氨基化PGMA对高氯体系中Pb(Ⅱ)吸附性能研究
张燕青,杨淑娟,成喜峰,胡长峰
(呼和浩特职业学院生物化学工程学院,内蒙古呼和浩特 010051)
铅是一种无机环境激素,在人体内聚集到一定程度就会影响人的正常代谢活动,对人体造成严重危害[1]。环境中的铅可经过食物或者呼吸等途径进入人体,引起生殖、呼吸、消化、神经和免疫系统毒性影响,也会损害肝脏、肾脏、生殖系统和脑部功能,我国已将铅及其化合物列入优先控制污染物[2],最高允许排放浓度为1.0 mg/L。水体中的铅主要来源于油漆、涂料、有色金属冶炼及加工、蓄电池、农药及汽车尾气等。此外,工业含铅废水中由于盐酸的广泛使用而含有大量的氯离子,氯离子的存在影响铅离子的去除效果,所以这种含有大量氯离子,且氯离子浓度相对铅离子浓度较大的体系(以下简称高氯体系)中含铅废水的处理极为重要。目前处理含铅废水的方法主要有化学沉淀法[3]、离子交换法[4]、电解法[5]及吸附法等。其中,吸附法具有工艺简单、成本低及操作方便等优点。对于去除含铅废水的吸附剂,国内外研究者已进行了一些探索研究工作,Vassileva等[6]研究了以纳米二氧化铈为吸附剂,Liu等[7]制得胺功能化的磁性壳聚糖复合材料,用于吸附 Cu2+、Pb2+和 Cd2+等。
甲基丙烯酸缩水甘油酯(GMA)是一种功能性单体,用于制备多种功能高分子材料PGMA,其中研究最广泛的是PGMA微球。氨基化的PGMA可以作为多种物质的吸附剂,Bayramoglu等[8]报道了乙二胺修饰的聚甲基丙烯酸缩水甘油酯与甲基丙烯酸甲酯共聚的高分子微球用于吸附溶液中的铬离子。陈志萍等[9]探讨了氨基化PGMA交联微球对胆红素的吸附机理。关于氨基化的PGMA微球对高氯体系中Pb(II)的吸附性能还需要进一步研究。
本实验采用改进的分散聚合法[10]合成聚甲基丙烯酸缩水甘油酯高分子微球(PGMA),并通过氨解反应使其表面氨基化,进而详细考察了氨基化的聚甲基丙烯酸缩水甘油酯高分子微球(PGMA-NH2)对高氯体系中少量Pb(II)的吸附性能。
1 实验部分
1.1 试剂与仪器
甲基丙烯酸缩水甘油酯(GMA,纯度>99%,经减压蒸馏除去阻聚剂);二甲基丙烯酸乙二醇酯(EGDMA)、乙二胺(EDA)、氯化铅、NaCl均为分析纯;聚乙烯醇(PVA,聚合度为2 200)、偶氮二异丁腈(AIBN)均为化学纯;D201、D318阴离子交换树脂。
H1 2221 Calibration Check PH/ORP Meter;Optima 5000DV等离子体发射光谱仪;KQ-300DE超声波清洗器;SHZ-28A水浴摇床;HC-3018高速离心机;D2x-6050B真空干燥箱;THZ-C恒温振荡器;XW-80A旋涡混合仪;S-3400N型扫描电镜。
1.2 吸附剂制备
1.2.1 PGMA微球的制备 采用改进的分散聚合法,将一定量的PVA溶于质量分数为10%NaCl水溶液,构成连续相水相,加入到装有冷凝管、搅拌器及N2进气管的四口瓶中,并加热到50℃。将10 mL GMA和EGDMA(二者摩尔比为10∶1)混溶,构成分散相,加入水相中,搅拌回流30 min,使有机相充分分散在水相中,反应中以氮气为保护气体。加入0.1 g引发剂AIBN,在搅拌下将体系温度升高至70℃。氮气保护下在120 r/min转速下反应10 h。反应终止后,将微球滤出,分别用蒸馏水、乙醇多次洗涤,微球于50℃真空干燥,备用。
1.2.2 PGMA-NH2的制备 PGMA 中的环氧基团和乙二胺(EDA)发生开环反应引入氨基。2 g干燥的PGMA微球在60℃用50 mL水和50 mL乙二胺搅拌反应12 h。实验过程中采用氮气保护。反应后,颗粒经过蒸馏水多次洗涤,除去多余的乙二胺,真空干燥,备用。
1.3 吸附实验
取适量NaCl、标准氯化铅溶液,于25 mL容量瓶中定容,然后转移至锥形瓶中,分别加入一定量的PGMA-NH2,使用数控超声波清洗器使溶液与颗粒混合均匀,放入到恒温振荡箱中,30℃,转速为200 r/min,振荡2 h后取出过滤,吸附后溶液中的Pb2+浓度采用电感耦合等离子体发射光谱(ICP)测定。吸附过程中溶液的酸度采用醋酸-醋酸钠缓冲体系控制,分别采用0.2 mol/L NaAc和0.3 mol/L HAc根据不同比例配制不同pH的缓冲溶液。吸附容量q计算式如下:

式中 C0—— Pb2+初始浓度,mg/L;
Ce——吸附平衡时溶液中 Pb2+浓度,mg/L;
V——水相体积,mL;
W——吸附剂用量,g。
除温度实验外,其它的吸附实验均在303 K的条件下进行。
1.4 PGMA-NH2中氨基含量的测定
取标定好的盐酸溶液25 mL和0.1 g PGMANH2固体(30~50 μm)于恒温振荡箱中,设定转速为200 r/min,温度为30℃,恒温振荡1 h。取3 mL产物于锥形瓶中,滴入溴甲酚绿指示剂,用标定好的氢氧化钠溶液进行准确滴定。
氨基含量(mmol/g)

本实验PGMA-NH2中氨基含量为6.65 mmol/g。
2 结果与讨论
2.1 样品的形貌与结构
高分子微球PGMA和PGMA-NH2的扫描电镜照片见图1。

图1 PGMA及PGMA-NH2微球的扫描电镜照片Fig.1 SEM photographs of PGMA and PGMA-NH2microspheres
由图1可知,PGMA微球颗粒的单分散性很好,其粒径约为3.0 μm,氨基化的微球PGMA-NH2形貌基本未发生变化,其粒径稍有缩小,为2.5 μm左右。
2.2 pH值对Pb(II)吸附的影响
在以下条件,t=2 h,T=303 K,CPb=100×10-6,CCl-=1 mol/L,W=20 mg,酸度对 PGMA-NH2高分子微球吸附Pb(Ⅱ)的影响见图2。

图2 pH对PGMA-NH2微球吸附Pb(Ⅱ)的影响Fig.2 Effect of pH value on the adsorption of Pb(Ⅱ)
由图2可知,吸附量随pH值的增加而增大。主要原因与Pb(II)以及吸附剂表面的活性官能团的存在形式有关。水体中Pb2+通常以Pb(OH)-、Pb(OH)2和Pb(OH)3-三种形式存在,平衡反应如下:
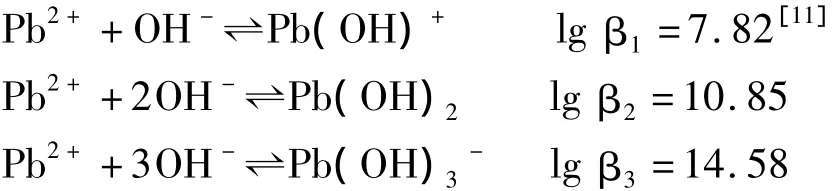
氨基化的PGMA高分子微球的活性官能团为—NH2,吸附剂表面的官能团 —NH2的存在形式随着溶液中酸度的不同而不同。文献[12]报道,当pH较低时,—NH质子化作用较强,—NH以 —N22形式存在;但是当pH较高时,—NH2的质子化作用减弱,主要以 —NH2的形式存在。由图2还可知,Pb(II)的吸附主要发生在pH>5.5的条件下,这表明吸附机理可能是中性分子和游离的 —NH2的络合作用机理。因此,我们认为是中性分子Pb(OH)2通过与游离的 —NH2的络合作用而实现吸附。随着pH的增加,溶液中Pb(OH)2的浓度增加,有利于PGMA-NH2高分子微球对Pb(II)的吸附,双重原因使吸附容量随溶液pH值增加而增大。
2.3 Pb(II)吸附等温线
为了估算 PGMA-NH2高分子微球对废水中Pb(II)的最大吸附容量,在以下条件,t=2 h,pH=6.4,T=303 K,CCl-=1 mol/L,W=20 mg,考察了 Pb(II)平衡浓度对吸附的影响,结果见图3。
由图3可知,随平衡浓度的增大,PGMA-NH2高分子微球对高氯体系中的Pb(II)吸附量逐渐增大,但是目前实验条件下未得到饱和吸附容量值,预计其饱和吸附容量值>374.1 mg/g。吸附等温线通常用以下两种的等温方程模型进行拟合,表1给出了吸附等温模型各常数的拟合结果。

图3 平衡浓度对PGMA-NH2微球吸附Pb(II)的影响Fig.3 Effect of equilibrium concentration on the adsorption of Pb(II)
Langmuir模型:

Freundlich模型:

式中 qe——平衡吸附量,mg/g;
qm——饱和吸附容量,mg/g;
k——吸附平衡解离常数;
n,kf——与吸附相关的经验常数。

表1 吸附等温模型拟合结果Table 1 Fitting result of Freundlich and Langmuir isotherms
Freundlich模型中,n-1与吸附剂-吸附质之间的亲和力相关,0<n-1<1时,表示数据符合 Freundlich 模型[13]。
由表1可知,Pb(II)在PGMA-NH2高分子微球表面的吸附能较好地符合Freundlich等温吸附方程。由此认为所合成的PGMA-NH2高分子微球表面存在吸附位点,对Pb(II)有较好的吸附能力。
2.4 时间对Pb(II)吸附的影响
吸附动力学可以解释吸附反应的路径和反应机理,因此我们考察了吸附时间对PGMA-NH2高分子微球吸附Pb(II)的影响,吸附条件为:pH=6.4,T=303 K,CPb=50 ×10-6,CCl-=1 mol/L,W=20 mg,结果见图4。

图4 时间对PGMA-NH2微球吸附 Pb(Ⅱ)的影响Fig.4 Effect of time on the adsorption of Pb(Ⅱ)
由图4可知,PGMA-NH2高分子微球对Pb(Ⅱ)的吸附随时间的增加迅速增加,2 h内可达到平衡。延长接触时间,吸附量变化不大,保持在70 mg/g左右。与文献[13]报道的PGMA-NH2对Cr(VI)吸附变化规律相似,主要原因可能是PGMA-NH2高分子微球的表面含大量 —NH2活性位点。金属离子在吸附剂上的动力学行为常用准一级和准二级动力学模型进行模拟,拟合结果见表2。
由表2可知,二级模型的相关系数为0.999 7,平衡吸附量为70.54 mg/g,与实验值69.93 mg/g接近,说明PGMA-NH2高分子微球对于Pb(II)的吸附过程符合准二级动力学模型,即吸附剂和吸附质之间通过电子交换或共享而发生的化学反应是吸附反应的速控步骤[14]。

表2 吸附动力学模型拟合结果Table 2 The model fitting result of adsorption kinetic
2.5 温度对Pb(II)吸附的影响
反应条件:t=2 h,pH=6.4,CPb=50 × 10-6,CCl-=1 mol/L,W=20 mg,温度对 Pb(II)吸附的影响见图5。

图5 温度对PGMA-NH2微球吸附Pb(II)的影响Fig.5 Effect of temperature on the adsorption of Pb(II)
由图5可知,PGMA-NH2高分子微球对Pb(II)的吸附量随温度的增加而下降。说明PGMA-NH2高分子微球对Pb(II)的吸附为放热过程,温度较低有利于吸附。
2.6 吸附剂用量对Pb(II)吸附的影响
反应条件:t=2 h,pH=5.4,T=303 K,CPb=100 ×10-6,CCl-=1 mol/L,吸附剂用量对 Pb(II)吸附的影响见图6。

图6 吸附剂加入量对Pb(II)吸附的影响Fig.6 Effect of dosage on the adsorption of Pb(II)
由图6可知,吸附容量随吸附剂用量的增加逐渐增大,这是由于随着吸附剂用量的增加,吸附剂表面可供利用的活性位点增多,而在当前实验条件下,Pb(II)浓度一定且相对于吸附剂来说是过量的,因此活性位点的增加将导致吸附容量的增加[15]。
2.7 Cl-浓度对 Pb(II)吸附的影响
反应条件:t=2 h,pH=6.4,T=303 K,CPb=50×10-6,W=20 mg,考察了 Cl-对 PGMA-NH2高分子微球吸附Pb(Ⅱ)的影响,结果见图7。
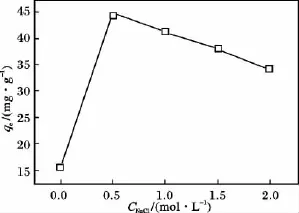
图7 Cl-浓度对Pb(II)吸附的影响Fig.7 Effect of Cl- concentration on the adsorption of Pb(II)
由图7可知,溶液中不含Cl-时,吸附容量较小;随Cl-浓度增加,吸附容量先增加然后减小,Cl-浓度为0.5 mol/L左右,吸附容量达到最大。主要原因可能是由于高氯体系中Pb2+有多种存在形式,平衡反应如下:

随着Cl-浓度的增加,溶液中PbCl2逐渐增多,吸附容量会逐渐增大。当 Cl-浓度 >0.5 mol/L,PbC逐渐增多,而PbCl2逐渐减少,所以吸附容量会随Cl-浓度变化而先增加后减小。
2.8 高氯体系中不同吸附剂对Pb(II)吸附比较
D201和D318均为具有大孔结构的阴离子交换树脂,广泛用于废水处理、重金属回收中[16-17]。市售的D201和D318经4%NaOH和4%HCl依次处理后,与制得的PGMA-NH2高分子微球在相同条件下吸附高氯体系中的Pb(II),结果见图8。反应条件:pH=6.4,T=303 K,CPb=100 × 10-6,CCl-=1 mol/L,W=20 mg。

图8 不同吸附剂对Pb(Ⅱ)吸附比较Fig.8 The adsorption of Pb(Ⅱ)of different adsorbent
由图8可知,PGMA-NH2高分子微球对Pb(II)的吸附在几小时内最先达到平衡,吸附容量明显大于D201和D318;D201几乎不吸附Pb(II);D318对Pb(II)的吸附随时间的增长,吸附容量逐渐增加。由此认为,PGMA-NH2高分子微球吸附高氯体系中Pb(II)的性能优于D201和D318。
3 结论
(1)通过改进的分散聚合法制备了单分散的PGMA-NH2高分子微球,其表面存在丰富的活性基团—NH2,对高氯体系中的Pb(II)有良好的吸附性能,其吸附等温线符合Freundlich方程,吸附动力学符合准二级动力学方程。
(2)随 pH值升高,PGMA-NH2高分子微球对Pb(II)的吸附量增大。相同条件下,含氯体系中Pb(II)的吸附容量高于无氯体系中Pb(II)的吸附容量,但是吸附容量随着Cl-浓度的增加而下降,在Cl-浓度为0.5 mol/L时,吸附容量达到最大。推测,吸附机理为 —NH2和中性分子 PbCl2或者Pb(OH)2的络合作用。该吸附过程为放热反应,温度较低有利于吸附。
(3)PGMA-NH2高分子微球从高氯体系中吸附Pb(II)的性能优于商业树脂D201和D318,表明该吸附剂用于吸附高氯体系中Pb(II)具有良好的应用潜能。
[1]王玲玲,闫永胜,邓月华,等.铅离子印迹聚合物的制备、表征及其在水溶液中的吸附行为研究[J].分析化学,2009,37(4):537-542.
[2]周文敏,傅德黔,孙宗光.水中优先控制污染物黑名单[J].中国环境监测,1990,6(4):1-3.
[3]陈胜利,郭学益,李钧,等.镍电解液中杂质铅和锌的行为及脱除方法[J].有色金属(冶炼部分),2008(6):6-8.
[4]Rao K Srinivasa,Dash P K,Sarangi D,et al.Treatment of wastewater containing Pt and Fe using ion-exchange techniques[J].Journal of Chemical Technology and Biotechnology,2005,80(8):892-898.
[5]封明,雷小利.电解法在废水处理中的应用[J].电镀与精饰,2013,35(1):43-46.
[6]Vassileve E,Varimezova B,Hadjiivanov K.Column solidphase extraction of heavy metal ions on a high surface area CeO2as a preconcentration method for trace determination[J].Anal Chim Acta,1996,336(1/2/3):141-150.
[7]Liu X,Hu Q,Fang Z,et al.Magnetic chitosan nanocomposites:A useful recyclable tool for heavy metal ion removal[J].Langmuir,2008,25(1):3-8.
[8]Bayramoglu G,Arica M Y.Ethylenediaminegrafted poly(glycidylmethacrylate-co-methylmethacrylate)adsorbent for removal of chromate anions [J].Sep Purif Technol,2005,45(3):192-199.
[9]陈志萍,高保娇,杨晓峰.氨基化PGMA交联微球对胆红素的吸附机理[J].物理化学学报,2008,24(8):1417-1424.
[10]王伟财,张琦,张兵波,等.氨基化单分散超顺磁荧光PGMA多功能微球制备[J].科学通报,2007,52(21):2477-2481.
[11]李梦龙,浦雪梅.分析化学数据速查手册[M].北京:化学工业出版社,2009:84-85.
[12]尹甲兴,王雪兆,齐连怀,等.氨基化磁性纳米粒子的制备及其对Pb2+吸附性能研究[J].功能材料,2013,44(17):2511-2515.
[13]李鹏飞,杨良嵘,李文松,等.氨基功能化超顺磁性PGMA高分子微球去除废水中的铬(VI)[J].过程工程学报,2011,11(4):554-560.
[14]Wang Fuchun,Zhao Junmei,Wei Xuetuan,et al.Adsorption of rare earths(III)by calaium alginate-poly glutamic acid hybrid gels[J].Journal of Chemical Technology and Biotechnology,DOI:10.1002/jctb.4186,2013.
[15]汪婷,高滢,金晓英,等.纳米四氧化三铁同步去除水中的 Pb(Ⅱ)和 Cr(III)离子[J].环境工程学报,2013,7(9):3476-3482.
[16]白国华,李建臣,张国范,等.D201树脂吸附钒(V)的行为研究[J].矿冶工程,2010,30(5):62-65.
[17]Shu Zengnian,Yang Minghua.Adsorption of rhenium(VII)with anion exchange resin D318[J].Chinese Journal of Chemical Engineering,2010,18(3):372-376.

