急性低压缺氧对大鼠肾组织中生化指标变化的研究
王 喆,郭广进,熊 敏,牛天慧
(空军总医院临床航空医学中心实验室,北京 100142)
急性低压缺氧对大鼠肾组织中生化指标变化的研究
王 喆,郭广进,熊 敏,牛天慧
(空军总医院临床航空医学中心实验室,北京 100142)
目的 观察急性低压缺氧对大鼠肾组织中超氧化物歧化酶(SOD)、丙二醛(MDA)、还原型谷胱甘肽(GSH)、过氧化氢酶(CAT)及内皮素(ET-1)和肿瘤坏死因子(TNF-α)的影响。方法 将24只雄性Wistar大鼠,体重180~220 g,随机分成地面对照组和急性低压缺氧组,急性低压缺氧组又分成缺氧1组和缺氧2组,每组8只。急性低压缺氧后10 min和24 h处死动物,迅速取出肾脏进行生化指标的检测,并采用免疫组织化学方法观察肾组织内皮素(ET-1)和肿瘤坏死因子(TNF-α)的表达情况。结果 急性低压缺氧后,大鼠肾组织中SOD活性明显下降(P<0.01),缺氧1组CAT活性极显著降低(P<0.01),缺氧2组GSH活性显著降低(P<0.05),但MDA含量无明显变化(P >0.05)。免疫组织化学染色显示,ET-1和TNF-α表达均明显增强,24 h后表达减弱。结论SOD、CAT和GSH活性明显下降及ET-1及TNF-α表达明显增强,可能参与了缺氧性肾损伤的病理过程。
急性低压缺氧;超氧化物歧化酶;丙二醛;还原型谷胱甘肽;过氧化氢酶;内皮素;肿瘤坏死因子
飞行员或初次进入高原的指战员在意外情况下会遭受急性低压缺氧的影响。急性低压缺氧对机体可产生多种影响,但主要集中在心脏、大脑及肝功能的研究,国内曾报道急性低压缺氧对大鼠肾功能和肾脏结构均有损害[1-3]。有关低压缺氧对大鼠肾组织生化指标变化的研究报道较少。本实验研究超氧化物歧化酶(superoxide dismutase,SOD)、还原型谷胱甘肽(glutathione,GSH)、过氧化氢酶(catalase,CAT)、丙二醛(malondialdehyde,MDA)在低压缺氧大鼠肾组织中的变化,并采用免疫组织化学方法观察肾组织内皮素(Endothelin,ET-1)和肿瘤坏死因子(tumor necrosis factor alpha,TNF-α)的表达情况,为进一步阐明低压缺氧条件下肾损伤的机制提供依据,这方面的工作将有助于从更深层次阐明高空缺氧对人体的影响,从而建立更加有效的预防方法。
1 材料和方法
1.1 实验动物及分组
24只雄性SPF级Wistar大鼠,体重180~200 g,购自军事医学科学院实验动物中心,许可证号[SCXK(军)2007-004]。动物饲养在屏障系统内,许可证[SYXK(军)2007-008]。动物适应性饲养1周后,开始正式实验。将大鼠随机分成地面对照组和急性低压缺氧组,低压缺氧组又分成缺氧1组(缺氧后10 min)和缺氧2组(缺氧后24 h),每组8只。
1.2 仪器及试剂
动物低压舱(空军航空医学研究所研制),UV-2201紫外分光光度计(日本岛津),高速冷冻离心机(上海安亭科学仪器厂),SOD、CAT、GSH和MDA检测试剂盒(批号:20130618,南京建成生物工程研究所),ET-1多克隆抗体和TNF-α单克隆抗体(北京邦定公司提供)。
1.3 急性低压缺氧实验
将低压缺氧组大鼠放入动物低压舱后,以30 m/s的速度模拟上升至8000 m,停留30 min后,造成缺氧。然后以30 m/s的速度下降至地面[4]。对照组同时放入另一实验条件完全相同的动物低压舱30 min,不进行低压缺氧。
1.4 观察指标
1.4.1 肾组织生化指标的测定:各组大鼠均在出舱后的时间点处死。所有动物均用速眠新Ⅱ与氯胺酮复合麻醉致死,迅速取出同侧肾脏,浸入冰生理盐水中洗净残余血迹,滤纸吸干,剪取1 g组织,按W/V=1/9加入预冷的生理盐水,匀浆后放入4℃的冷冻离心机,以3 000 r/min离心15 min,取上清液分别用于SOD、CAT、GSH、MDA的测定,肾组织中SOD、CAT活性及GSH、MDA含量测定的方法详见南京建成生物工程研究所提供的测定试剂盒要求进行操作。
1.4.2 免疫组织化学染色检测:采用SP法检测各组大鼠肾组织ET-1和TNF-α的表达[5]。取每组大鼠左肾组织,石蜡包埋切片,厚2μm,烤片2 h,常规脱蜡至水,加0.1%Triton X-100常温下处理10 min,3%过氧化氢-甲醇溶液处理15 min,10% 山羊血清封闭15 min,分别加ET-1多克隆抗体和TNF-α单克隆抗体孵育,4℃过夜。16 h后加二抗,37℃处理30 min。DBA显色,苏木素复染,经二甲苯透明后中性树胶封片。组织呈黄褐色为ET-1和TNF-α阳性染色。
1.5 统计学方法
2 结果
2.1 肾组织生化指标变化
与正常对照组比较,低压缺氧组SOD活性极显著降低(P<0.01),缺氧2组GSH活性显著降低(P<0.05),缺氧1组CAT活性极显著降低(P<0.01),MDA含量组内和组间比较均无显著变化(P>0.05)(表1)。
2.2 免疫组织化学检测结果
在正常对照组,ET-1和TNF-α的表达极低,缺氧1组有明显表达,缺氧2组表达减弱(彩插5图1)。
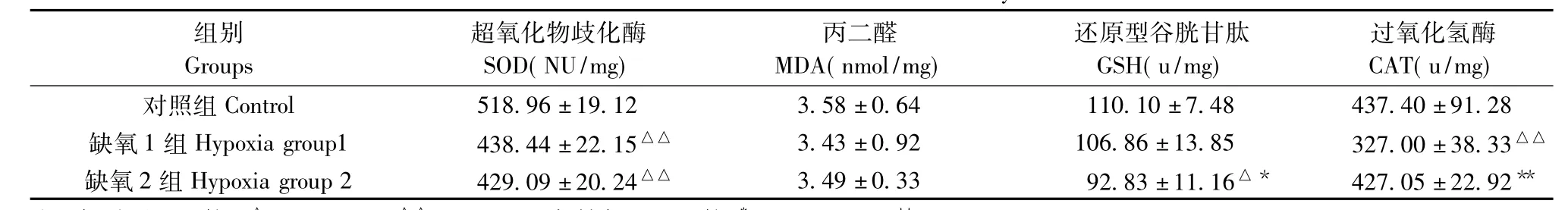
表1 大鼠肾组织生化指标的变化Tab.1 Variations of biochemical index in the kidneys tissues of rats
3 讨论
我国青藏高原平均海拔4500 m,自然环境十分恶劣,严重威胁高原居民和部队官兵的身心健康和作业能力。应用低压低氧环境模拟装置开展高原医学的研究具有一定的现实意义。大型复合低压舱的研制成功,为高原环境下军地人员作业能力的医学保障研究提供了一种实验平台[6]。小型动物低压舱的应用,为开展许多高原医学的研究提供了结构简单、成本低、实用、稳定的低压低氧环境,我们应用动物低压舱进行动物实验工作,均取得良好的实验效果。
在正常生理条件下,处于平衡状态下的自由基浓度很低,不但不会对机体造成损伤,而且还具有细胞信号调节、代谢、生存和凋亡等重要的生理功能。但是,当环境中的物理因素或外源化学物质直接或间接诱导产生的大量自由基超过了机体的清除能力,或内源性自由基产生和清除失去平衡,使机体处于氧化应激状态中。自由基可与生物大分子共价结合和使生物膜脂质过氧化而产生各种毒性效应,从而损害细胞的结构与功能,导致许多疾病的发生与发展。为保护机体免受过氧化损伤,细胞形成一套复杂的抗氧化酶防御系统,这个系统主要包括SOD、CAT、GSH等,其中SOD把超氧阴离子()转换为过氧化氢(H2O2),CAT再把H2O2转化为水,从而有毒性的和H2O2均被转化为无害的水分子;GSH在被催化下,实现向氧化型谷胱甘肽的转变,使氧化型物质还原,解除其毒性[7]。低压缺氧后动物血液及某些脏器的脂质过氧化反应增强,脂质过氧化产物MDA含量能直接反映体内脂质过氧化的强度和速度。国外报道大鼠血中MDA的浓度随缺氧时间延长而增加。国内也有报道9000 m重度缺氧主要造成心、脑、肺的过氧化损伤,而肝肾不明显。这可能与前3种组织主要是以有氧代谢为主有关[8]。
关于急性低压缺氧引起肾损伤的确切机制,目前还不十分清楚。从本研究结果看,在急性低压缺氧后,肾组织中的SOD、GSH和CAT活性显著降低,说明肾脏的抗脂质过氧化能力已有显著减退,所引起的氧自由基代谢失衡是诱发肾损伤的主要原因。但MDA含量无显著变化,这些结果与俞启福等报道相一致[9],说明急性低压缺氧应激刺激对肾组织MDA含量影响不明显。
ET-1是血管内皮细胞、支气管粘膜上皮细胞分泌,具有较强的缩血管活性。缺氧可使ET合成增加。已知肾血管对ET的缩血管效应比其他血管床敏感10倍[10]。TNF-α受体存在血管内皮细胞表面,当TNF-α在血液中异常增生时,可损伤血管内皮细胞,造成血管内皮细胞形态改变,细胞膜及细胞器损害等[11-12]。肾组织中的TNF-α可来源于循环血中的白细胞,也可来源于肾小球固有的系膜细胞、肾小球脏层上皮细胞和肾小球上皮细胞。本实验对肾组织ET-1和TNF-α表达的情况发现:急性低压缺氧组的表达明显强于正常对照组。这可能说明急性低压缺氧引起的肾损伤可产生更多的细胞因子,ET-1和TNF-α既是其中的两种。有关细胞因子在肾损伤中的作用机制今后还需进一步研究。
[1]李文斌,王荣,谢华,等.急进4010m实地高原Wistar大鼠生理学和病理学变化研究[J].国际病理科学与临床杂志,2012,32(3):185-192.
[2]张蕾,谢林伸,樊均明.高原低压缺氧对肾脏的影响及藏药红景天的应用[J].中国中西医结合肾病杂志,2008,9(5):459-461.
[3]戴雨,王喆,纪桂英,等.低压缺氧对肾脏功能和结构的影响[J].航空军医,1997,25(3):3-4.
[4]尹世敏,俞启福,郝唯蔚,等.神经节苷脂对老龄大鼠急性低压缺氧脑损害的防治作用[J].中华航空航天杂志,2000,11 (1):36-38.
[5]周敬,潘兴华,庞荣清,等.兔慢性肾功能衰竭模型的建立与评价[J].中国比较医学杂志,2010,20(10):48-51.
[6]许永华,张琼,曹金军,等.创建大型复合低压舱扩大医学实验平台种类[J].中国比较医学杂志,2012,22(7):60-63.
[7]辛益妹,张清俊,葛华,等.复方红景天提取物对大鼠+Gz暴露后血清超氧化物歧化酶活性和丙二醛含量的影响[J].中华航空航天杂志,2012,23(3):188-191.
[8]郑晓惠.高空低压和缺氧生理学研究进展[J].航空军医,2002,30(3):126-129.
[9]俞启福,杨晔,李庆棣,等.血小板活化因子拮抗剂对急性低压缺氧肾损害的防护效应[J].中华航空航天医学杂志,1996,7(2):75-78.
[10]Cantley LG,Spokes K,Clark B,et al.Role of endothelin and prostaglandins in radiocontrast-induced renal artery constriction[J].Kidney Int,1993,44(6):1217.
[11]Goldblum SE,whining B,Jay M,et al.Tumor necrosis factor induced Pumonary vascular endothelial injury[J].Infect Inrum,1989,57:1218-1225.
[12]徐望明,杨菁,谢青贞,等.肿瘤坏死因子α与妊娠高血压综合征发病关系的研究[J].中华医学杂志,2000,80:271 -274.
The study of acute hypobaric hypoxia on variation biochem ical index of renal tissue in rats
WANG Zhe,GUO Guang-jin,XIONG Min,NIU Tian-hui
(Aviation Medicine Research Lab,General Hospital of Air Force,Beijing 100142,China)
Objective To observe the effect of superoxide dismutase(SOD),malondialdehyde(MDA),glutathione(GSH),catalase(CAT)and endothelin(ET-1)and tumor necrosis factor alpha(TNF-α)on rat renal tissue under acute hypoxia.M ethods 24 male Wistar rats,weight180~220 g,were random ly divided into control group and acute hypobaric hypoxia group.Acute hypoxia group was divided into 2 groups hypoxia 1 and hypoxia 2,8 rats for each group.After acute hypobaric hypoxia 10min and 24h,rats were sacrificed.The left removed kidneys were analyzed for biochemical indexes,and the right parts were observed by immunohistochemistry to evaluate the expression level of renal endothelin(ET-1)and tumor necrosis factor alpha(TNF-α).Results After acute hypobaric hypoxia,the activity of SOD of the rats kidney was greatly decreased(P <0.01),CAT activity of hypoxia group 1 was significantly decreased(P <0.01),GSH activity of hypoxia group 2 was significantly decreased(P <0.05),but the MDA content had no obvious change(P >0.05).The immunohistochemical staining showed that,the expression level of ET-1 and TNF-αwas increased remarkably,but itwas reduced after 24 h.Conclusion The obviously decreased activity of SOD,CAT,GSH and significantly increased expression of ET-1 and TNF-α,may be involved in the pathogenesis of renal hypoxic injury.
Acure hypobaric hypoxia;Superoxide dismutase;Malondialdehyde;Glutathione;Catalase;Endothelin;Tumor necrosis factor alpha
R332
A
1671-7856(2014)03-0030-04
10.3969.j.issn.1671.7856.2014.003.007
空军总医院面上项目(KZ2012041)。
王喆(1960-),男,副主任医师,从事动物实验工作。E-mail:wangzhe6019@sohu.com。
牛天慧(1981-),女,博士,从事分子生物学工作。E-mail:niuhui81@126.com。
2014-02-21
·征稿启事·

