基于冷冻熔炼的液-液萃取/气相色谱法测定啤酒中的N-二甲基亚硝胺
彭俏容, 唐 涛, 于淑新, 孙元社,雷 武, 王风云, 张维冰, 李 彤*
(1.南京理工大学,江苏南京210094;2.大连依利特分析仪器有限公司,辽宁大连116023;3.华东理工大学,上海200237)
亚硝胺类化合物具有强致癌性,迄今已发现的亚硝胺有300多种。目前在橡胶制品[1]、乳胶儿童用品[2]、腌制水产品[3]、肉制品及啤酒中已检测到不同种类和浓度的亚硝胺物质;其中N-二甲基亚硝胺(N-nitrosodimethylamine,NDMA)是极具代表性的物质之一[4,5]。啤酒在酿造过程中生成的微量亚硝胺主要包括二甲基亚硝胺和吡咯烷亚硝胺[6]。对于啤酒中 NDMA的检测,国家标准 GB/T 5009.26-2003[7]采用常规液-液萃取法。该方法作为一种传统的前处理技术,能较好地完成目标组分的分离[8],但通常需要多次萃取才能保证回收率,并需要进一步的转移、浓缩,操作较为繁琐。
随着现代科学技术的进步,超高压萃取[9]、超临界流体萃取[10]、加速溶剂萃取[11]等新型萃取技术得到了较快的发展。该类技术具有萃取时间短、效率高、绿色环保等优点,但由于装置专用性及价格因素的影响,在应用上受到限制[12]。
冷冻熔炼液-液萃取是液-液萃取与区域熔炼技术的结合,是一种简单、高效的高压萃取技术[13],目前在食品和环境中农药残留[14-16]、药物残留的分析中常用来除去杂质、富集低浓度水平的目标化合物。利用目标化合物和脂肪、蛋白质等物质在熔点上的差别,低温下这些干扰物会在水相中凝结成冰,目标化合物则在有机相中富集,从而可以得到比较干净的样品[17]。Goulart等[18]使用低温分配液-液萃取技术对水体中3种氨基甲酸酯类农药进行提取,仅消耗4 mL有机溶剂,回收率在90%~96%之间。Rübensam 等[19]利用液-液萃取/冷冻纯化前处理方式对牛奶中5种大环内酯类抗生素进行提取,与普通的液-液萃取方法相比,减少了有机溶剂中的共萃取物。
本文基于上述冷冻熔炼液-液萃取的原理,采用高压熔炼萃取釜,建立了一种对啤酒中NDMA进行直接萃取、GC-FID分析的测定方法;优化了前处理条件,完成了方法验证。本文为该种新型前处理技术的推广提供了技术依据。
1 实验部分
1.1 仪器、试剂与材料
GC7890Ⅱ气相色谱仪,配氢火焰离子化检测器(上海天美科学仪器有限公司);高压熔炼萃取釜(杭州普普科技有限公司);旋转蒸发仪(上海新苗医疗器械制造有限公司);氮吹仪(河南爱博特科技发展有限公司)。
N-二甲基亚硝胺(纯度100%,美国 AccuStandard公司);二氯甲烷、无水乙醇、氯化钠(分析纯,天津市科密欧化学试剂有限公司);啤酒(市售)。实验所用水均为Milli-Q超纯水。
1.2 标准溶液的配制
用无水乙醇溶解适量的N-二甲基亚硝胺标准品得到标准储备液。分别移取适量体积的储备液,用无水乙醇稀释配成 5.0、10、50、100、150、200 mg/L系列浓度的标准工作液。于避光、4℃下冷藏保存。
1.3 样品前处理方法
1.3.1 冷冻熔炼液-液萃取法
分别量取90 mL啤酒样品(预先脱气处理)和10 mL二氯甲烷置于250 mL具塞三角瓶中,加9 g氯化钠,超声10 min。将混合液加入到高压熔炼萃取釜中,用二氯甲烷填充以排尽空气,密封。将萃取釜放入-19℃的冷冻室冷冻16 h后取出;取有机相,经0.45 μm滤膜过滤,滤液供分析。
1.3.2 国家标准方法(GB/T 5009.26-2003)
取50 mL啤酒于真空低温下蒸馏,收集的蒸馏液用60 mL二氯甲烷分3次液-液萃取。合并萃取液,旋转蒸发浓缩至10 mL,氮吹定容至1 mL后供分析。
1.4 色谱条件
色谱柱:TM-WAX毛细管柱(30 m×0.53 mm×0.5 μm);TM-1毛细管柱(30 m ×0.53 mm ×0.5 μm);升温程序:初始温度为50℃,保持4 min,以5℃/min升至220℃,保持10 min。载气:高纯(纯度99.999%)氮气;流速:8 mL/min;进样口温度:220℃;检测器温度:250℃;进样量:6 μL,不分流进样。
2 结果与讨论
2.1 冷冻熔炼液-液萃取条件的选择和优化
冷冻熔炼液-液萃取是在液-液萃取基础上,利用密封体系内水凝结成冰产生的压力来提高萃取效率。其目标化合物的富集效率不仅与样品的基质有关,而且还受其他多种因素的影响。以加入20 mg/L NDMA标准品的啤酒样品为研究对象,探讨了两相比(样品与萃取溶剂的体积比)和冷冻时间对实验结果的影响,确定适合啤酒中NDMA提取的最佳冷冻熔炼液-液萃取条件。
2.1.1 两相比的选择
以二氯甲烷为萃取溶剂,分别考察两相比为1∶3、1∶1、3∶1、4∶1、9∶1 时的萃取效果,利用计算得到的回收率来度量萃取效果。结果见图1。
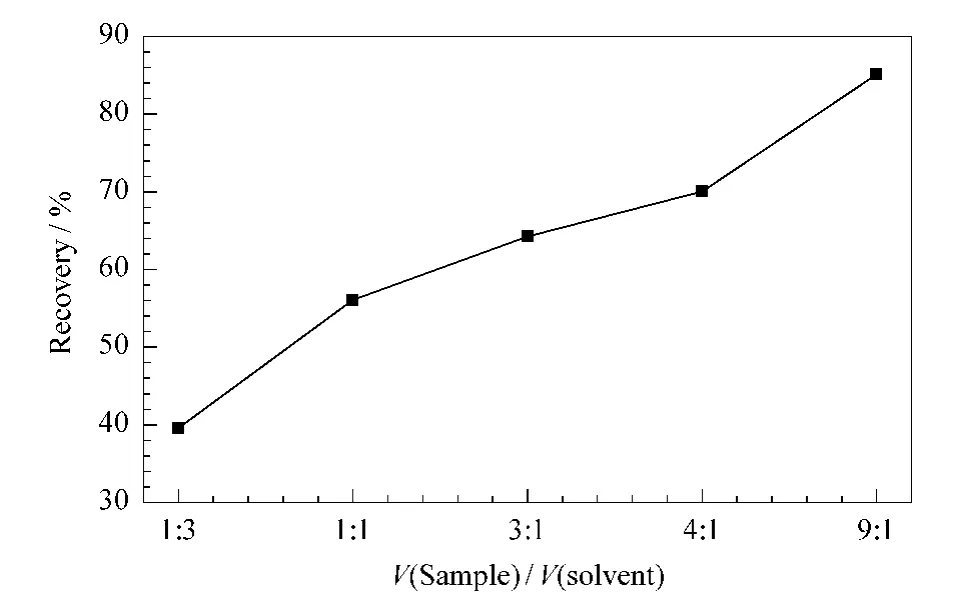
图1 样品与萃取溶剂的体积比对萃取效果的影响Fig.1 Effect of volume ratio of sample and solvent on the extraction yield
由图1可知,随着萃取釜内样品体积比例的增大,目标化合物的回收率增加。由于水凝固成冰体积会膨胀增大,使得容器中的压力增加,从而提高NDMA在有机溶剂中的溶解度;同时根据区域熔炼的原理,在水凝固成冰的过程中,水中的NDMA也可进一步溶解在有机溶剂中。从图1的曲线趋势来看,两相比继续增加,回收率增大。但两相比大于9∶1时,一方面会导致后续取样操作不便,另一方面由于水相比例远远高于有机相,会使两相的分离更加困难,会导致部分有机相溶于水相中,使回收的有机相体积减小,导致回收率降低。因此选择9∶1作为两相比。
2.1.2 冷冻时间
以二氯甲烷为萃取溶剂,在两相比为9∶1的条件下,分别考察冷冻时间为 8、12、14、16、18、20 h 的萃取效果。结果见图2。
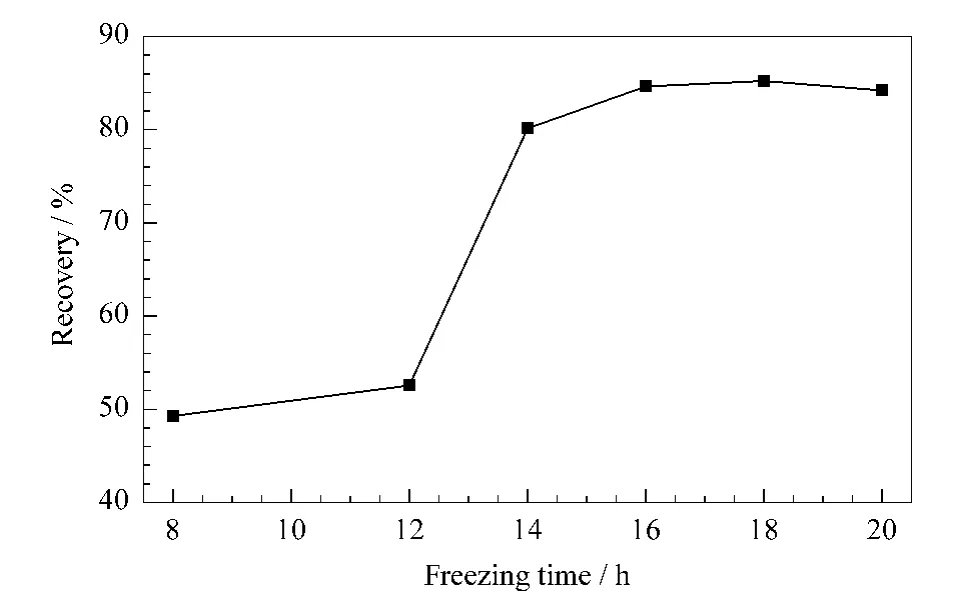
图2 冷冻时间对萃取效果的影响Fig.2 Effect of freezing time on the extraction yield
冷冻时间主要关系到水结成冰的体积分数。随着水结成冰的体积分数的增加,密封体系内压力增大,促进目标化合物向有机相转移,从而提高萃取效率。由图2可知,当冷冻时间小于12 h时,回收率仅为50%左右;当冷冻时间大于14 h,回收率在80%~90%之间,冷冻时间高于16 h后回收率变化很小。因此选择16 h作为冷冻时间。
另外,可以通过改变冷冻速率来调节冷冻时间。增大冷冻速率,可以减少冷冻时间;但过快的冷冻速率可能导致回收率降低。因此该因素应该通过相关实验结果进行选择。
2.2 方法学考察
2.2.1 线性范围和检出限
对于亚硝胺类化合物的分析,以FID为检测器时,仅以目标化合物在一种极性色谱柱上的保留值来判断该化合物的存在,可靠性不高。通常采用双柱定性法来提高定性能力。不同的物质在同一根色谱柱上可能会有相同的保留时间,但在两根不同极性的色谱柱上一般不可能有相同的保留时间。双柱定性就是利用这个原理来排除假阳性。分别用不同的毛细管柱获取两组对照数据,在原有TM-WAX(极性)毛细管柱基础上,结合TM-1(非极性)毛细管柱的保留时间结果来定性。
采用外标法定量,以目标化合物的质量浓度X为横坐标,峰面积Y为纵坐标做标准曲线。线性方程为Y=1.176X-1.044,线性相关系数为0.999 6,说明NDMA在5~200 mg/L(测试浓度)范围内具有良好的线性关系。
按3倍信噪比计算仪器的检出限(LOD)为0.51 mg/L;在空白样品中添加标准品,以10倍信噪比计算方法的定量限(LOQ)为1.26 mg/kg。
2.2.2 回收率和精密度
在空白啤酒样品中进行加标回收率测定。加标水平分别为20、10、5 mg/L,采用1.3.1节所述的前处理方法对样品进行处理,每个添加水平重复测定7次。由表1可知,NDMA的加标回收率可以满足痕量分析的要求,说明所建立的方法可行。

表1 空白啤酒样品中不同添加水平下NDMA的回收率及R SD(n=7)Table 1 R ecoveries and R SDs of NDMA spiked in a blank beer sample at different levels(n=7)
2.3 方法比较
按照1.3节所述的2种前处理方法(即冷冻熔炼液-液萃取和国家标准方法)对啤酒样品进行处理,对比考察实际样品的前处理效果。
由表2可知,90 mL啤酒经10 mL二氯甲烷一次冷冻熔炼液-液萃取可以达到60 mL二氯甲烷分3次液-液萃取的效果,且稳定性更好。实验过程发现,啤酒样品直接经二氯甲烷液-液萃取,两相界面存在严重的乳化现象,需采取必要的破乳方法才能进行后续的实验步骤。
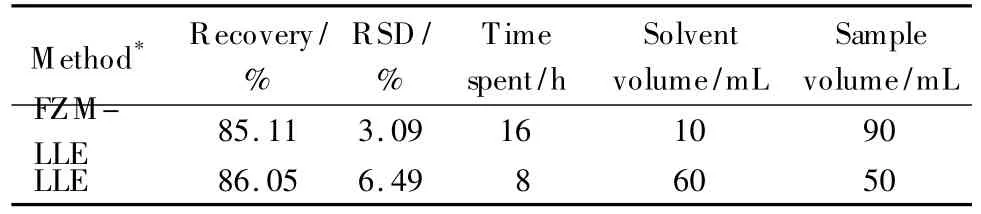
表2 两种前处理方法的比较Table 2 Comparison of two pretreatment methods
从样品整个前处理过程来看,2种前处理方法的差别主要表现在4个方面。
(1)前处理步骤。冷冻熔炼液-液萃取同时起到净化和浓缩的作用,冷冻过程结束后可直接取样进行分析。在国家标准方法中,液-液萃取后需要后续的浓缩步骤来富集目标化合物。由于NDMA易挥发,无论是旋转蒸发浓缩或者氮吹浓缩,都容易造成损失。国家标准方法中采用的旋转蒸发浓缩温度为55℃,但在该水浴温度下回收率偏低,目标化合物损失达60%,可能是由于蒸发速率过快所致;实验发现,水浴温度为30℃和39℃下,氮吹浓缩平均回收率仅为80%左右,损失都达到了约20%。减少前处理操作步骤,有利于获得可靠、稳定的实验结果。
(2)溶剂消耗量。液-液萃取需要3次单独的萃取过程,消耗60 mL有机溶剂。冷冻熔炼液-液萃取仅消耗10 mL萃取溶剂,这不仅降低了分析成本,同时还减少了操作人员与有害试剂的接触。
(3)操作时间。冷冻熔炼液-液萃取需要16 h的冷冻过程,但此期间冷冻装置可自动控制温度,操作人员可同时对多个样品进行处理,从而使单个样品的分析时间远远小于8 h。而常规的液-液萃取以及后续的浓缩步骤需对操作温度、压力、氮吹速率严格控制。
(4)实验设备。冷冻熔炼液-液萃取只需使用冷冻熔炼萃取釜,省去了常规分析中使用的玻璃仪器。
由上述比较可知,相比于常温液-液萃取,冷冻熔炼液-液萃取是一种简单、高效的高压萃取技术。
2.4 实际样品检测
利用建立的方法对啤酒样品、啤酒加标样品及标准品进行了分析,结果如图3所示。
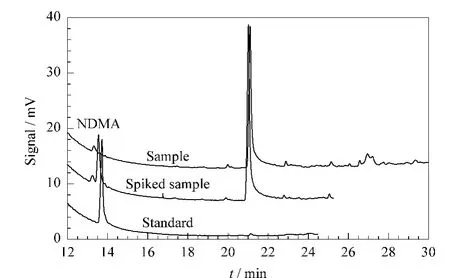
图3 冷冻熔炼液-液萃取方法处理后的实际啤酒样品及样品加标、标准品谱图Fig.3 Chromatograms of a beer sample,the beer sample spiked with standard and the standard after the treatment by frozen zone melting liquid-liquid extraction
在市售的4种啤酒样品中均未检出NDMA。从图3可知,啤酒样品经冷冻熔炼液-液萃取法处理后,可以得到较干净的色谱图;NDMA的出峰位置附近没有杂质峰干扰,满足定性和定量分析要求。采用此种前处理方法,即使样品基质中有大量的干扰物,例如蛋白质、氨基酸等,由于它们的凝固点较低,均可在水相中凝固,也能使有机相中的共萃取物大大减少。
3 结论
通过对冷冻熔炼液-液萃取条件的优化,建立了一种简单、高效的测定啤酒中NDMA的气相色谱检测方法。实验结果表明:NDMA的添加回收率为83.24%~85.14%,相对标准偏差为 2.63%~3.19%。与常温液-液萃取相比,冷冻熔炼液-液萃取技术所用装置简单、操作方便,同时起到净化和富集的目的,大大减少了有机溶剂的消耗量。
[1] Chen T,Wen Y Y,Ou Y,et al.Chinese Journal of Chromatography(陈婷,温裕云,欧延,等.色谱),2014,32(1):89
[2] Li P,Bai H,Li H Y,et al.Chinese Journal of Chromatography(李丕,白桦,李海玉,等.色谱),2014,32(1):81
[3] Zhao H,Wang X Y,Wang P Y,et al.Chinese Journal of Chromatography(赵华,王秀元,王萍亚,等.色谱),2013,31(3):223
[4] Chen J,Zhang C J,Li F,et al.Water Purification Technology(陈晶,张超杰,李飞,等.净水技术),2009,28(4):10
[5] Crews C.Qual Assur Saf Crop Foods,DOI:10.1111/j.1757-837X.2010.00049.x
[6] Zhao Y X,Wang X,Hu Y M.Chinese Journal of Analysis Laboratory(赵宇翔,王翔,胡耀明.分析试验室),2011,30(5):84
[7] GB/T 5009.26-2003
[8] Yu P H,Chang Z D,Jin S C,et al.Chemical Industry and Engineering Progress(于品华,常志东,金声超,等.化工进展),2009,28(9):1507
[9] Ma B F,Ma Y Q,Wan Y Q.Journal of Nanchang University:Natural Science(马冰峰,马雅倩,万益群.南昌大学学报:理科版),2013,37(5):452
[10] Reche F,Garrigos M C,Marin M L,et al.J Chromatogr A,2002,976:301
[11] Chen J H,Yang B J,Li W L,et al.Chinese Journal of Chromatography(陈军辉,杨柏娟,李文龙,等.色谱),2007,25(5):628
[12] Snyder L R,Kirkland J J,Glajch J L.Practical HPLC Method Development.2nd.Zhang Y K,Wang J,Zhang W B,transl.Beijing:Hua Wen Press(Snyder L R,Kirkland J J,Glajch J L.实用高效液相色谱法的建立.2版.张玉奎,王杰,张维冰,译.北京:华文出版社),2001
[13] Zhang W B(张维冰).CN 202006038 U.2011-10-12
[14] Sobhanzadeh E,Abu Bakar N K,Abas M R B,et al.J Hazard Mater,2011,186:1308
[15] He X Y,Chen S B,Yu X J,et al.Journal of Instrumental A-nalysis(贺小雨,陈树兵,俞雪钧,等.分析测试学报),2009,28(3):306
[16] de Pinho G P,Neves A A,de Queiroz M E L R,et al.Food Control,2010,21:1307
[17] Zhang W B,Wang Z C,Wan H,et al.Scientia Sinica Chinica(张维冰,王智聪,万昊,等.中国科学:化学),2013,43(2):209
[18] Goulart S M,Alves R D,Neves A A,et al.Anal Chim Acta,2010,671:41
[19] Rübensam G,Barreto F,Hoff R B,et al.Anal Chim Acta,2011,705:24

