伴刀豆凝集素修饰磁性纳米粒子富集人血清中糖蛋白及质谱鉴定
李 凤, 康经武
(中国科学院上海有机化学研究所,上海200032)
细胞中50%以上的蛋白都具有糖基化修饰[1]。作为一种普遍存在的翻译后修饰形式,糖基化对蛋白的结构和功能有着重要影响[2]。糖蛋白参与了广泛的生命活动,例如蛋白的转运和分选、细胞的生长和分化、细胞间的信号传导等[3]。异常的糖基化现象往往与疾病密切相关,包括癌症和先天性糖链缺陷(congenital disorders of glycosylation,CDG)[4]。近年来,为了寻找疾病早期诊断和检测的生物标志物(biomarker),对血液、尿液和脑脊液的广泛性糖蛋白组学研究已被大量报道[5]。特别是针对血清样品进行的研究中,白蛋白、免疫球蛋白等20种高丰度蛋白占蛋白总量的99%。而许多潜在的生物标志物蛋白含量很低,对其进行预先富集是进行深入研究的基础[6]。
凝集素亲和技术是广泛使用的糖蛋白富集手段之一[7]。商品化的琼脂糖作为常用基质,硅胶粒子以及整体柱作为载体材料的研究已见诸报道[8,9]。近年来,由于磁性材料良好的磁响应性,易于实现高通量,因而在生物分析领域得到广泛关注[10]。另外,磁性纳米粒子因其具有很大的比表面积、良好的分散性和生物兼容性,成功地在微量生物样品中实现了目标分子的高效富集[11]。张祥民课题组[12]采用核壳结构的磁性微球富集复杂体系中的低丰度肽段和蛋白,大大提高了MALDI-TOF质谱鉴定肽段和蛋白的数量。Ferreira等[13]采用硅胶包裹的磁纳米粒子用于体液(包括血清、尿液和唾液)中糖蛋白的富集。本课题组[14]将核壳结构的磁性纳米粒子运用于小分子药物靶标蛋白的富集,获得了丰富的免疫抑制剂环孢素A靶标蛋白谱。
虽然磁性纳米粒子在生物样品的分析中显示了良好的应用前景,但其制备过程比较复杂。本文报道了一种简易的磁性纳米粒子的制备和修饰方法,只需要在一般条件下,就可以制备出高性能的磁性纳米粒子用于亲和富集。它具有三层的核/壳/壳结构,由8 nm的Fe3O4磁性粒子作为内核,以硅胶层以及种子聚合的聚缩水甘油醚甲基丙烯酸酯(PGMA)外壳(Fe3O4@SiO2@PGMA)构成。伴刀豆凝集素通过亲水的聚乙二醇连接臂共价交联到粒子表面,用于特异性地富集人血清中的糖蛋白。采用离线的二维色谱和高分辨生物质谱进行分析,一共鉴定出76种糖蛋白。
1 实验部分
1.1 仪器与试剂
质谱为LTQ-Orbitrap(美国Thermo公司),离子源为 Advance nanoESI(美国 Michrom公司),1 260 series液相色谱仪(美国Agilent公司)。数据搜索算法为SEQUEST。
三羟甲基氨基甲烷(Tris)、FeCl2·4H2O、FeCl3·6H2O、四乙氧基硅烷(TEOS)、Triton X-100、缩水甘油醚甲基丙烯酸酯(GMA)、甲基丙烯酰氧丙基三甲氧基硅烷(MPS)、过硫酸钾(KPS)、N,N,N',N'-四甲基乙二胺(TEMED)、N-羟基丁二酰亚胺(NHS)、4-吗啉乙磺酸(MES)、二硫苏糖醇(DTT)、碘乙酰胺(IAA)、尿素(urea)、Tween-20、4,7,10-三氧-1,13-十三烷二胺(TTDA)、甲基 α-D-吡喃甘露糖苷(methyl α-D-mannopyranoside)、伴刀豆凝集素A、健康人血清样品均购自Sigma-Aldrich(美国)。1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDC·HCl)购自吉尔生化公司(上海),Trypsin Gold购自Promega公司(美国),乙腈(HPLC级)购自Merck公司(德国),甲酸(HPLC级)购自TEDIA公司(上海),乙醇、N,N-二甲基甲酰胺(DMF)均为分析纯。超滤管(3 kDa),ZipTip®微量层析柱(0.6 μL,C18)购置于Millipore公司(美国)。
1.2 缓冲液的配制
富集血清中的糖蛋白时使用的结合缓冲液:20 mmol/L Tris-HCl缓冲液(pH=7.4),150 mmol/L NaCl,1 mmol/L CaCl2,1 mmol/L MnCl2;洗涤缓冲液:20 mmol/L Tris-HCl缓冲液(pH=7.4),500 mmol/L NaCl,1 mmol/L CaCl2,1 mmol/L MnCl2和0.05%(v/v)Tween-20;洗脱缓冲液:在洗涤缓冲液中加入0.5 mol/L甲基α-D-吡喃甘露糖苷。
1.3 Fe3O4@SiO2@PGMA@ConA 的合成
伴刀豆凝集素-磁性纳米粒子的合成路线如图1所示。
1.3.1 Fe3O4@SiO2的合成
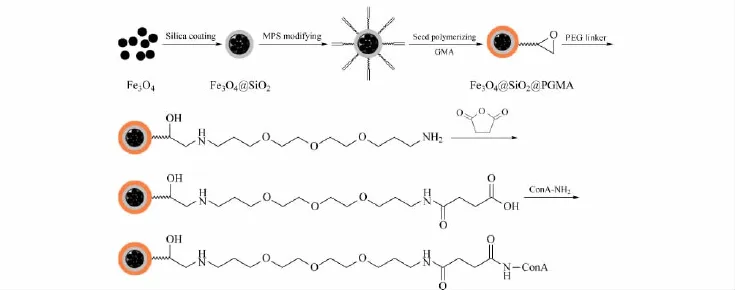
图1 Fe3O4@SiO2@PGMA@ConA的制备流程Fig.1 Procedure for the preparation of the core-shell Fe3O4@SiO2@PGMA@ConA
称取2.705 g FeCl3·6H2O(10.0 mmol)和0.995 g FeCl2·4H2O(5.0 mmol),溶于 10 mL 0.4 mol/L盐酸溶液中。在N2保护及机械搅拌下,用恒压滴液漏斗缓慢加入100 mL氢氧化钠水溶液(0.5 mol/L),升温至80℃反应30 min。反应过程中逐渐生成黑色的铁磁纳米粒子(Fe3O4)。反应完毕后将溶液冷却到室温,得到的铁磁纳米粒子依次用0.1 mol/L盐酸和水洗涤去除杂质,然后用水配制成100 g/L的磁性纳米粒子悬浮液,4℃保存备用。采用反向微乳液(油包水)的sol-gel方法在磁性纳米粒子表面形成硅胶包裹层。具体操作如下:在一个干燥的广口瓶中,将123.2 mL环己烷、25.6 mL正己醇和28.32 g Triton X-100混合,机械搅拌15 min,随即加入3.28 mL(100 g/L)的 Fe3O4粒子。之后,室温搅拌20 min形成均匀的黑色微乳液。将1.6 mL TEOS用注射器一次性加入到上述反应体系中,搅拌10 min使之充分溶解,然后加入0.96 mL浓氨水(质量分数为25%~27%),室温下搅拌反应20 h,反应液逐渐变成灰色。反应完毕后,加入200 mL无水乙醇破坏微乳液体系,最后用乙醇重复洗涤4次,完全去除粒子吸附的表面活性剂。高速离心回收纳米粒子,真空干燥备用。用扫描电镜证明硅胶层包裹完整后,将300 mg Fe3O4@SiO2粒子分散到10 mL无水乙醇中,加入1 mL硅烷化试剂MPS室温反应24 h,在粒子表面引入双键官能团,作为下一步种子聚合反应的起点。反应结束后用乙醇洗涤,真空干燥备用。
1.3.2 Fe3O4@SiO2@PGMA 的合成
在50 mL圆底烧瓶中,加入20 mL去离子水和300 mg MPS修饰的Fe3O4@SiO2粒子,超声波分散均匀。加入0.2 mL GMA,用氮气鼓泡脱气后,升温至80℃,加入0.1 mL过硫酸钾水溶液(100 g/L)反应12 h。反应完毕后,磁力分离得到红色的Fe3O4@SiO2@PGMA粒子。用水重复洗涤3次,分散于20 mL去离子水中,4℃保存。
1.4 伴刀豆凝集素的固定化
为了将伴刀豆凝集素固定到磁性纳米载体表面,首先用TTDA与载体表面GMA发生环氧开环反应,将其转化为方便进一步修饰的氨基官能团。具体操作如下:将30 mg Fe3O4@SiO2@PGMA粒子加入到0.88 mL的TTDA(0.2 mol/L)中,100℃油浴加热回流24 h。反应完毕冷却至室温,DMF重复洗涤粒子3次,将粒子最终分散于10 mL干燥的DMF中。之后,加入60 mg琥珀酸酐(0.3 mol/L)及10%(v/v)三乙胺,室温过夜反应。超声条件下将其分散于50 mmol/L MES(pH=5.5)缓冲液中,加入0.25 mL EDC(10 g/L)和0.25 mL NHS(10 g/L),室温搅拌反应2 h。在磁分离条件下,去除多余的EDC和NHS。将上述琥珀酰亚胺活化的粒子加入到伴刀豆凝集素溶液(2 g/L,溶于结合缓冲液)中,4℃过夜反应。
1.5 人血清中糖蛋白的富集
超滤去除人血清样品中的小分子,用结合缓冲液稀释至蛋白质量浓度为0.25 g/L(BCA蛋白定量试剂盒测定)。加入5 mg Fe3O4@SiO2@PGMA@Con A粒子,在摇床上室温孵育30 min。在磁分离条件下,用洗涤缓冲液重复洗涤3次,去除表面非特异性吸附的蛋白。之后用0.2 mL的洗脱缓冲液洗脱特异性结合的糖蛋白,重复3次。合并洗脱液,冻干备用。
1.6 胰蛋白酶酶切
将富集的蛋白溶于0.1 mL的50 mmol/L NH4HCO3、8 mol/L 尿素(pH=8.0)缓冲液中,于37℃孵育30 min。加入5 μL 200 mmol/L DTT,56℃反应1 h。之后加入5 μL 400 mmol/L IAA,室温避光反应2 h。将尿素浓度稀释至2 mmol/L后,按酶与蛋白质量比1∶50加入胰蛋白酶,37℃过夜酶切。
1.7 强阳离子交换色谱制备肽段的色谱条件
色谱柱为Agilent ZORBAX SCX(150 mm×2.1 mm,5 μm,30 nm);柱温为25℃,流速为0.3 mL/min,检测波长为280 nm;流动相A为含有30%(v/v,下同)ACN 的 5 mmol/L NH4COOH(pH 3.0)水溶液,B为含有30%ACN的500 mmol/L NH4COOH(pH 6.5)水溶液。采用50 min的梯度洗脱:0~5 min,0%B;5~15 min,0% ~10%B;15~30 min,10%B ~30%B;30~43 min,30%B ~50%B;43~45 min,50%B;45.1~55 min,0%B。按时间进行收集,每2 min收集一个组分。
1.8 质谱分析和数据处理
肽段样品脱盐后,真空离心干燥。最终溶解于0.1%HCOOH(含2%ACN)水溶液中,用液相色谱-串联质谱进行分析。色谱柱为Michrom Bioresources的 Magic C18 AQ(150 mm ×0.1 mm,3 μm,10 nm);进样量 10 μL,用自动进样器(HTSPAL,CTC Analytics,Zwingen,Switzerland)以 1 μL/min的速度保持10 min。流动相A为2%乙腈(含0.1%HCOOH)水溶液,流动相B为98%乙腈(含0.1%HCCOH)水溶液。采用100 min的梯度洗脱:0~60 min,0%B~35%B;60~68 min,80%B;68~80 min,80%B~95%B;80~100 min,0%B。质谱条件:正离子模式扫描,电压1.6 kV,管状透镜电压125 V;二级质谱(MS/MS)通过数据依赖的扫描方式,以电荷数≥2的离子强度最强的10个离子为基准。动态质量排除时间为27 s,单电荷和不带电荷的离子不进行MS/MS扫描,碰撞诱导解离能量设置为35%。
将上述分析获取的质谱数据通过SEQUEST搜索算法与人类蛋白序列数据库(International Protein Index,IPI)进行比对,确定肽段序列、肽段修饰位点及其对应的蛋白种类。搜索引擎参数设置:MS1质量精度±10 ppm,MS2质量精度1 Da。检索时每个蛋白的最小肽段数设定为2,肽段长度为6以上。Xcorr值设定:2.5(+2)、3.0(+3)、3.5(+4)。蛋白数据通过Scaffold 3 Proteome(Proteome Software,Portland,OR)软件进一步分析。N-糖基化位点的预测通过搜索NetNGlyc 1.0 server(http://www.cbs.dtu.dk/services/NetNGlyc)来完成,基于蛋白序列中是否含有保守的Asn-Xaa-Ser/Thr(Xaa是除了Pro外的任意氨基酸);O-糖基化位点的预测通过搜索 NetOGlyc 3.1 server(http://www.cbs.dtu.dk/services/NetOGlyc)来完成[15]。
2 结果和讨论
2.1 磁性纳米粒子的表征
本实验中制备的核壳结构磁性粒子的透射电镜(TEM)照片如图2所示。我们合成Fe3O4磁粒子核是采用均相沉淀法(也称共沉淀法)[16],图2a电镜图表明平均粒径为8 nm。图2b和2c是采用反相微乳液的方法合成的Fe3O4@SiO2粒子。反相微乳液是一种由大量表面活性剂及水相和有机相组成的热稳定分散体系,反相微乳液是油包水微乳液体系。微乳液体系制备硅胶包裹粒子的优点是良好的硅胶外形控制(表面比较光滑,粒径均匀)及粒径可调(改变水相和表面活性剂的比例,从而控制硅胶粒子的尺寸范围)。从电镜图可以看出,Fe3O4@SiO2粒子具有球型光滑的外形,均匀的粒径分布,每颗硅胶包裹粒子中都含有多颗Fe3O4纳米核,平均粒径为135 nm。由于本实验采用共沉淀法合成的Fe3O4粒径较小(仅为8 nm),磁响应较弱,无法直接使用。通过硅胶层的引入,使每个硅胶颗粒中含有多个Fe3O4纳米核,大大增强了磁响应性,便于后面的亲和富集操作。文献[10]中报道的聚合物包裹的磁性纳米粒子制备较繁琐,不易广泛应用。本工作中设计在硅胶表面通过种子聚合引入一层生物兼容性的聚合物PGMA,同时也引入了可修饰的环氧官能团,制备简单、重复性好。图2d是表面包裹聚合物PGMA的粒子,其起始于硅胶表面的硅烷化,用硅烷化试剂MPS对硅胶表面进行修饰,引入双键作为自由基聚合的起点。为了得到外形良好的聚合物包裹纳米粒子,实验发现硅胶的外形控制是关键。电镜图显示聚合物包裹层很薄,对硅胶外形的影响较小,纳米粒子粒径没有明显的变化。

图2 磁性纳米粒子的透射电镜图Fig.2 Transmission electron microscope(TEM)images of the magnetic nanoparticles(MNPs)a.Fe3O4;b and c.Fe3O4@SiO2;d.Fe3O4@SiO2@PGMA.
磁性纳米粒子的红外光谱(IR)表征如图3所示。Fe3O4粒子的主要吸收峰是588.9 cm-1处Fe-O-Fe的特征吸收。Fe3O4@SiO2粒子在1 103.2 cm-1处有很强的吸收,它是Si-O-Si的特征吸收峰,证明硅胶包裹是成功的。硅胶粒子表面引入硅烷化试剂MPS会增加一些碳氢元素,是谱图中对应的2 982.8 cm-1、2 920.9 cm-1、2 850.1 cm-13 个 C-H键的吸收峰,吸收较弱是因为这些修饰分子的含量较低,只是覆盖在硅胶表面的一层单分子层。Fe3O4@SiO2@PGMA粒子表面GMA分子的引入增加了1 722.4 cm-1处羰基的特征吸收峰,同时2 996.1 cm-1、2 956.3 cm-1、2 894.3 cm-1处的 C-H键吸收也明显增强,证明了PGMA聚合物成功地包裹在硅胶表面。
2.2 伴刀豆凝集素的固定化
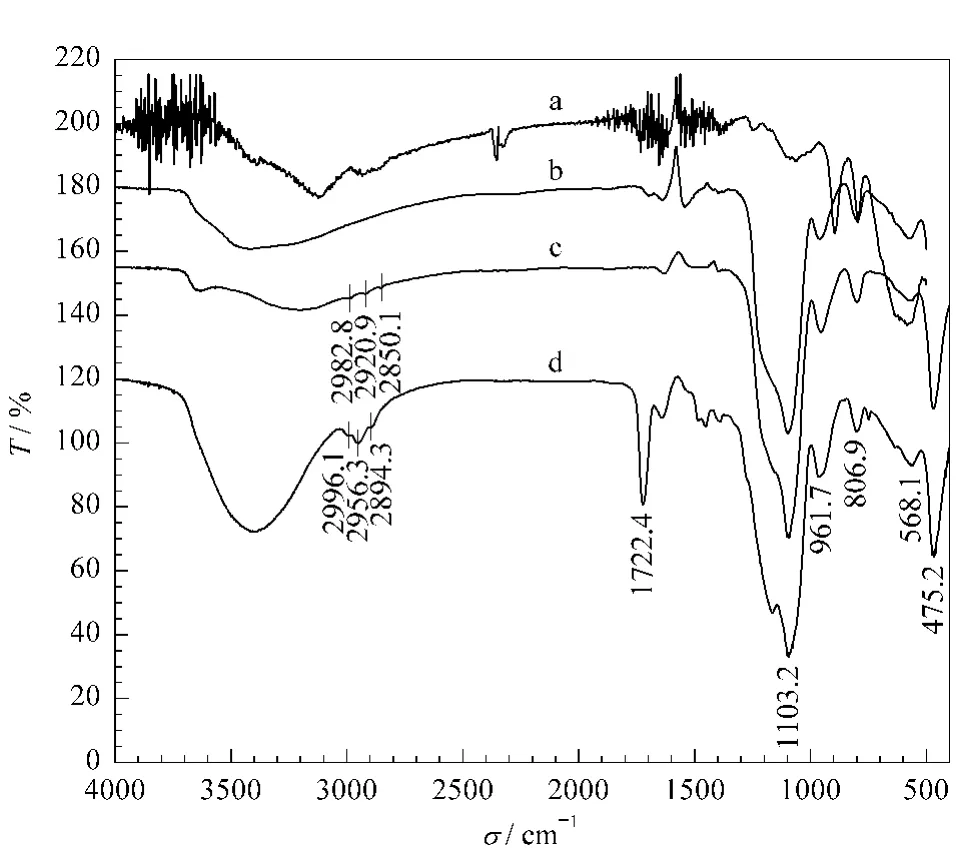
图3 磁性纳米粒子的红外光谱图Fig.3 Infrared spectra of the MNPsa.Fe3O4;b.Fe3O4@SiO2;c.Fe3O4@SiO2@MPS;d.Fe3O4@SiO2@PGMA.
为了实现伴刀豆凝集素的固定化,首先通过Fe3O4@SiO2@PGMA表面的环氧官能团引入聚乙二醇连接臂 4,7,10-三氧-1,13-十三烷二胺。实验表明,连接臂的引入大大增加了粒子的亲水性,使粒子在水相中分散性更好,同时减少了富集过程中基质引起的非特异性吸附。粒子表面的氨基被转化为羧基,通过EDC/NHS活化羧基实现伴刀豆凝集素的固定化。本实验中选用的伴刀豆凝集素是众多商品化凝集素中最常用的,它可以识别构成血清和细胞膜表面糖蛋白核心结构中的α-甘露糖。为了确定粒子表面凝集素的固定量,通过BCA assay测定了固定化反应前后溶液中的蛋白含量。结果表明,每毫克磁性纳米粒子表面的蛋白固载量为(32±5)μg。Ferreira等[13]报道的平均粒径为14 nm的硅胶磁性纳米粒子中伴刀豆凝集素的固载量为80 μg/mg。由于蛋白固载量与纳米粒子的粒径负相关,与文献报道相比本文中的蛋白固载量较低(约为文献的1/3);但是本文中平均粒径为135 nm的磁性纳米粒子分散性更好,最终实验结果表明其富集效率更高。
2.3 人血清中糖蛋白的富集和质谱鉴定
采用本实验室发展的伴刀豆凝集素-磁性纳米载体对人血清中的特异性糖蛋白进行富集。富集的蛋白经过变性、还原、烷基化和胰蛋白酶酶解后,采用离线的二维色谱(SCX/RPLC)对肽段进行分离与纯化。离线的二维分离方法更灵活,可以进行独立的条件优化。最终一共鉴定了80种蛋白,经过Uniprot的检索和在线软件Net-NGly 1.0、NetO Gly 3.1的分析,糖蛋白一共有76种,鉴定得到的所有蛋白的相关信息见表1。与文献[17]中 Agarose@Con A富集结果比较,我们在其基础上多富集了48种糖蛋白。分析其原因是本文中使用的磁性纳米粒子具有很大的比表面积,大大增加了粒子表面凝集素蛋白分子的密度;同时粒子亲水性的聚合物表面使其在水相中分散性良好,提高了其与靶标糖蛋白的结合效率。同时,我们鉴定的蛋白肽段覆盖率较高,每种蛋白的平均肽段数为16,这大大增加了蛋白质谱鉴定的可信度。我们制备的材料与文献[18]中的glycobeads(非糖基化蛋白占23%)比较,非特异性吸附大大降低,分析原因是我们合成的纳米粒子表面光滑,亲水性的聚乙二醇连接臂减小了凝集素与糖蛋白作用的空间位阻。发展制备简易、非特异性吸附小的磁性纳米粒子对将凝集素亲和技术广泛地应用于生物分离分析领域至关重要。
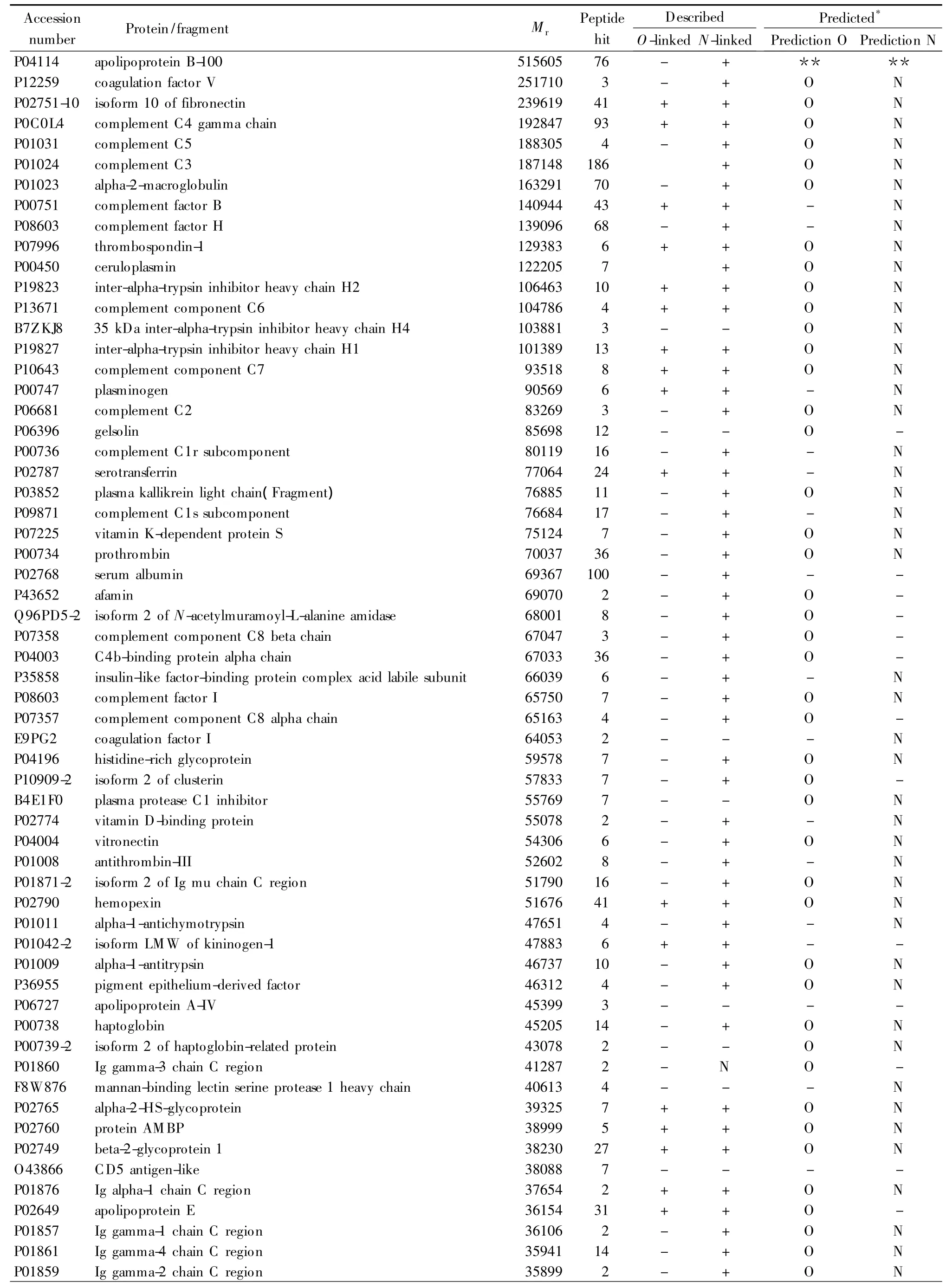
表1 Fe3O4@SiO2@PGMA@Con A富集的糖蛋白Table 1 Glycoproteins enriched with Fe3O4@SiO2@PGMA@Con A
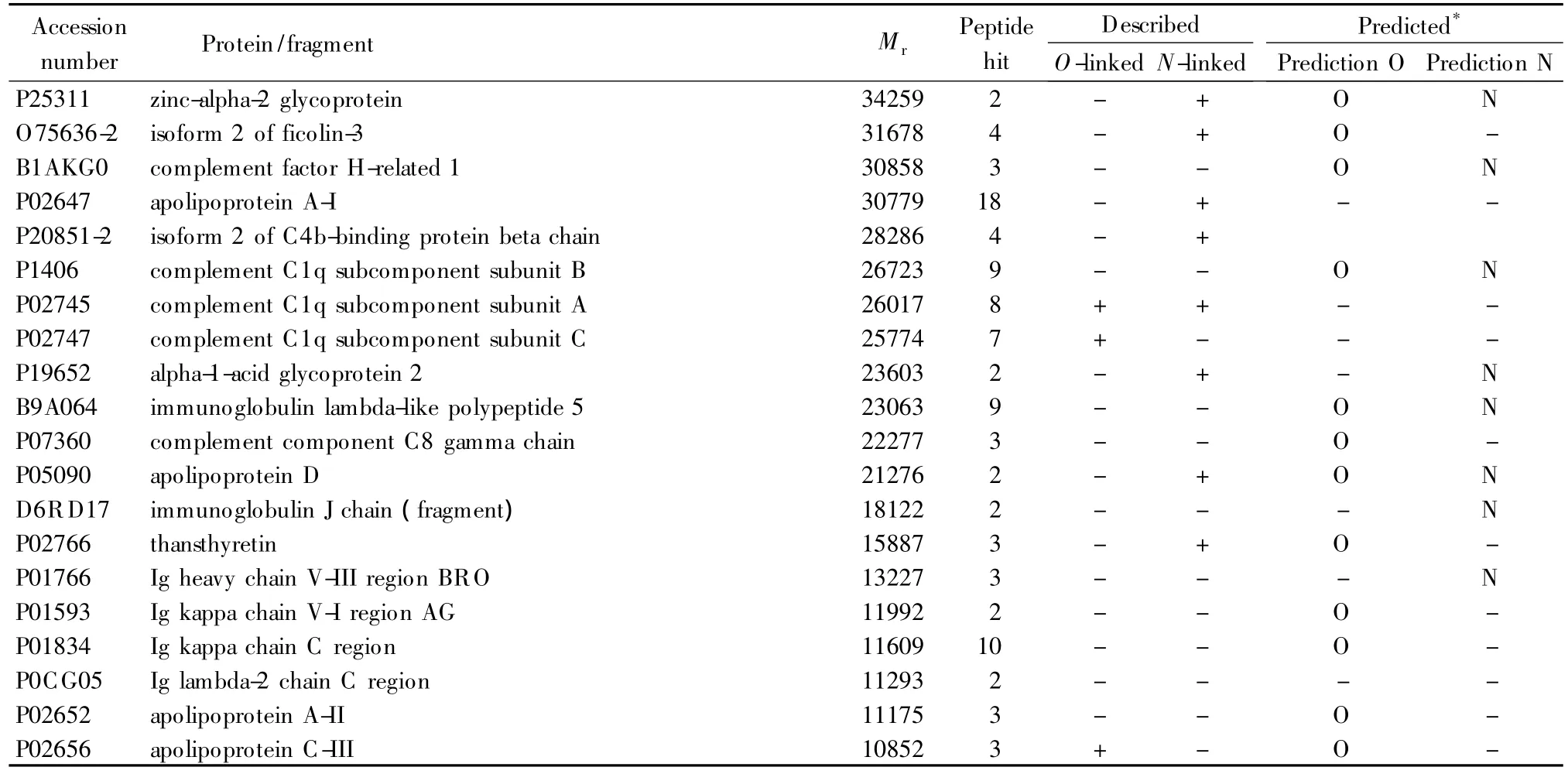
表1 (续)Table 1 (Continued)
3 结论
我们发展了一种新型磁性纳米粒子,其制备简易,分散性良好。将其与伴刀豆凝集素结合应用于复杂体系人血清中特异性糖蛋白的富集。结果表明,与传统的Agarose@Con A相比,本文中设计的MNP@Con A可以富集到更多特异性的糖蛋白,大大提高了富集的效率。同时蛋白鉴定结果中5%的非糖基化蛋白也强有力地证明了我们的磁性纳米粒子非特异性吸附小。同时粒子自身的磁响应性可以大大简化实验操作、节省时间,有望实现高通量。凝集素作为一种天然存在的对多种糖链有特异性识别的生物大分子,已广泛应用于糖组学的各个领域。
本文中的磁性纳米粒子已证明是一种较理想的凝集素固定基质,有望在更广泛的糖组学研究中发挥作用。
[1] Hagglund P,Bunkenborg J,Elortza F,et al.J Proteome Res,2004,3:556
[2] Ye M L.Chinese Journal of Chromatography(叶明亮.色谱),2013,31(1):1
[3] Shental-Bechor D,Levy Y.Curr Opin Struct Biol,2009,19(5):524
[4] Peracaula R,Barrabés S,Sarrats A,et al.Disease Markers,2008,25:207
[5] Zeng X,Hood B L,Sun M,et al.J Proteome Res,2010,9(12):6440
[6] Ma C,Pan Y T,Zhang Q,et al.Chinese Journal of Chromatography(马成,潘一廷,张琪,等.色谱),2013,31(11):1057
[7] Zhao J,Qiu W L,Simeone D M,et al.J Proteome Res,2007,6:1126
[8] Yang F,Mao J,He X W,et al.Chinese Journal of Chromatography(杨帆,毛劼,何锡文,等.色谱),2013,31(6):531
[9] Feng S,Yang N,Pennathur S,et al.Anal Chem,2009,81(10):3776
[10] Aguilar-Arteaga K,Rodriguez J A,Barrado E.Anal Chim Acta,2010,674(2),157
[11] Wang Z,Wang C.Chinese Journal of Chromatography(王志,王春.色谱),2012,30(10):977
[12] Chen H M,Deng C H,Zhang X M,Angew Chem Int Ed,2010,49(3):607
[13] Ferreira J A,Daniel-da-Silva A L,Alves R M P,et al.Anal Chem,2011,83:7035
[14] Wei Y H,Wang T D,Liu C,et al.Chin J Chem,2013,31:715
[15] Julenius K,Molgaard A,Gupta R,et al.Glycobiology,2004,15(2):153
[16] Li Y C,Lin Y S,Thai P J,et al.Anal Chem,2007,79:7519
[17] Yang Z P,Hancock W S.J Chromatogr A,2004,1053:79
[18] Sparbier K,Asperger A,Resemann A,et al.J Biomol Tech,2007,18(4):252

