改良预充液用于婴幼儿体外循环效果观察
徐红亮,杨玉齐,石 磊,范顺阳,尉新华,张金涛,李 群
(郑州大学第三附属医院,郑州450052)
近年来先天性心脏病(以下简称先心病)的外科治疗呈现低龄化和复杂化趋势,手术成功取决于体外循环技术和材料的进步。体外循环对婴幼儿内环境的影响以及由此产生的炎症反应和一系列并发症仍是目前限制先心病手术的一大困扰。对于婴幼儿复杂先心病,尽管可以采用新型的微型化体外循环管路和预充量较小的氧合器,仍难避免应用库存血。无血预充会对患儿造成严重的血液稀释[1,2];库存血高钾、高乳酸破碎红细胞及代谢废物与术后炎症反应、肺功能低下等诸多并发症密切相关[3]。2011~2013年,我们将体外循环预充液进行改良并用于20例室间隔缺损(VSD)手术患儿,取得满意效果。现报告如下。
1 资料与方法
1.1 临床资料 选择VSD患儿40例,年龄3~8(5.2 ±0.9)个月,体质量 5 ~10 kg,均发现心脏杂音数月,易患呼吸道感染,生长发育略差于正常同龄儿,胸骨左缘第3、4肋间可闻及2/6~4/6级收缩期杂音。经心脏彩色多普勒、胸部X线、心电图检查确诊为VSD,且超声心动图提示均有轻至中度肺动脉高压。将40例患儿随机分为改良组及常规组,每组各20例。两组性别比例、年龄、体质量差异无统计学意义。
1.2 手术方法 两组均于浅低温(31~32℃)体外循环下行VSD修补术。体外循环采用StocketⅢ型人工心肺机、Terumo婴儿型膜肺、国产婴儿型动脉微栓滤器、标准C型管道、HPH-400血液浓缩器,用改良St.ThomasⅡ晶体心脏停搏液顺灌行心肌保护。预充液总量400 mL,悬浮红细胞1 U,血浆100 mL,20%白蛋白50 mL。预充方式:常规组采用勃脉力-A晶体液(67±33)mL、浓缩红细胞1 U、血浆100 mL、20%人血白蛋白50 mL。改良组预充方法:在常规预充后,通过内循环行零平衡超滤(ZBUF),平衡置换液选用勃脉力-A晶体液,ZBUF时间(28.0±1.5)min,滤液量(1 000 ± 22)mL,0.2 L/min,40%氧体积分数氧合8 min,然后根据血气分析结果调整预充液pH值至生理范围(7.35~7.45),给予50 g/L 碳酸氢钠溶液(47.0 ±10.5)mL。
1.4 观察项目
1.4.1 动脉血气分析、电解质 分别于体外循环前、中及术后ICU期间检测两组动脉血气指标、电解质,包括 pH、PO2、碱剩余 (BE)、K+、HCT、SPO2等。
1.4.2 预充液 TNF-α与IL-8水平 用放射免疫法分别于体外循环开始时(T1,其中改良组在改良调整前为T1a,改良调整后为T1b)、体外循环开始10 min时(T2)、停体外循环前(T3)、术后6 h(T4)及12 h(T5)时测定两组预充液TNF-α与IL-8水平。
1.4.3 呼吸机辅助时间 记录两组术后呼吸机辅助时间。
1.5 统计学方法 采用SPSS13.0统计软件,数据以±s表示,两组数据间的显著性检验采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 动脉血气分析及电解质指标 改良组体外循环前 pH、PCO2、BE、K+均低于常规组(P <0.01)并达到正常生理范围。体外循环中及术后ICU期间两组血气分析结果差异均无统计学意义,见表1。
表1 两组不同时间段血气指标及电解质结果比较(±s)
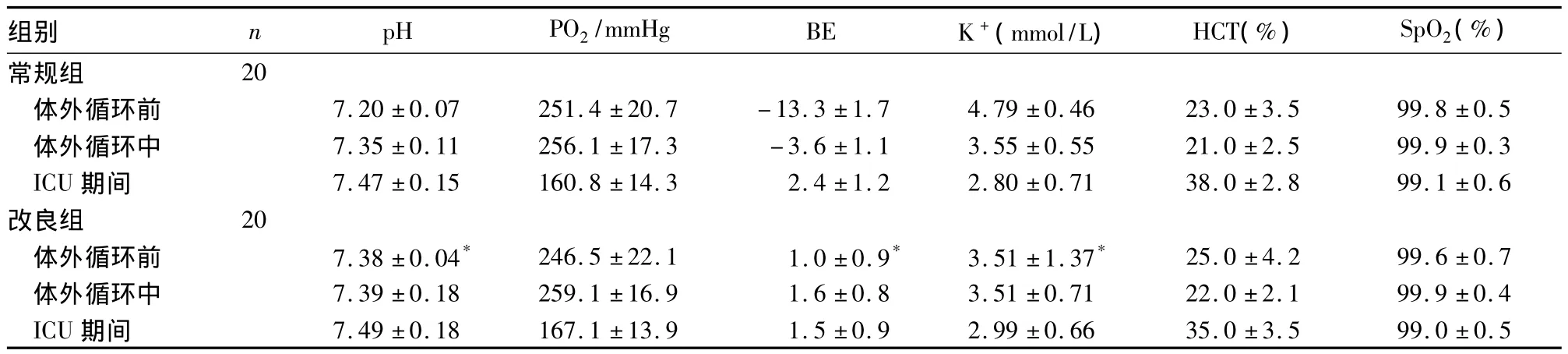
表1 两组不同时间段血气指标及电解质结果比较(±s)
注:与常规组比较,*P <0.01
组别 n pH PO2/mmHg BE K+(mmol/L) HCT(%) SpO2(%)20体外循环前 7.20 ±0.07 251.4 ±20.7 -13.3 ±1.7 4.79 ±0.46 23.0 ±3.5 99.8 ±0.5体外循环中 7.35 ±0.11 256.1±17.3 -3.6 ±1.1 3.55±0.55 21.0±2.5 99.9±0.3 ICU 期间 7.47 ±0.15 160.8 ±14.3 2.4 ±1.2 2.80 ±0.71 38.0 ±2.8 99.1 ±0.6改良组 20体外循环前 7.38 ±0.04* 246.5 ±22.1 1.0 ±0.9* 3.51 ±1.37* 25.0 ±4.2 99.6 ±0.7体外循环中 7.39 ±0.18 259.1 ±16.9 1.6 ±0.8 3.51 ±0.71 22.0 ±2.1 99.9 ±0.4 ICU 期间 7.49 ±0.18 167.1 ±13.9 1.5 ±0.9 2.99 ±0.66 35.0常规组±3.5 99.0 ±0.5
2.2 TNF-α及IL-8水平 改良组T1b时TNF-α水平低于 T1a时及常规组 T1时(P<0.05)。T3、T4时,改良组TNF-α水平均低于常规组(P<0.05)。改良组T1b时IL-8水平低于T1a时及常规组T1时(P <0.05);T2、T3、T4 时,改良组 IL-8 水平低于常规组(P <0.05),见表2。
2.3 呼吸机辅助时间 改良组、常规组呼吸机辅助时间分别为(13.9 ±5.5)、(20.6 ±6.9)h,改良组呼吸机辅助时间短于常规组(P<0.05)。
表2 两组不同时间点TNF-α与IL-8水平比较(ng/L,±s)
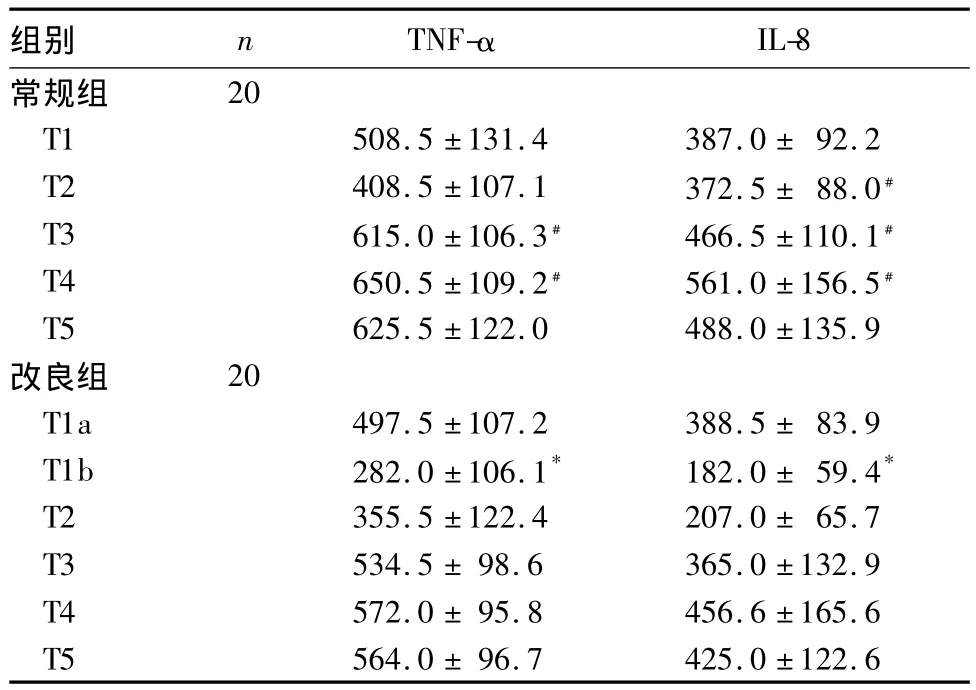
表2 两组不同时间点TNF-α与IL-8水平比较(ng/L,±s)
注:与同组T1a时比较,*P<0.01;与改良组同时刻比较,﹟P<0.05
组别 n TNF-αIL-8常规组20 T1 508.5 ±131.4 387.0 ± 92.2 T2 408.5 ±107.1 372.5 ± 88.0﹟T3 615.0 ±106.3﹟ 466.5 ±110.1﹟T4 650.5 ±109.2﹟ 561.0 ±156.5﹟T5 625.5 ±122.0 488.0 ±135.9改良组 20 T1a 497.5 ±107.2 388.5 ± 83.9 T1b 282.0 ±106.1* 182.0 ± 59.4*T2 355.5 ±122.4 207.0 ± 65.7 T3 534.5 ± 98.6 365.0 ±132.9 T4 572.0 ± 95.8 456.6 ±165.6 T5 564.0 ± 96.7 425.0 ±122.6
3 讨论
先心病患儿受自身体质量的影响,体外循环中所预充的库存血量往往超过其本身的血容量。库存血高乳酸、高钾,并含较多炎性因子和代谢毒素,在体外循环中会加重机体的炎性反应,严重影响术后心、肺功能的恢复。对预充库存血在体外循环开始前行零平衡超滤、调整,可以减小对内环境的影响,有效降低炎性因子,清除库存血中乳酸、K+,促进术后恢复。
婴幼儿体外循环中所加库存血一般为悬浮红细胞,临床上以保存7 d以内的为新鲜悬浮红细胞,体外循环应用时多数均超过这一期限[4,5]。库存悬浮红细胞在缺氧条件下糖酵解产生乳酸,此过程是红细胞能量的主要来源,这一代谢途径在4℃时并未停止,因此随着库存血存放时间增长,其糖含量逐渐下降而乳酸浓度逐渐升高,并且随着红细胞的破坏释放出K+,其浓度与存放时间呈线性关系[6,7]。研究发现,体外循环会使患儿血K+浓度平均升高3.1 mmol/L。输入高浓度K+时会引起心律失常及心跳停止。本研究发现,改良组库存血预充液中乳酸和K+浓度降低,该组患儿血乳酸和K+浓度更接近生理范围,提示与体外循环前的零平衡超滤有关。
近年来在研究体外循环所致全身炎性反应过程中,中性粒细胞激活后导致的细胞内皮损伤受到重视[8]。体外循环过程中由于输入大量库存血,血液暴露于体外循环管道等人工材料以及缺血—再灌注损伤等因素影响,引起体内补体系统和单核/巨噬细胞激活,释放大量炎性因子,其中TNF-α、IL-8的致炎作用最为重要[9,10]。文献报道婴幼儿心脏手术体外循环开始前对库存血预充液超滤,可以有效维持体外循环中电解质及酸碱平衡,明显减少体外循环中及术后细胞因子、缓激肽等炎性因子的水平,缓解全身炎性反应综合征,减轻水负荷及术后肺损伤[11,12]。本研究发现,两组预充液中 TNF-α、IL-8水平在零平衡超滤前无统计学差异,而改良调整后,改良组均低于常规组,提示零平衡超滤对炎症因子有理想的滤出效果,可消除库存血中炎性因子、乳酸及红细胞代谢毒素的影响,使得体外循环中炎性反应的程度也相应降低。本研究发现,停体外循环前(T3)、术后6 h(T4)时改良组两种炎症因子水平均低于常规组,体外循环开始10 min(T2)时改良组IL-8水平已低于常规组,推测可能在参与炎性反应的环节中IL-8发挥作用早于TNF-α。
先心病婴幼儿一般术前基础体质较差,有不同程度的贫血、低蛋白血症、肺间质充血水肿等。本研究发现,改良组ICU期间呼吸机辅助时间均短于常规组,提示对库存血预充液零平衡超滤、调整后,对心肺功能恢复有明显的促进作用。
综上所述,婴幼儿复杂先心病体外循环中,对库存血预充液行零平衡超滤调整改良后,可以有效减轻库存血中及体外循环中的炎性因子水平,消除高乳酸、高钾、细胞代谢毒素等对机体内环境的影响,降低全身炎性反应,促进心肺功能恢复,且操作简单,是减小库存血对婴幼儿复杂先天性心脏病体外循环影响的有效方法。
[1]陈萍,雷迪斯,章晓华,等.微小化体外循环管路减少新生儿及小婴儿术中用血及炎性反应[J].中国体外循环杂志,2010,8(3):136.
[2]Charette K,Hirata Y,Bograd A,et al.180ml and less:cardiopulmonary bypass techniques to minimize hemodilution for neonates and small infants[J].Perfusion,2007,22(5):327.
[3]陈萍,柯俊,李刚,等.库存红细胞清洗在新生儿及小婴儿体外循环手术中的应用[J].中华胸心外科杂志,2009,23(3):165.
[4]Gruenwald CE,McCrindle BW,Crawford-Lean L,et al.Reconstituted fresh whole blood improves clinical outcomes compared with stored component blood therapy for neonates undergoing cardiopulmonary bypass for cardiac surgery:a randomized controlled trial[J].Thorac Cardiovasc Surg,2008,136(6):1442.
[5]Ranucci M,Carlucci C,Boncilli A,et al.Duration of red blood cell storage and outcomes in pediatric cardiac surgery:an association found for pump prime blood[J].Crit Care,2009,13(6):207.
[6]倪虹,龚庆成.库存悬浮红细胞生化特点及预充策略[J].中国体外循环杂志,2009,7(2):86.
[7]张慧萍,殷燕斌,牟红.库存悬浮红细胞预处理对婴幼儿预充液中血糖、乳酸及钾离子的影响[J].中国胸心血管外科临床杂志,2013,20(2):247.
[8]Rasmussen BS,Sollid J,Knudsen L,et al.The release of systemic inflammatory mediators is independent of cardiopulmonary bypass temperrature[J].J Cardiothorac Vase Aneth,2007,21(2):191.
[9]Allan CK,Newburger JW,McGrath E,et al.The relationship between inflammatory activation and clinical outcome after infant cardiopulmonary bypass[J].Anesth Analg,2010,111(5):1244.
[10]王 刚,潘征夏.体外循环术后肺损伤的机制及防治[J].实用儿科临床杂志,2008,23(23):1855.
[11]马黎明,褚衍林,乔衍,等.改良超滤联合平衡超滤对婴幼儿体外循环术后IL-6,TNF-α及sICAM-1血浆含量和肺功能影响[J].心肺血管病杂志,2011,30(1):13.
[12]张文龙,荣宁宁,范全心.平衡超滤加改良超滤对婴幼儿体外循环术后血清炎症介质水平的影响[J].山东医药,2007,47(9):5.

