橙皮苷对扑热息痛和四氯化碳所致小鼠急性肝损伤的保护作用
黄隽敏,雷 焦,舒克钢,陈秀娟,聂 浩,龚 权
(长江大学医学院,湖北荆州434023)
橙皮苷(HDN)是橙皮素与芸香糖形成的糖苷,为二氢黄酮衍生物。既往研究显示HDN具有多种药理活性,如抗炎、抗脂质氧化、清除氧自由基[1,2]、抗肿瘤[3]、维持血管正常渗透压、降血脂及保护心血管系统[4,5]等作用。Garg 等[6]研究发现 HDN 有较强的抑制和改善急性炎症反应的抗炎活性作用。秦得安等[7]研究发现HDN对羟自由基有明显的清除作用。Al-Ashaal等[8]研究发现橙皮苷对喉癌、宫颈癌、乳房癌和肝癌有显著的抗肿瘤活性。近年来随着对HDN药效学研究的深入,HDN已成为药物学研究的热点。2012年3月~2013年2月,我们观察了HDN对扑热息痛(APAP)和四氯化碳(CCl4)导致的小鼠急性肝损伤的保护作用,现报告如下。
1 材料与方法
1.1 材料 实验动物:清洁级昆明小鼠,雄性,体质量18~22 g,购自武汉大学动物实验中心,质量合格证SCXK(鄂)2008-0004,分笼饲养,自由进食、饮水,自然昼夜节律光照。药品和试剂:HDN、APAP购自美国Sigma公司;CCl4购自北京化学试剂公司;羧甲基纤维素钠(CMC-Na)购自天津市科密欧化学试剂开发中心;甲醛购自武汉市中天化工有限责任公司;橄榄油为市售食用油。
1.2 实验方法
1.2.1 急性肝损伤模型制作[9,10]将50只小鼠随机分为正常组、APAP组、CCl4组、HDN+APAP组、HDN+CCl4组,每组各10只。HDN+APAP组和HDN+CCl4组用 HDN 悬浊液(0.1 mL/10 g,溶于0.5%CMC-Na中)500 mg/kg灌胃,其他各组分别用同体积的0.5%CMC-Na溶液灌胃,均1次/d,连续10 d。末次给药2 h后禁食不禁水,APAP组和HDN+APAP组腹腔注射APAP溶液175 mg/kg,CCl4组和 HDN+CCl4组腹腔注射0.4%CCl40.1 mL/10 g诱导急性肝损伤;正常组腹腔注射同体积0.5%CMC-Na溶液。
1.2.2 观察项目
1.2.2.1 血清ALT、AST、LDH 水平 制模16 h后,小鼠眼球取血0.5 ~1.0 mL,室温静置30 min,4 ℃3 000 r/min离心15 min,取上清液,采用自动生化分析仪检测ALT、AST、LDH水平。
1.2.2.2 肝指数 眼球取血后处死各组小鼠,迅速解剖肝脏,冷生理盐水漂洗,滤纸吸干称重,计算肝指数。肝指数=肝质量(g)/体质量(g)×100%。
1.2.2.3 肝脏病理改变 取肝右叶,用10%中性甲醛溶液固定,常规石蜡包埋、切片,HE染色,光镜下(HE染色,400×)观察肝脏病理组织学改变。
1.3 统计学方法 采用SPSS17.0软件行统计学处理,数据以±s表示,多组间比较采用F检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组肝指数及血清ALT、AST、LDH水平比较见表1。
表1 各组肝指数及血清ALT、AST、LDH水平比较(±s)
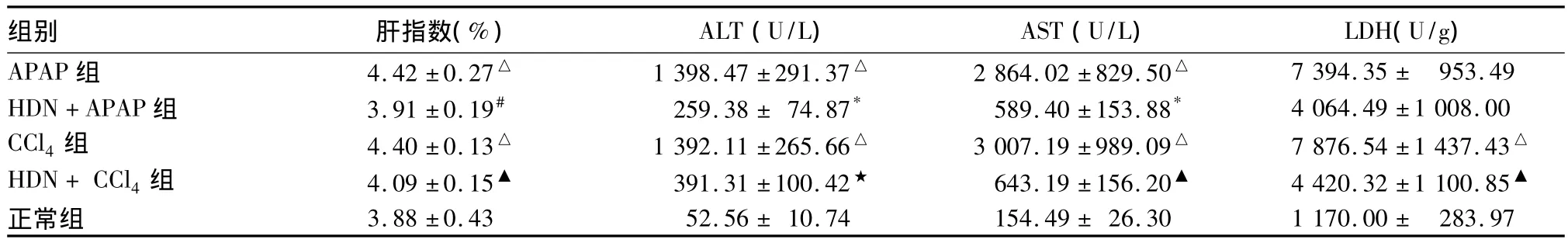
表1 各组肝指数及血清ALT、AST、LDH水平比较(±s)
注:与正常组比较,△P <0.01;与 APAP组比较,*P <0.01,#P <0.05;与CCl4组比较,▲P <0.05,★P <0.01
组别 肝指数(%) ALT(U/L) AST(U/L) LDH(U/g)APAP 组 4.42 ±0.27△ 1 398.47 ±291.37△ 2 864.02 ±829.50△7 394.35 ± 953.49 HDN+APAP 组 3.91 ±0.19# 259.38 ± 74.87* 589.40 ±153.88* 4 064.49 ±1 008.00 CCl4组 4.40 ±0.13△ 1 392.11 ±265.66△ 3 007.19 ±989.09△ 7 876.54 ±1 437.43△HDN+CCl4组 4.09 ±0.15▲ 391.31 ±100.42★ 643.19 ±156.20▲ 4 420.32 ±1 100.85▲正常组 3.88 ±0.43 52.56 ± 10.74 154.49 ± 26.30 1 170.00± 283.97
2.2 各组肝组织病理学变化 大体观察发现,正常组肝脏颜色红润,被膜光滑,有光泽,边缘锐利,质软而富有弹性。APAP组肝脏外观肿大,颜色略黄,出现灰黄色点状坏死灶,分布尚均匀,无光泽,质地较脆。CCl4组肝脏外观体积肿大,边缘钝而厚,色泽灰黄无光伴有黄褐色斑块,均匀分布,个别肝脏可见明显片状淤血。HDN+APAP组及HDN+CCl4组肝脏颜色稍红润,形态接近正常。光镜下可见,正常组肝小叶结构清晰完整,肝索排列整齐,肝细胞以中央静脉为中心呈放射状排列,大小均匀,无变性、坏死,无炎症细胞浸润等病理改变(见图1A)。APAP组肝细胞形态被破坏,可见明显围绕中央静脉的大片状坏死,肝细胞有不同程度的变性、坏死并伴大量炎性细胞浸润(见图1B)。与APAP组比较,HDN+APAP组肝细胞索形态接近正常,肝细胞坏死程度明显减轻,炎症细胞浸润显著减少(见图1D)。CCl4组肝组织肝小叶结构排列紊乱,肝细胞明显肿胀、坏死,伴明显组织充血和大量炎性细胞浸润(见图1C);与CCl4组比较,HDN+CCl4组肝肿胀程度明显减轻,肝小叶结构清楚,肝细胞排列较整齐,坏死明显减少,可见少量炎性细胞浸润,肝组织炎症明显改善(见图1E)。
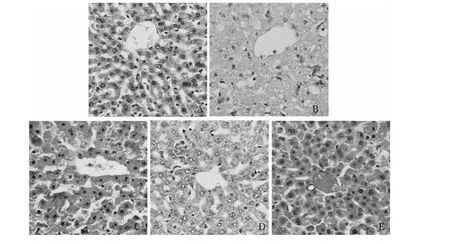
图1 各组肝脏病理学变化光镜图(HE×400)
3 讨论
橙皮苷来源广泛,价格低,易获取,主要存在于天然植物陈皮、枳实、柑橘皮中,尤其在中药陈皮中含量丰富[11]。橙皮苷具有多种药理、营养等价值活性,特别在医药领域其研究已涉及到心血管、内分泌、抗癌、抗突变、免疫、抗菌消炎、抗衰老等诸多方面。近年来橙皮苷在医药、食品、运动营养学等领域的研究日益深入,橙皮苷的化学成分及药理药效作用的进一步明确,使得其开发利用具有重大的经济和社会效益。
APAP是临床常用的解热镇痛药,过量使用或体内蓄积时可以造成严重的肝损害[12],其诱导小鼠急性肝损伤动物模型是临床上筛选保肝药物的常用模型之一。目前认为APAP在体内主要经肝细胞色素P450代谢,生成毒性中间代谢产物N-乙酸—对苯醌亚胺(NAPQI),其绝大部分与硫酸及葡葡糖醛酸结合,经肾脏排出体外。当APAP摄入量超过机体代谢限度时,NAPQI未能及时处理,就与肝细胞膜结合,引起细胞膜脂质过氧化反应,导致细胞坏死和死亡,造成肝损伤[13]。CCl4诱导急性肝损伤动物模型也是一种经典的筛选和研究肝炎治疗药物的病理模型[14],具有操作简便、适用性广和重复性好等优点。目前学者认为CCl4进入体内后,通过肝细胞色素P450而产生肝毒性代谢产物,生成活泼的三氯甲基自由基(·CCl3)和氯自由基(·Cl),这些自由基可使细胞膜脂质过氧化,使膜结构和功能破坏,并抑制细胞膜和微粒体膜上钙泵活性导致钙内流增加,从而导致肝细胞凋亡和坏死,内源性转氨酶释放到胞外[15]。APAP和CCl4引起的急性肝损伤均有通过肝细胞色素P450代谢而产生肝毒性产物导致肝细胞膜破坏造成肝细胞的损坏。但APAP引起药物性肝损伤,而CCl4则导致化学性肝损伤,两者损伤途径及机制有一定的不同。所以探讨橙皮苷对两种不同损伤机制引起的肝损伤是否具有保护作用,具有一定的实验意义。ALT和AST存在于正常肝细胞内,肝细胞受损时外排入血液,ALT活性主要反应肝细胞损伤,AST可反映线粒体的受损程度[16];LDH是一种糖酵解酶,它广泛存在于肝脏、心脏等多种组织器官当中。当组织器官出现病理变化时,LDH就会释放到血液中,是组织损伤的较敏感指标之一,临床上常用其活性来评定肝功能受损程度[17]。这三者是常用的判断肝脏损伤程度的重要指标。
本研究中,APAP模型组和CCl4模型组小鼠肝指数、血清ALT、AST、LDH的含量均明显升高,与正常组相比,差异均具有统计学意义(P<0.01或P<0.05),肝脏病理学切片肝细胞大片坏死,表明本研究成功建立APAP和CCl4所致急性肝损伤动物模型。与APAP模型组和CCl4模型组相比,APAP+HDN组和CCl4+HDN组小鼠肝指数、血清的ALT、AST、LDH含量各有所降低(P<0.01或P<0.05),病理组织学显示肝损伤坏死和炎细胞浸润程度均明显减轻,表明HDN对APAP和CCl4引起的急性肝损伤均具有保护作用。
综上所述,HDN对APAP和CCl4诱导小鼠急性肝损害均有一定的保护作用。因APAP、CCl4造成小鼠急性肝损害的机制不同,HDN可能通过作用于肝细胞不同的代谢环节而发挥对肝脏的保护作用,其具体机制还有待进一步研究。
[1]Kim JK,Sung NY,Srinrvasan P,et al.Effect of gamma irradiated hyaluronic acid on acetaminophen induced acute hepatotoxicity[J].Chem Biol Interact,2008,172(2):141-153.
[2]Choi EM,Kim YH.Hesperetin attenuates the highly reducing sugarrtiggered inhibition of osteob last differentiation[J].Cell Biol Toxicol,2008,24(3):225-231.
[3]Aranganathan S,Selvam JP,Sangeetha N,et al.Modulatory efficacy of hesperedin(citrus flavanone)on xenobiotic-metabolizing enzymes during 1,2-dimethylhydrazine-induced colon carcinogenesis[J].Chem Biol Interact,2009,180(2):254-261.
[4]李慧,杨中林.橙皮苷降血脂作用的实验研究[J].中医药学报,2010,1(38):23-25.
[5]Morand C,Dubray C,Milenkovic D,et al.Hesperidin contributes to the vascular protective effects of orange juice:a randomized crossover study in healthy volunteers[J].Am J Clin Nutr,2011,93(1):73-80.
[6]Garg A.Chemistry and pharm acology of the citrus bioflavonoid hesperidin[J].Phytother Res,2001,15(2):655.
[7]秦得安,王晓玲.橙皮苷对羟自由基的清除作用[J].中国药学杂志,1996,31(7):390.
[8]Al-Ashaal HA,El-Sheltawy ST.Antioxidant capacity of hesperidin from citrus peel using electron spin resonance and cytotoxic activity against human carcinoma cell lines[J].Pharm Biol,2011,49(3):276-282.
[9]Ju C,Reilly TP,Bourdi M.Protective role of Kupffer cells in acetaminophen induced hepatic injury in mice[J].Chem Res Toxicol,2002,15(12):1504-1513.
[10]Weber LW,Boll M,Stampfl A.Hepatotoxicty and mechanism of action of haloalkanes:carbon tetrachloride as a toxicological model[J].Crit Rev Toxicol,2003,33(2):105.
[11]Wilmsen PK,Spada DS,Salvador M.Antioxidantactivity of the flavonoid hesperidin in chemicaland biological systems[J].J Agric Food Chem,2005,53(12):4757-4761.
[12] Rumack BH.Acetaminophen hepatotoxicity:the first 35 years[J].J Toxicol Clin Toxicol,2002,40(1):3-20.
[13]James LP,Mayeux PR,Hinson JA.acetaminophen induced hepatotoxicity[J].Drug Metabolism Disposition,2003,31(12):1499.
[14]Jie Z,Shoutao G,Shezong S,et al.Anti-oxidation effect polysaccharides from herba scutellariae barbate[J].Medicinal Plant,2013,4(2):48-52.
[15]Weber LW,Boll M,Stampfl A.Hepatotoxicity andmechanism of action of haloalkanes:carbon tetrachlorideas a toxicological model[J].Crit Rev Toxicol,2003,33(2):105-136.
[16]Park CM,Cha YS,Youn HJ,et al.Amelioration ofoxidative stress by dandelion extract through CYP2E1 suppression against acute liver injury induced by carbon tetrachloride in Sprague-Dawley rats[J].Phytother Res,2010,24(9):1347-1353.
[17]毛文灏,赖敏玲.乳酸脱氢酶异常升高在缺血性肝炎诊断中的意义—附12例缺血性肝炎误诊分析[J].中西医结合肝病杂志,2003,Suppl(1):116-117.

