由废旧钛酸锂电极材料浸出液制备纳米TiO2
唐文江,周涛,段昊,王建,陈永斌
(中南大学化学化工学院,湖南长沙410083)
由废旧钛酸锂电极材料浸出液制备纳米TiO2
唐文江,周涛,段昊,王建,陈永斌
(中南大学化学化工学院,湖南长沙410083)
提出了一种从废旧钛酸锂电池中回收钛并制备成纳米TiO2的有效方法。采用尿素作沉淀剂,十二烷基苯磺酸钠(SDBS)作分散剂,采用均相沉淀法制备纳米TiO2,通过称量和扫描电镜(SEM)分析测试手段研究了钛离子浓度、尿素用量、反应温度、反应时间等因素对纳米TiO2的收率和粒径的影响。实验结果表明:钛离子质量浓度为60 g/L,分散剂质量分数为1.5%,n(CO(NH2)2)/n(TiOSO4)为3,反应温度为90℃,时间为2 h条件下,钛的收率达到90%以上。从扫描电镜图中可知,制备的纳米TiO2粒径约为100 nm。该方法为纳米二氧化钛的制备提供了一种新途径。
钛酸锂电池;浸出;均相沉淀法;纳米TiO2
0 引言
纳米二氧化钛(TiO2)主要有2种晶型结构:锐钛型和金红石型[1]。纳米二氧化钛作为一种半导体,具有较好的光催化活性和紫外线屏蔽性能,在废水处理、杀菌材料、空气净化材料和紫外屏蔽剂等领域有广阔的应用前景[2-5]。此外,纳米TiO2薄膜在光照下具有超亲水性和超永久性,采用这种材料处理过的玻璃和陶瓷具有自洁、防雾功能[6]。再加上纳米TiO2具有高折射率和反射率、化学稳定性、热稳定性、无毒性等优点,在催化剂载体、涂料、塑料、光导体和介质材料等领域已得到广泛应用[7-9]。
二氧化钛因具有独特的性能已引起人们普遍关注,对它的制备也进行了深入研究。制备纳米TiO2的方法很多,大致可分为气相法和液相法2类[10]。制备方法不同,所得纳米TiO2的性质存在差异,粒子的形状也会不同,而最常见的为球形粒子。其中液相法中的化学沉淀法又包括直接沉淀、共沉淀和均相沉淀等方法[11]。化学沉淀法是指向TiOSO4或TiCl4溶液中加入沉淀剂,然后进行加热处理。因其具有操作简单易行、成本低、对设备和技术的要求不高等优点,在生产纳米TiO2粉体时被广泛采用。
李易东[12]以硫酸法钛白粉生产中产生的硫酸氧钛(TiOSO4)为原料,用尿素作沉淀剂,采用均匀沉淀法,探索了反应物浓度、温度、沉淀剂和表面活性剂用量等条件对制备颗粒粒径分布的影响。H. Wang等[13]采用均相沉淀法,用尿素作沉淀剂,以工业级的硫酸氧钛为原料,研究了添加不同表面活性剂对制备纳米二氧化钛颗粒粒径的影响。P.E. Tsakiridis等[14]采用质量分数为10%的MgO作为一种缓慢调节溶液酸碱度的中和剂,在95℃条件下,从赤泥的硫酸浸出液中成功制备出锐钛型的纳米二氧化钛粉体。相较于非均相沉淀法,沉淀剂在溶液中是缓慢地生成(如尿素热分解生成水合氨分子),故溶液中的pH值是缓慢均匀地改变,这样使得生成的沉淀具有更好的晶型且颗粒尺寸和形状也更均匀[15]。本文以废钛酸锂电极材料的浸出液为原料制备纳米二氧化钛,在减少环境污染的同时实现了资源的再利用。
1 实验
1.1 实验试剂、仪器和方法
实验采用硫酸和双氧水浸出钛酸锂(Li4Ti5O12)电极材料所得的含钛溶液作为直接原料,通过滴加亚硫酸钠溶液除去其中的双氧水,则钛以TiOSO4形式存在,其质量分数为5.5 g/L。以尿素为沉淀剂,OH-与硫酸氧钛反应生成纳米TiO2的反应原理如下:
尿素水解生成水合氨分子
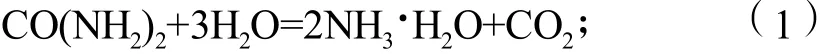
水合氨分子电离分解出OH-
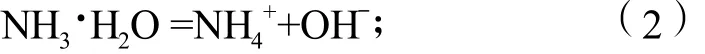
电离出的OH-与硫酸氧钛反应得到水合TiO2沉淀
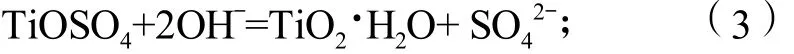
水合TiO2煅烧得到纳米TiO2
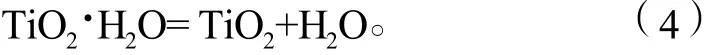
纳米颗粒的析出并形成由2个过程构成:一个是成核过程,即核的形成过程;另一个是生长过程,即核的长大过程。沉淀物的粒径取决于二者的相对速度,为了获得纳米颗粒,必须保证生长速度小于成核速度,这样就需要很好地控制核的形成与核的生产过程。如果采用滴加沉淀剂的方法直接与反应物反应,很容易造成沉淀剂浓度局部过大,使溶液中非均相成核和均相成核同时进行,造成生成的沉淀粒径不均匀。而以尿素为沉淀剂宿主时,沉淀剂不是直接与TiOSO4反应,而是通过尿素水解生成的构晶离子OH-与TiOSO4反应。尿素溶液在加热下水解(式(1))反应缓慢,是整个反应的控制步骤,这样构晶离子就能够均匀地分散在溶液中,与TiOSO4可达到分子水平的混合,而不会造成反应物浓度在溶液中突然增大,确保在整个溶液中均匀地反应。
实验流程如图1所示,实验的主要仪器和试剂分别如表1~2所示。
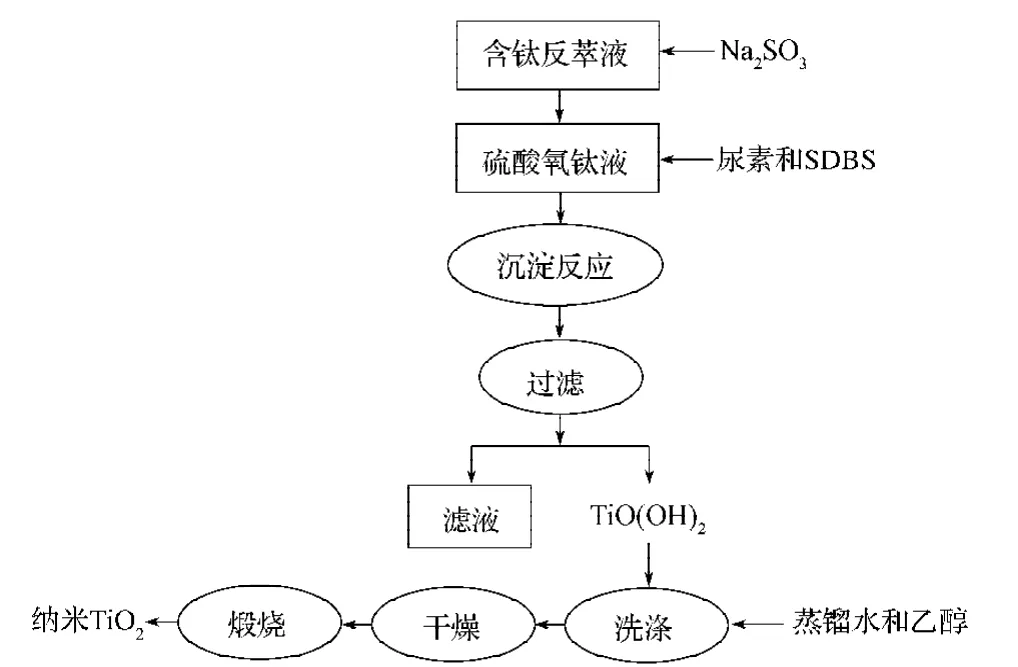
图1 纳米二氧化钛制备流程图Fig.1Flowchart of nano TiO2preparation
表1 实验仪器Table 1Experiment instruments

表2 化学试剂Table 2Chemical agents
1.2 样品分析与测试
1.2.1 收率计算
收率计算公式为:

1.2.2 粒径分析
用玻璃棒沾取少量的纳米样品于导电胶带上,置于SEM金属试样台上,进行喷金镀膜后,用JSM-5600LV型扫描电子显微镜在20 kV工作电压下表征。图2是部分不同条件下制备的二氧化钛扫描电镜照片,其实验条件和颗粒评价尺寸如表3所示。

图2 不同条件下二氧化钛扫描电镜图Fig.2SEM micrograph of TiO2powder at different conditions
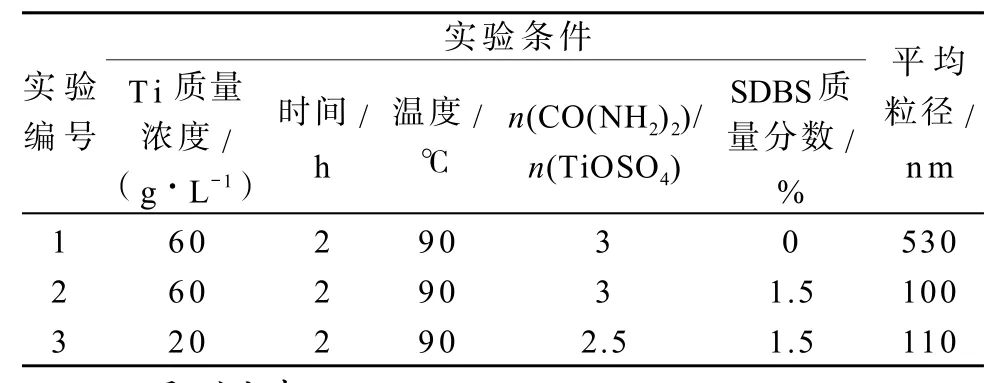
表3 不同实验条件制备的二氧化钛粒径Fig.3Particle size of TiO2prepared at different experiment conditions
1.2.3 晶型分析
将煅烧后得到的纳米TiO2用Bruker D8 ADVANCE型X射线衍射仪进行晶型测试,波长为0.154 06 nm,扫描角度范围为10~80°,扫描速度为3°/min。图3是XRD图谱,通过与标准物质卡(JCPDS卡)进行比较可知,制得的纳米二氧化钛晶型是锐钛型。
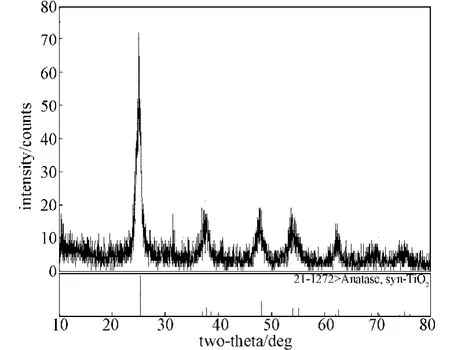
图3 二氧化钛XRD图谱Fig.3X-ray diffraction pattern of TiO2powder
2 结果与讨论
2.1 钛浓度对反应的影响
理论上,钛酸锂和双氧水的反应方程式为
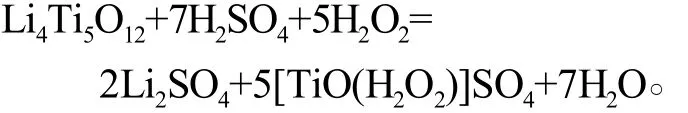
通过滴加亚硫酸钠溶液除去双氧水后的溶液中钛的质量浓度为5.5 g/L,通过旋转蒸发一定量体积的水后得到不同质量浓度的含钛溶液(5.5~88 g/L)。二氧化钛收率与钛质量浓度的关系如图4所示,钛质量浓度对二氧化钛粒径的影响见表4。
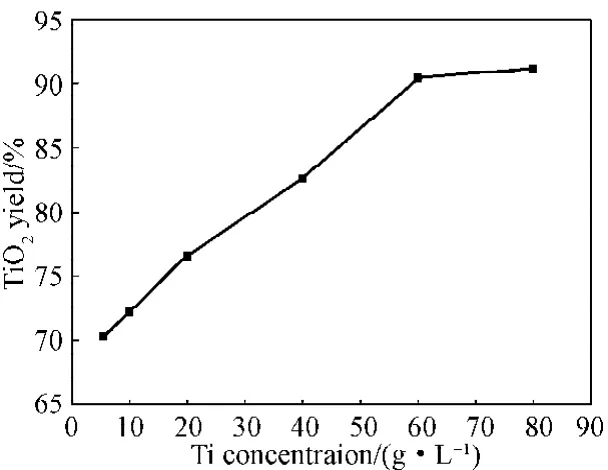
图4 二氧化钛收率与钛质量浓度的关系Fig.4Yield of TiO2in relation to concentration of Ti
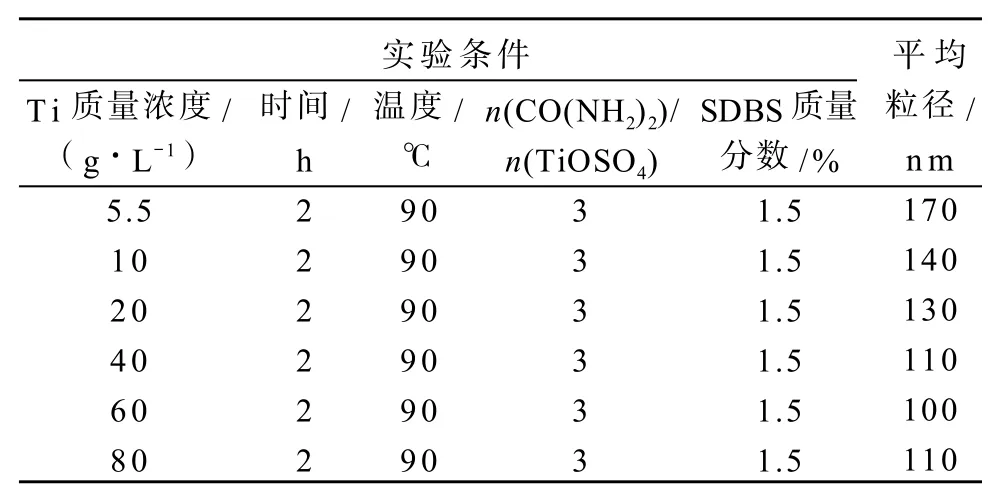
表4 二氧化钛粒径与钛质量浓度的关系Table 4Particle size of TiO2in relation to concentration of Ti
由图4可以看出,二氧化钛的收率随着钛浓度的增大而增大,当原料中钛离子质量浓度达到60 g/L时,二氧化钛的收率达到90%以上,之后继续增大钛离子浓度对二氧化钛收率提升影响不大,故最佳质量浓度为60 g/L。
由表4可知,随着钛浓度的增加,纳米二氧化钛粒径先减小后增大。这是因为随着溶液中钛离子浓度的增加,单位时间内产生晶核的数量增多,使得晶核生成速率大于晶核长大速率,晶体粒径减小。但当钛离子浓度达到一定值后,会抑制溶液中硫酸氧钛的水解,从而使得晶核生成量减少,故晶体粒径增大。由实验可知在钛质量浓度为60 g/L左右时,所得到的产物粒径最小。
2.2 尿素用量对反应的影响
二氧化钛收率与尿素用量的关系如图5所示,尿素用量对二氧化钛粒径的影响见表5。
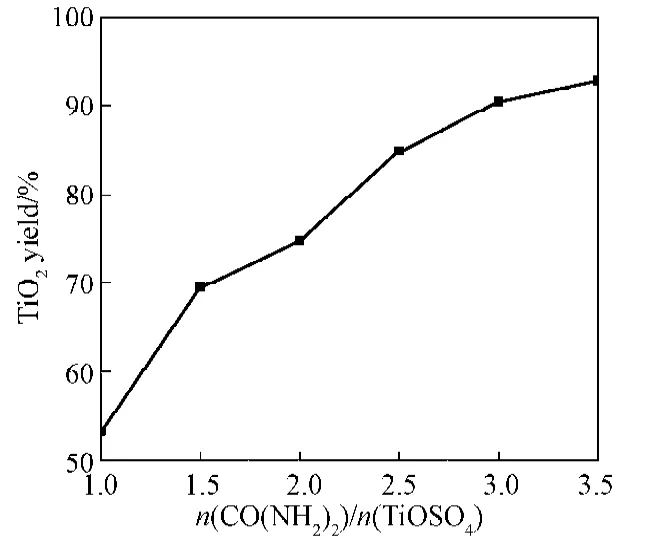
图5 尿素用量与二氧化钛收率的关系Fig.5Yield of TiO2in relation ton(CO(NH2)2)/n(TiOSO4) contents
由图5可知,随着尿素用量的增加,二氧化钛的收率逐渐升高。这是因为在溶液中钛离子浓度一定时,增加尿素的量意味着溶液中的OH-浓度增加,从而保证在一定时间内OH-能与硫酸氧钛充分反应,因此收率就会增大。当尿素和溶液中硫酸氧钛配比为3时,二氧化钛收率达到90%,在配比为3.5时收率没有明显提升,综合考虑选择配比为3较合适。
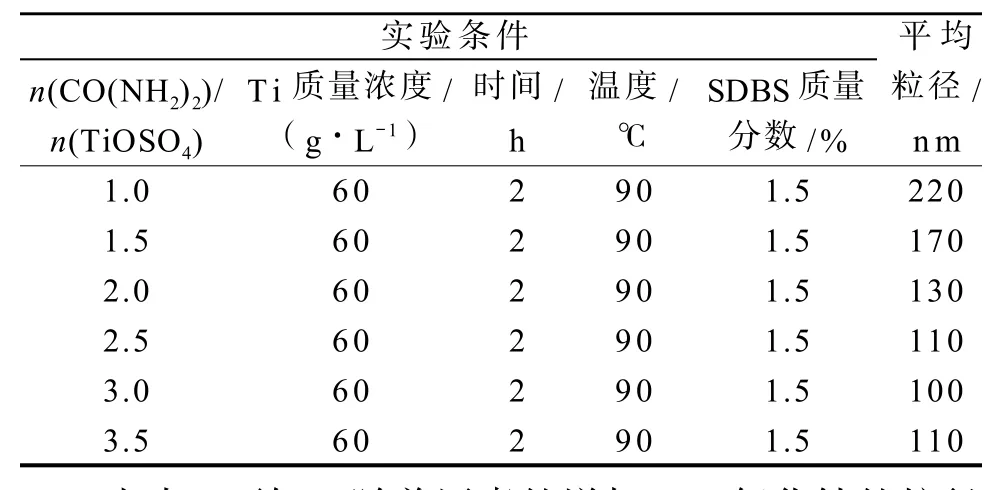
表5 二氧化钛粒径与尿素用量的关系Table 5Particle size of TiO2in relation ton(CO(NH2)2)/n(TiOSO4) contents
由表5可知,随着尿素的增加,二氧化钛的粒径逐渐减小,这是因为尿素用量增加使得溶液中的构晶粒子OH-过饱和度增加,有利于晶核的生成,故颗粒的尺寸降低。但尿素用量不宜过高,因为未溶解的尿素表面有可能吸附纳米二氧化钛使得颗粒尺寸变大。
2.3 表面活性剂对反应的影响
一般而言,表面活性剂用量对二氧化钛的收率影响很小,故在此不作讨论。但表面活性剂对二氧化钛颗粒的尺寸大小影响显著,因为表面活性剂能够在粒子表面形成双电层[14],使粒子表面自由能降低,抑制粒子凝聚。本文选用的表面活性剂是阴离子型的十二烷基苯磺酸钠(SDBS),表6列出了所得二氧化钛颗粒尺寸与表面活性剂SDBS用量的关系。
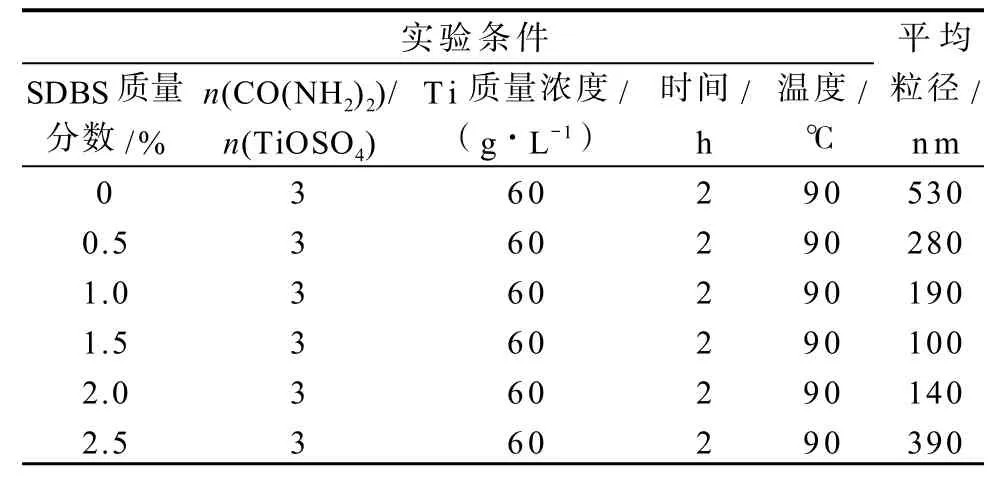
表6 二氧化钛粒径与SDBS用量的关系Table 6Particle size of TiO2in relation to concentration of SDBS
从表6可以看出,在不添加表面活性剂时,颗粒的尺寸最大,几乎没有纳米级的二氧化钛生成。随着表面活性剂加入,粒子的尺寸逐渐减小,当表面活性剂质量分数为1.5%时,颗粒尺寸最小。继续增加表面活性剂用量会使颗粒粒径增大,因为溶液粘性增加,一方面使粒子运动变得困难,另一方面粒子的表面张力会增大,使颗粒尺寸增大。
2.4 温度对反应的影响
图6是二氧化钛收率与反应温度的关系图。从图可以看出,随着温度的升高,二氧化钛收率逐渐增加。这是因为尿素的水解速率随温度的升高而变大,溶液中的构晶离子增加,相互碰撞形成晶核的几率更高。当温度升高至90 ℃时,二氧化钛收率达到最大,故温度控制在90 ℃为宜。
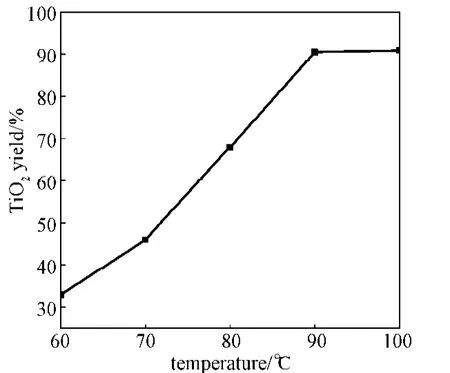
图6 二氧化钛收率与反应温度的关系Fig.6Yield of TiO2in relation to temperature
表7列出的是产物粒径与反应温度的关系。由表可知,为了得到较小尺寸的二氧化钛,反应温度不能太低。因为在较高的温度条件下,尿素水解率增加,离子通过相互碰撞聚集形成晶核的几率增大,生成晶核的数量相对较多,因此晶核生长速度就会小于晶核形成速度,得到的颗粒尺寸就会较小。

表7 二氧化钛粒径与温度的关系Table 7Particle size of TiO2in relation to temperature
2.5 反应时间对反应的影响
图7是二氧化钛收率与反应时间的关系图。由图可知,二氧化钛的收率随反应时间的增加而升高,这是因为尿素的水解率随时间的增大而增大,所以延长反应时间有利于提高产物收率。当反应时间达到2 h后,继续增加反应时间对二氧化钛收率影响不大,说明其中硫酸氧钛已基本反应完全,故选择2 h反应时间为最佳。
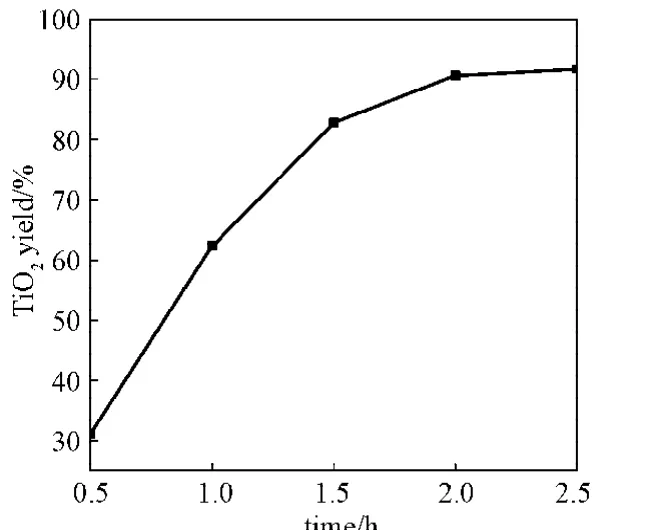
图7 二氧化钛收率与反应时间的关系Fig.7Yield of TiO2in relation to time
2.6 后处理条件对颗粒粒径的影响
均相沉淀法制得的二氧化钛前驱体在煅烧前需要经过洗涤和干燥步骤。实验结果表明,将前驱体用乙醇洗涤对颗粒的粒径改善有一定的效果。这是因为乙醇在洗涤时具有一定表面处理剂的作用,可以交换沉淀中的游离水,一是可以降低表面能,提高烘干效率,二是能够起到屏蔽作用,阻止表面羟基因形成桥接或化学键而导致的硬团聚,从而有效地减少粗粒子的生成。在干燥的过程中,温度不宜过高,因为过高的温度容易导致颗粒间真正的化学键作用,形成难以分散的硬团聚。因此,本实验选择用乙醇洗涤和低温烘干相结合的方法处理前驱体,可以有效改善产品的粒径大小。
3 结论
以尿素作沉淀剂,与废旧钛酸锂正极材料浸出液中分离出来的钛溶液反应,采用均匀沉淀法制备纳米二氧化钛,得到的产品纯度高,粒径均匀。
纳米二氧化钛的收率会随着钛离子浓度、尿素用量、反应温度、反应时间的增大而增加;钛离子浓度、尿素用量、反应温度和表面活性剂用量会影响纳米二氧化钛粒径大小,其中钛离子浓度和表面活性剂用量影响显著。最佳的反应条件是:钛离子质量浓度为60 g/L,表面活性剂质量分数为1.5 %,n(CO(NH2)2)/n(TiOSO4)为3,反应温度为90℃,反应时间为2 h。制得的纳米二氧化钛晶型是锐钛型,尺寸约为100 nm。
[1]Suzuki Y,Pavasupree S,Yoshikawa S,et al. Direct Synthesis of an Anatase TiO2Nanofiber/Nanoparticle Composite Powder from Natural Rutile[J]. Physica Status Solidi (a),2007,204(6):1757-1761.
[2]Zhang Q H,Gao L,Guo J K. Preparation and Characterization of Nanosized TiO2Powders from Aqueous TiCl4Solution[J]. Nanostructured Materials,1999,11(8):1293-1300.
[3]Reck E,Richards M. TiO2Manufacture and Life Cycle Analysis[J]. Pigment & Resin Technology,1999,28(3):149-157.
[4]Li Y,Demopoulos G P. Precipitation of Nanosized Titanium Dioxide from Aqueous Titanium (IV) Chloride Solutions by Neutralization with MgO[J]. Hydrometallurgy,2008,90 (1):26-33.
[5]魏刚,黄海燕,熊蓉春. 纳米二氧化钛的光催化性能及其在有机污染物降解中的应用[J]. 现代化工,2003,23(1):20-23. Wei Gang,Huang Haiyan,Xiong Rongchun. Photocatalytic Performance and Applications of Nano Titanium Dioxide in Degrading Organisms[J]. Modern Chemical Industry,2003,23(1):20-23.
[6]Lasheen T A. Sulfate Digestion Process for High Purity TiO2from Titania Slag[J]. Frontiers of Chemical Engineering in China,2009,3(2):155-160.
[7]徐兆瑜. 纳米TiO2的新功能及其应用进展[J]. 化工技术与开发,2003,32(6):27-32. Xu Zhaoyu. New High Functional Materials of Nanometer Titanium Dioxide and Its Application[J]. Technology &Development of Chemical Industry,2003,32(6):27-32.
[8]徐瑞芬,许秀艳,付国柱. 纳米二氧化钛在抗菌塑料中的应用性能研究[J]. 塑料,2002,31(3):26-29. Xu Ruifen,Xu Xiuyan,Fu Guozhu. Applied Properties of Nano-Titania in Antibacterial Plastics[J]. Plastics,2002,31(3):26-29.
[9]林安,程学群,张三平,等. 纳米二氧化钛表面化学改性及在涂料中的应用[J]. 材料保护,2002,35(11):6-7. Lin An,Cheng Xuequn,Zhang Sanping,et al. Surface Chemical Modifications of Nano-Titanium Oxide and Its Applications in Coating[J]. Materials Protection,2002,35(11):6-7.
[10]姚超,朱毅青,成庆堂,等. 纳米级二氧化钛粉体的制备方法和发展趋势[J]. 现代化工,2000,20(7):20-22. Yao Chao,Zhu Yiqing,Cheng Qingtang,et al. Preparation Methods and Development Trends of Nanometer Titanium Dioxide Powder[J]. Modern Chemical Industry,2000,20 (7):20-22.
[11]Cauqui M A,Rodriguez-Izquierdo J M. Application of the Sol-Gel Methods to Catalyst Preparation[J]. Journal of Non-Crystalline Solids,1992,147/148:724-738.
[12]李易东. 纳米TiO2制备及光催化性能研究[D]. 重庆: 重庆大学,2002. Li Yidong. Study on Nanometer TiO2Preparation and Light Catalysis Property[J]. Chongqing:Chongqing University,2002.
[13]Wang H,Liu P,Cheng X,et al. Effect of Surfactants on Synthesis of TiO2Nano-Particles by Homogeneous Precipitation Method[J]. Powder Technology,2008,188 (1):52-54.
[14]Tsakiridis P E,Oustadakis P,Katsiapi A,et al. Synthesis of TiO2Nano-Powders Prepared from Purified Sulphate Leach Liquor of Red Mud[J]. Journal of Hazardous Materials,2011,194:42-47.
[15]ubrt J,tengl V,Bakardjieva S,et al. Synthesis of Spherical Metal Oxide Particles Using Homogeneous Precipitation of Aqueous Solutions of Metal Sulfates with Urea[J]. Powder Technology,2006,169(1):33-40.
(责任编辑:邓光辉)
Preparation of Nano TiO2from Leach Liquor of Waste Lithium Titanate Electrode Material
Tang Wenjiang,Zhou Tao,Duan Hao,Wang Jian,Chen Yongbin
(School of Chemistry and Chemical Engineering,Central South University,Changsha 410083,China)
A promising process for recovering titanium and lithium from waste lithium titanate battery and producing nano TiO2is proposed. Nano TiO2is synthesized via homogeneous precipitation with urea as precipitating agent and sodium dodecyl benzene sulfonate(SDBS) as dispersant. The effects of Ti concentration, urea contents, reacting temperature and time on the nano TiO2production rate and crystal size are studied by weighing and SEM analysis methods. The results indicate that the Ti recovery percentage achieved 90% on the conditions of Ti ion concentration of 60 g/L, SDBS mass fraction of 1.5% and n(CO(NH2)2)/n(TiOSO4) ratio of 3 at 90℃ for 2 h. The SEM image of the hydrolyzed product indicates the nano TiO2particle size is about 100 nm. The approach presents a new way to prepare nanometer titanium dioxide.
lithium titanate battery;leaching;homogeneous precipitation;nano TiO2
TQ949
A
1673-9833(2014)04-0096-06
10.3969/j.issn.1673-9833.2014.04.021
2014-05-14
唐文江(1987-),男,湖南邵阳人,中南大学硕士生,主要研究方向为废旧锂离子电池回收,纳米材料,E-mail:twj0209@qq.com

