异柠檬酸脱氢酶1基因突变焦磷酸测序检测方法的建立
王丹慧 蔡彦宁 张燕莉 高 杰 杨彩侠
(首都医科大学宣武医院神经生物学研究室教育部神经变性病重点实验室北京市老年病医疗研究中心,北京 100053)
胶质瘤是最常见的原发性颅内肿瘤,其中恶性胶质瘤的发病率为(5~8)/100万,5年病死率在全身肿瘤中仅次于胰腺癌和肺癌,位列第3位。胶质瘤给社会和家庭造成了巨大负担,因而一直是肿瘤研究的热点[1]。
异柠檬酸脱氢酶1(isocitrate dehydrogenase 1,IDH1)是胶质瘤研究领域的重要分子标志物。IDH1是否存在突变和胶质瘤患者的预后、胶质瘤的鉴别诊断以及指导放射治疗化学治疗密切相关。IDH1突变最早为Parsons等[2]所发现,该研究显示约12%的多形性胶质母细胞瘤患者存在IDH1第132位精氨酸的突变。在绝大多数携带突变的患者中,IDH1第132位精氨酸突变为组氨酸(R132H,CGT→CAT)[3-5],少数患者突变为半胱氨酸(R132C,CGT→TGT),或丝氨酸(R132S,CGT→AGT)、甘氨酸(R132G,CGT→GGT)、亮氨酸(R132L,CGT→CTT)、缬氨酸(R132V,CGT→GTT)、脯氨酸(R132P,CGT→CCT)[3,6]。Par-sons等[2]的研究还提示,相同病理级别情况下,IDH1突变患者较野生型患者的预后好。随后的研究[7-8]进一步揭示IDH1基因突变是胶质瘤独立的、强大的较野生型IDH1预后好的标志物。有学者[9-11]也对IDH1突变在不同类型胶质瘤中的分布情况展开研究,结果表明,IDH1突变主要出现于低级别胶质瘤和继发性胶质母细胞瘤中,原发性胶质母细胞瘤、儿童多形性胶质母细胞瘤、毛细胞型星形细胞瘤中IDH1突变率极低。提示对于组织病理学诊断不明确的样本,可以通过 IDH1基因突变检测进行辅助鉴别诊断[12]。Wick等[13]报道,新诊断的间变胶质瘤患者可以基于IDH1突变与否选择放射治疗或化学治疗。Houillier等[14]的研究进一步显示,IDH1突变联合1p-19q缺失的低级别胶质瘤患者,化学治疗效果更优。提示IDH1突变对胶质瘤患者的放射治疗或化疗化学治疗方案及生存时间评估具有指导及提示意义。
由于IDH1突变检测的重要性,多种检测方法相继建立。其中,直接测序法是应用最为广泛的经典检测手段。近年来,焦磷酸测序法由于能够检测低比例突变的存在,也日益受到重视。然而,焦磷酸测序法检测IDH1突变的灵敏度尚无报道,这也导致鉴别突变存在与否时依赖主观判断。此外,通过焦磷酸测序或直接测序分析IDH1突变结果是否存在差异也有待明确。为此,本研究首先构建野生型和突变型IDH1质粒;继而使用已知比例的混合野生型、突变型IDH1质粒作为模板,分析焦磷酸测序法检测突变IDH1的灵敏度,明确了判别突变存在与否的客观标准。最后分别使用焦磷酸测序法和直接测序法分析了96例胶质瘤患者的IDH1基因的突变情况,结果表明焦磷酸测序法能够更加灵敏地检测突变。
1 材料与方法
1.1 标本来源
选取首都医科大学宣武医院神经外科自2008年3月至2011年6月手术切除并经病理证实的人脑胶质瘤标本96例,经首都医科大学宣武医院伦理委员会批准,并获得患者的知情同意,样本经石蜡包埋,留后续实验使用。
1.2 主要试剂与仪器
Chelex(美国 BioRad公司),蛋白酶 K(上海Sangon公司),Ex Tag Hot Start Version(日本Takara公司),PyroMark Gold Q96 Reagents(德国Qiagen公司),Streptavidin SepharoseTMBeads(美国GE公司)。Nanodrop 2000分光光度计(美国Thermo公司),PTC-100基因扩增仪(美国MJ research公司),PyroMark Q96 ID焦磷酸测序仪(德国Qiagen公司)。
1.3 质粒构建及直接测序
由上海生工公司依照IDH1野生型及7种突变型(R132H,R132C,R132S,R132G,R132L,R132V,R132P)序列化学合成8种片段(表1),插入PUC57质粒载体,获得相应质粒,送诺赛公司直接测序。

表1 野生型和突变型IDH1基因型序列Tab.1 The sequences of wide-type and mutant-type IDH1 genotypes
1.4 焦磷酸测序检测质粒基因型
将8种质粒进行焦磷酸测序以验证插入片段序列的准确性及两种方法检测的一致性。PCR扩增正向引物序列为5’-GCTTGTGAGTGGATGGGTAAA-3’,反向引物序列为5’-TTGCCAACATGACTTACTTGATC-3’(生物素标记),扩增产物长度75 bp。PCR反应总体积50 μL,其中正向引物(10 μmol)及反向引物(10 μmol)各 1 μL,25 mmol dNTP 4 μL,10 × Ex Tag Buffer 5 μL,TaKaRa Ex TaqTMHS 0.25 μL,36.75 μL 超纯水,模板质粒2 μL(2 000拷贝)。反应条件:94℃预变性2 min;94℃变性20 s,58℃退火20 s,72℃延伸20 s,36个循环;最后72℃延伸5 min。PCR产物经琼脂糖凝胶电泳确认后进行焦磷酸测序。
焦磷酸测序引物为:5’-GGGTAAAACCTATCATCATA-3’;分析序列:位点1为 GGTNGTCATGCTTAT,位点2为GGTCNTCATGCTTAT;碱基分配顺序:CGTGCAGTCAT。测序体系80 μL,96孔板中加入PCR产物15 μL,Streptavidin SepharoseTMBeads 3 μL,PyroMark Binding Buffer 40 μL,超纯水22 μL,室温震荡混匀。上负压工作站,依次以70%乙醇、0.2 mol/L NaOH以及1 x Wash Buffer冲洗,以除去非生物素化的DNA片段。在测序板中释放生物素化的DNA片段,测序板每孔预先加入测序引物S(0.4 μmol/L)40 μL。随后80 ℃加热测序板2 min,室温冷却5 min,即可上机进行测序。
1.5 胶质瘤样本基因组DNA提取
取10 μm 蜡块切片(1.5 cm ×2 cm)5 张,加1 mL二甲苯,65℃恒温震荡10 min,10 700 r/min,离心5 min,去上清,重复二甲苯处理3次。加无水乙醇 1 mL,混匀,10 700 r/min,离心 5 min,去上清,以 95%、75% 乙醇各离心沉淀1次。空气干燥,加入200 μL的5%Chelex悬浮沉淀,加入5 μL蛋白酶K(20 mg/mL),55℃震荡3 h至溶液澄清。98℃ 10 min灭活蛋白酶K。简短离心后取上清放入新离心管,加入20.5 μL NaAC(3 mol/L,pH 5.2),450 μL 无水乙醇,混匀,-20℃冷冻1 h。10 700 r/min,离心5 min,去上清,加70%乙醇1 mL,10 700 r/min,离心 5 min,去上清。干燥,DNA溶解于100 μL TE缓冲液。
1.6 直接测序法检测胶质瘤样本IDH1突变
PCR扩增正向引物序列为5’-CGGTCTTCAGAGAAGCCATT-3’,反向引物序列为5’-GCAAAATCACATTATTGCCAAC-3’,扩增产物长度129 bp。PCR反应总体积25 μL,其中正向引物(5 μmol)及反向引物(5 μmol)各 1.25 μL,25 mmol dNTP 2 μL,10 × Ex Tag Buffer 5 μL,TaKaRa Ex TaqTMHS 0.125 μL,15.875 μL 超纯水,模版 DNA 2 μL(50 ng)。反应条件:94℃预变性40 s;94℃变性20 s,59℃退火20 s,72℃延伸20 s,36个循环;最后72℃延伸5 min。取PCR产物经琼脂糖凝胶电泳确认后送生工公司,使用扩增引物正反向测序。
1.7 焦磷酸测序法检测胶质瘤样本IDH1突变
PCR扩增正向引物序列为5’-GCTTGTGAGTGGATGGGTAAA-3’,反向引物序列为5’-TTGCCAACATGACTTACTTGATC-3’(生物素标记),扩增产物长度75 bp。PCR反应总体积50 μL,其中正向引物(10 μmol)及反向引物(10 μmol)各 1μL,25 mmol dNTP 4 μL,10× Ex Tag Buffer 5 μL,TaKaRa Ex TaqTMHS 0.25 μL,36.75 μL 超纯水,模板 DNA 2 μL(50 ng)。反应条件:94℃预变性2 min;94℃变性20 s,58℃退火20 s,72℃延伸20 s,36个循环;最后72℃延伸5 min。PCR产物经琼脂糖凝胶电泳确认后进行焦磷酸测序。
焦磷酸测序引物为:5’-GGGTAAAACCTATCATCATA-3’;分析序列:位点1为 GGTNGTCATGCTTAT,位点2为 GGTCNTCATGCTTAT;碱基分配顺序:CGTGCAGTCAT。测序体系80 μL,96孔板中加入PCR产物 15 μL,Streptavidin SepharoseTMBeads 3 μL,Pyro-Mark Binding Buffer 40 μL,超纯水 22 μL,室温震荡混匀。上负压工作站,依次以 70%乙醇、0.2 mol/L NaOH以及1×Wash Buffer冲洗,以除去非生物素化的DNA片段。在测序板中释放生物素化的DNA片段,测序板每孔预先加入测序引物S(0.4 μmol/L)40 μL。随后80℃加热测序板2 min,室温冷却5 min,即可上机进行测序。
1.8 统计学方法
采用SPSS 18.0统计学软件进行数据处理和统计分析,计数资料采用百分数表示,两种测序方法突变检出阳性率的比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 野生型和突变型IDH1质粒的构建
8种质粒经诺赛测序公司直接测序,验证插入片段序列正确。
2.2 焦磷酸测序法的建立
使用构建的IDH1质粒为模板,扩增得到75 bp的产物,凝胶电泳显示扩增产物长度正确(图1)。使用焦磷酸测序引物对质粒扩增产物进行测序反应,结果与直接测序结果一致(图2)。
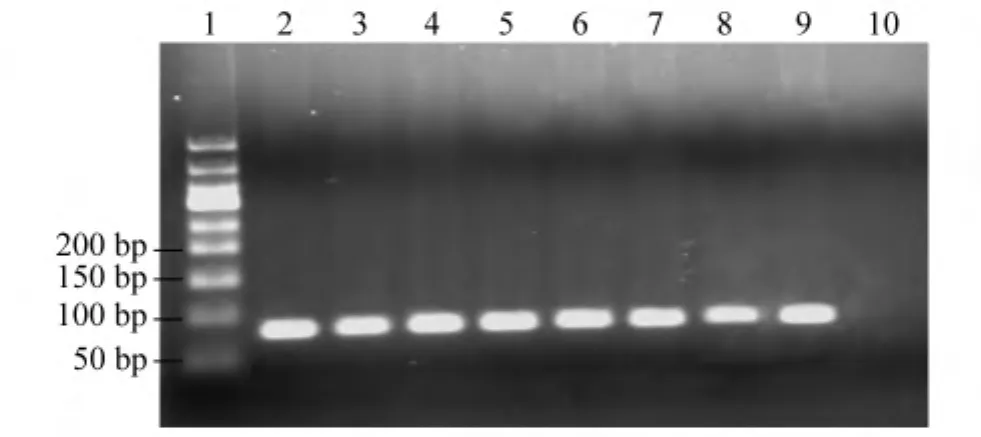
图1 野生型和突变型IDH1基因扩增产物电泳图Fig.1 Electrophoresis of wide-type and mutant IDH1
2.3 焦磷酸测序法灵敏度的分析
将携带R132H突变的质粒与野生型质粒按照1∶9,1∶19,1∶49,1∶99 混合,其中突变 DNA 分别占总DNA含量的10%,5%,2%,1%。以上述混合DNA为模板,扩增后进行焦磷酸测序,每组实验重复3次。结果表明焦磷酸测序法3次均成功检测出占总DNA含量2%的突变。对于占总DNA含量1%的突变,焦磷酸测序法检测的成功率为66.7%(2/3)(图3)。使用携带其他类型突变的质粒与野生型质粒混合,检测焦磷酸测序法的灵敏度,结果同样显示突变检测灵敏度为2%。
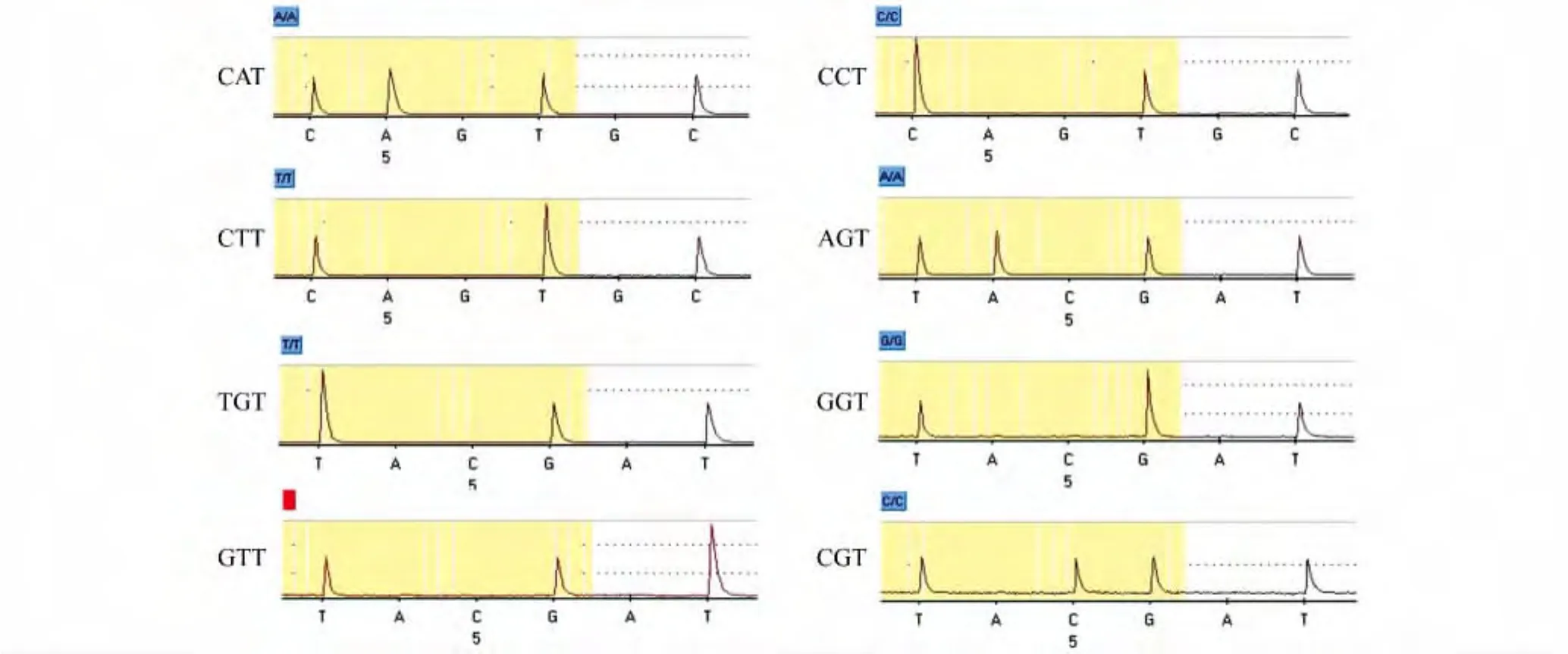
图2 野生型和突变型IDH1基因焦磷酸测序图Fig.2 Pyrosequencing analysis of wide-type and mutant IDH1

图3 焦磷酸测序检测IDH1突变灵敏度分析Fig.3 Sensitivity analysis of pyrosequencing in IDH1 mutation examination
2.4 胶质瘤样本直接测序和焦磷酸测序的比较
分别使用直接测序法和焦磷酸测序法检测96例胶质瘤样本的突变情况。如表2所示,直接测序法仅能检出两种形式的突变,突变样本占样本总量的32.3%。焦磷酸测序法能够检出六种形式的突变,突变样本占样本总量的74.0%。两种方法突变检出率相比差异有统计学意义(P<0.05)。

表2 焦磷酸测序法和直接测序法检测IDH1基因突变的比较Tab.2 Comparison between pyrosequencing and direct sequencing in IDH1 mutations examination
3 讨论
目前已经建立多种IDH1突变检测方法,包括免疫组织化学法、高分辨率熔解曲线法、直接测序法、焦磷酸测序法等[15-16]。免疫组化法检测依赖特异抗体,由于野生型和突变型IDH1仅存在一个氨基酸的差异,蛋白结构非常相似,从而导致抗体特异性识别的困难。有报道[3]显示,IDH1-R132H单克隆抗体与R132L蛋白有交叉反应。高分辨率熔解曲线依靠分析DNA片段解链温度的差异辨识突变是否存在。由于一些突变与野生型间解链温度差别不大,难以被检出。此外,当突变基因占比较小时,其对整体峰型的影响容易被忽视,也会导致误判[17-18]。直接测序法是应用最为广泛的IDH1突变检测方法。然而该方法灵敏度低,突变DNA占总DNA的20%以上方可被检出。这就带来了误诊的可能[17-20]。焦磷酸测序法操作简便,检测快速,在2~3 h内即可完成,特别适合临床诊断。而且与直接测序相同,本方法能够通过一次反应精确判定突变的类型,为免疫组织化学和高分辨率熔解曲线等方法无法比拟。与直接测序相比,焦磷酸测序能够更加灵敏地检测出低比例突变的存在,从而能够弥补肿瘤细胞样本采集过程中难以避免的肿瘤细胞占比低的不足,对于肿瘤突变相关检测意义重大。
焦磷酸测序方法正越来越多地用于IDH1突变的检测,但其检测灵敏度仍无报道。以往的研究中一般人为设定5%作为判定是否存在突变的标准。本研究表明,焦磷酸测序检测IDH1突变的灵敏度可以达到2%,甚至更高。为今后判定IDH1突变提供了客观的参照。本课题组的结果还表明焦磷酸测序法对于患者突变与否的判定与直接测序法间存在明显差异。依据焦磷酸测序结果对患者进行判定,并跟踪随访将有助于进一步阐明IDH1作为生物标记物对于胶质瘤的意义。同时,焦磷酸测序法还能够定量分析突变基因所占比例。可以推测,突变比例的高低很可能对于预后判断、用药指导等方面也具有重要的意义,值得进一步研究。
[1]康春生,浦佩玉.脑胶质瘤信号转导通路研究进展[J].中国现代神经疾病杂志,2008,8(5):388-392.
[2]Parsons D W,Jones S,Zhang X,et al.An integrated genomic analysis of human glioblastoma multiforme[J].Science,2008,321(5897):1807-1812.
[3]Agarwal S,Sharma M C,Jha P,et al.Comparative study of IDH1 mutations in gliomas by immunohistochemistry and DNA sequencing[J].Neuro Oncol,2013,15(6):718-726.
[4]任晓辉,崔向丽,尚志梅,等.少枝胶质肿瘤异柠檬酸脱氢酶1基因突变特点分析[J].中华医学杂志,2012,92(11):724-726.
[5]Jha P,Suri V,Sharma V,et al.IDH1 mutations in gliomas:first series from a tertiary care centre in India with comprehensive review of literature[J].Exp Mol Pathol,2011,91(1):385-393.
[6]Bleeker F E,Lamba S,Leenstra S,et al.IDH1 mutations at residue p.R132(IDH1R132)occur frequently in highgrade gliomas but not in other solid tumors[J].Hum Mutat,2009,30(1):7-11.
[7]郑勇,王继超,杨小朋,等.不同病理级别胶质瘤细胞中IDH1基因变异表达观察[J].中国神经肿瘤杂志,2012,10(3):143-146.
[8]YanH,Parsons D W,Jin G,et al.IDH1 and IDH2 mutations in gliomas[J].N Engl J Med,2009,360(8):765-773.
[9]Gravendeel L A,Kloosterhof N K,Bralten L B,et al.Segregation of non-p.R132H mutations in IDH1 in distinct molecular subtypes of glioma[J].Hum Mutat,2010,31(3):E1186-E1199.
[10]Nobusawa S,Watanabe T,Kleihues P,et al.IDH1 Mutations as molecular signature and predictive factor of secondary glioblastomas[J].Clin Cancer Res,2009,15(19):6002-6007.
[11]Horbinski C,Kofler J,Kelly L M,et al.Diagnostic use of IDH1/2 mutation analysis in routine clinical testing of formalin-fixed,paraffin-embedded glioma tissues[J].J Neuropathol Exp Neurol,2009,68(12):1319-1325.
[12]杨燕武,谢飞,汤俊佳,等.IDH1基因突变对胶质瘤诊断及预后意义[J].中国现代神经疾病杂志,2012,12(6):712-718.
[13]Wick W,Hartmann C,Engel C,et al.NOA-04 randomized phaseⅢtrial of sequential radiochemotherapy of ana-plastic glioma with procarbazine,lomustine,and vincristine or temozolomide[J].J Clin Oncol,2009,27(35):5874-5880.
[14]Houillier C,Wang X,Kaloshi G,et al.IDH1 or IDH2 mutations predict longer survival and response to temozolomide in low-grade gliomas[J].Neurology,2010,75(17):1560-1566.
[15]赵心同,赵洪洋,姚东晓,等.脑胶质瘤治疗中自由基清除剂的价值[J].中华肿瘤防治杂志,2011,18(8):571-574.
[16]孙增峰,李文良,谷峰,等.胶质瘤耐药相关机制的研究进展[J].中华肿瘤防治杂志,2011,18(7):551-556.
[17]van den Bent M J,Hartmann C,Preusser M,et al.Interlaboratory comparison of IDH mutation detection[J].J Neurooncol,2013,112(2):173-178.
[18]Patel K P,Barkoh B A,Chen Z,et al.Diagnostic Testing for IDH1 and IDH2 variants in acute myeloid leukemia and algorithmic approach using high-resolution melting curve analysis[J].J Mol Diagn,2011,13(6):678-686.
[19]Tang J Y,Chang C C,Lin P C,et al.Isocitrate dehydrogenase mutation hot spots in acute lymphoblastic leukemia and oral cancer[J].Kaohsiung J Med Sci,2012,28(3):138-144.
[20]Blandine B,Yannick M.COLD PCR HRM:a highly sensitive detection method for IDH1 mutations[J].Hum Mutat,2010,31(12):1360-1365.
