不同生产厂家的0.9%氯化钠注射液对奥美拉唑钠配伍稳定性的影响
肖莹 徐彦贵 张弋 李淑娟
(天津市第一中心医院药学部,天津 300192)
不同生产厂家的0.9%氯化钠注射液对奥美拉唑钠配伍稳定性的影响
肖莹 徐彦贵 张弋 李淑娟
(天津市第一中心医院药学部,天津 300192)
目的:探讨不同生产厂家的0.9%氯化钠注射液对注射用奥美拉唑钠配伍稳定性的影响。方法:将注射用奥美拉唑钠与不同生产厂家的100 m L 0.9%氯化钠注射液配伍,分别在自然光、强光及紫外光下照射,同时在加入药品的0,2,4,6,8 h观察液体外观、pH值、含量以及不溶性微粒变化情况。结果:3种光照条件下,注射用奥美拉唑钠与不同生产厂家的0.9%氯化钠注射液配伍后均显澄明无色,不溶性微粒符合《中国药典》规定,pH值对其稳定性影响大,pH值越高稳定性越好,含量变化程度为紫外光>强光>自然光。结论:注射用奥美拉唑钠的配伍稳定性与输液的pH值有关。
注射用奥美拉唑钠;0.9%氯化钠注射液;配伍稳定性
奥美拉唑为质子泵抑制药,能选择性地抑制胃壁细胞的H+-K+-ATP酶,从而有效地抑制胃酸分泌。由于H+-K+-ATP酶是壁细胞泌酸的最后一个过程,故本品抑酸能力强大,目前临床上主要用于治疗胃、十二指肠溃疡,反流性食管炎及静脉注射治疗消化性溃疡急性出血。以往研究已发现奥美拉唑钠与100 m L 0.9%氯化钠注射液(NS)配伍稳定性高,但在临床应用中偶尔出现配伍后颜色变化的情况,为确保临床用药安全、有效,本文进一步探讨注射用奥美拉唑钠与不同生产厂家的0.9%NS配伍后在自然光、强光及紫外光照射条件下的稳定性,为临床合理用药提供依据。
1 仪器与试药
1.1 仪器
Agilent 1200高效液相色谱仪,包括四元泵(G1311A)、紫外检测器(G1314B)、柱温箱(G1316A)、标准自动进样器(G1329A)、标准真空脱气机(G1322A);PHB-1型酸度计(杭州奥立龙仪器有限公司);GWF-8JA微粒分析仪(天津天河医疗仪器有限公司)。
1.2 试药
0.9 %NS(规格:100 m L,生产厂家1批号:2H79A1,2H80A2,2E72A1;生产厂家2批号:C1111242A,C1204131A,C1111241A;生产厂家3批号:201208311,201209011,201209021),注射用奥美拉唑钠(规格:40 mg,上海第一生化药业有限公司,批号:1108061),标准比色液(规格:5 m L,上海食品药品检验所),异丙醇、甲醇、三乙胺均为色谱纯,磷酸为分析纯。
2 方法与结果
2.1 配伍方法及观察指标
模拟临床用药情况,所有配伍溶液浓度均为40 mg/100 m L,配伍环境温度为25℃。
2.1.1 溶液的配制用一次性注射器将10 m L 0.9% NS推入1瓶注射用奥美拉唑钠40 mg冻干粉针剂中,摇匀,待完全溶解后,将粉针剂中的药液全部注入剩余的100 m L 0.9%NS,摇匀,即得注射用奥美拉唑钠溶液。
2.1.2 配伍稳定性观察指标将3个不同厂家3种不同批号配好的溶液在自然光(正常室内环境),强光(光照强度为(4 500±500)lx)及紫外光(波长:200~400 nm,强度:90 μW/cm2,距离:1 m)下各放置1份,并即刻(0 h)及加药后不同时间(2,4,6,8 h)观察溶液外观色泽及澄明度,同时取样进行pH值、不溶性微粒和奥美拉唑的含量测定。含量变化以即刻点浓度为100%考察。凡符合以下情况之一者即判断为不能配伍[1]:出现变色、气泡、沉淀、浑浊等明显外观变化;混合后6 h内pH值变化明显(≥0.2);含量变化明显(≥10%);微粒变化超过药典[2]规定,即1 m L中含10 μm以上(≥10 μm)的微粒不得超过25粒,含25 μm以上的微粒不得超过3粒。
2.1.3 高效液相色谱法(HPLC)测定奥美拉唑含量[3]色谱柱为Agilent HC-C18柱(4.6×150 mm,5 μm),流动相为甲醇-水-三乙胺-磷酸(65∶35∶0.5∶0.15),检测波长302 nm,灵敏度0.000 1 AUFS,进样量10 μL,按外标法峰面积定量。注射用奥美拉唑钠浓度在0.01~0.1 mg/m L范围内,与峰面积线性关系良好,
S=24 453C-0.5216(r=0.999 9,n=6),
低、中、高3个不同浓度的回收率分别为(98.15± 1.25)%,(98.59±0.89)%,(1.00±1.78)%;日内差分别为1.33%,1.52%,1.32%,日间差分别为1.91%,1.40%,1.69%。
2.2 溶液外观及pH值变化
以标准比色液作为对照品,观察溶液的外观色泽及澄明度变化,测定输液在加药前及加药后各时间点的pH值。在整个实验过程中,各个光照条件下的溶液均保持澄明无色,pH值变化见表1~3,经SPSS16.0的t检验法对同一光照条件下各生产厂家之间8 h时的pH值进行统计得出1号与3号pH值有统计学意义(P<0.05)。
2.3 含量变化
注射用奥美拉唑钠与不同生产厂家的100 m L 0.9%NS配伍后,用HPLC测定溶液中奥美拉唑钠浓度,以配制后即刻(0 h)的含量为100%,计算其他时间的百分含量。含量变化结果见表1~3,3种光照条件下所有批号的100 m L 0.9%NS配制的注射用奥美拉唑钠含量随光照时间变化见图1(以光照时间为横坐标,奥美拉唑钠的含量变化为纵坐标)。使用SPSS16.0的t检验法对同一光照条件下各生产厂家之间8 h时含量进行统计,结果显示1号与3号含量有统计学意义(P<0.05)。
从表1~3可以看出,自然光下8 h配伍液中的含量保持在90%以上,部分pH值较低的0.9% NS含量下降接近10%;强光照射下6 h pH值较低组的奥美拉唑钠含量下降在10%左右,8 h下降达82.25%;紫外光下含量下降明显,4 h的含量即出现>10%,超出药典规定,说明药物分解较多,不稳定。从图1可见,试验时间8 h内各配伍液奥美拉唑钠含量逐渐减少,变化程度为紫外光>强光>自然光。
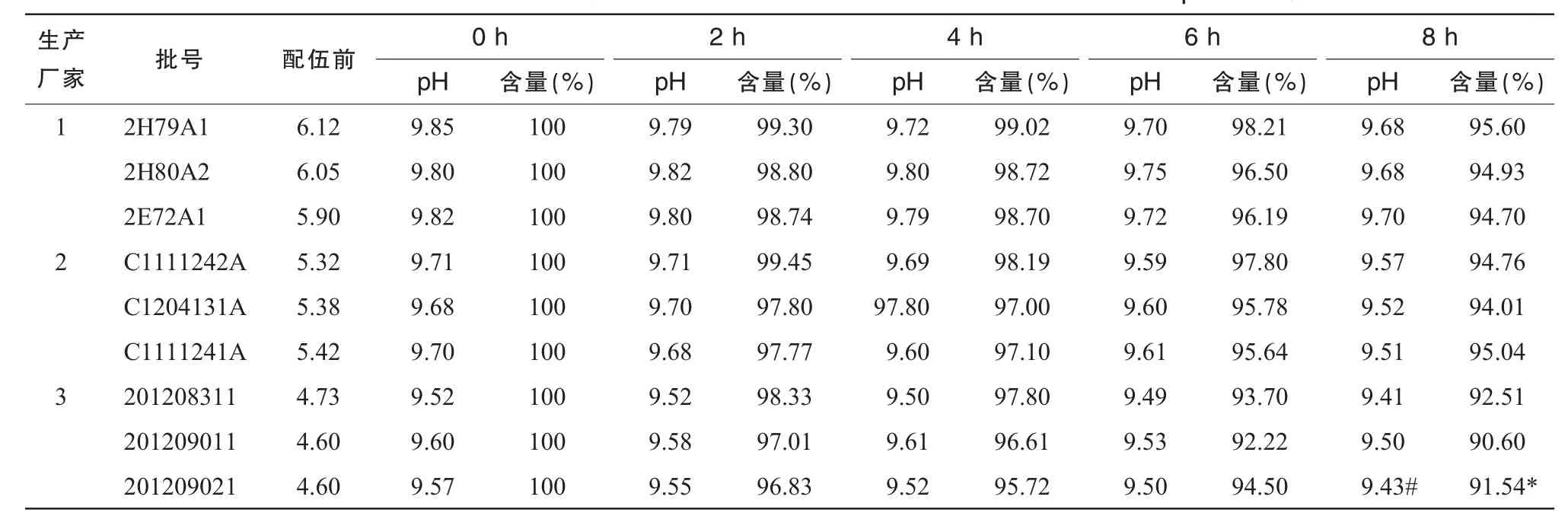
表1 25℃自然光照射下奥美拉唑钠与不同生产厂家的0.9%NS配伍的pH值及含量
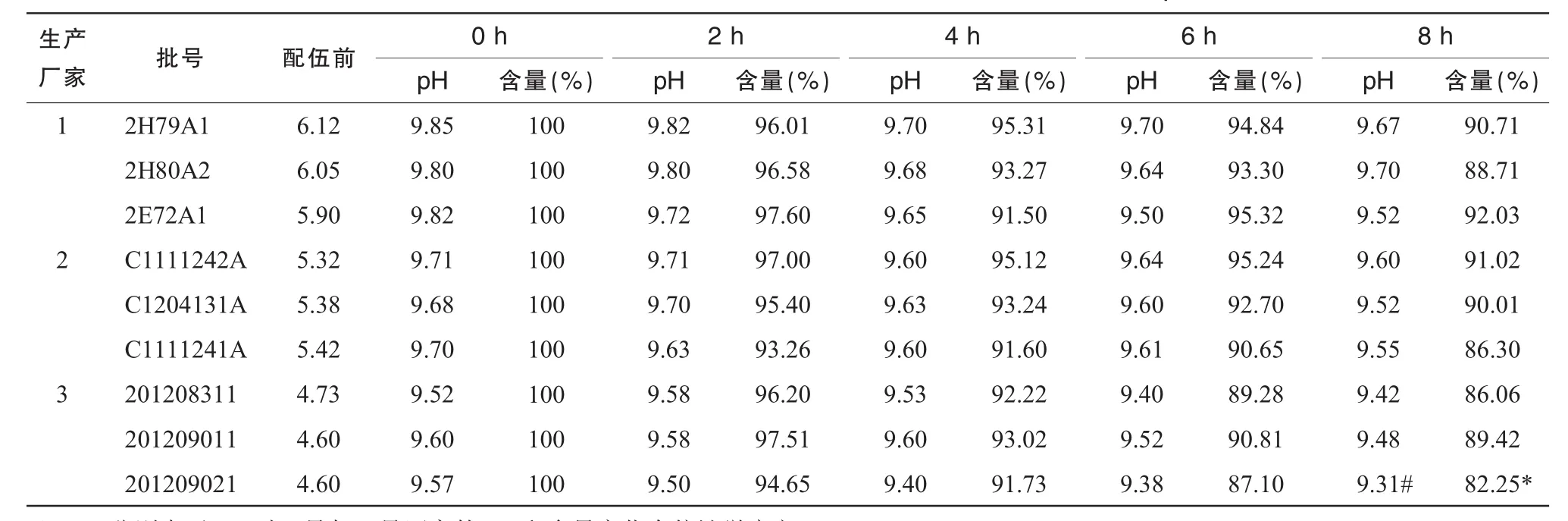
表2 25℃强光照射下奥美拉唑钠与不同生产厂家的0.9%NS配伍的pH值及含量
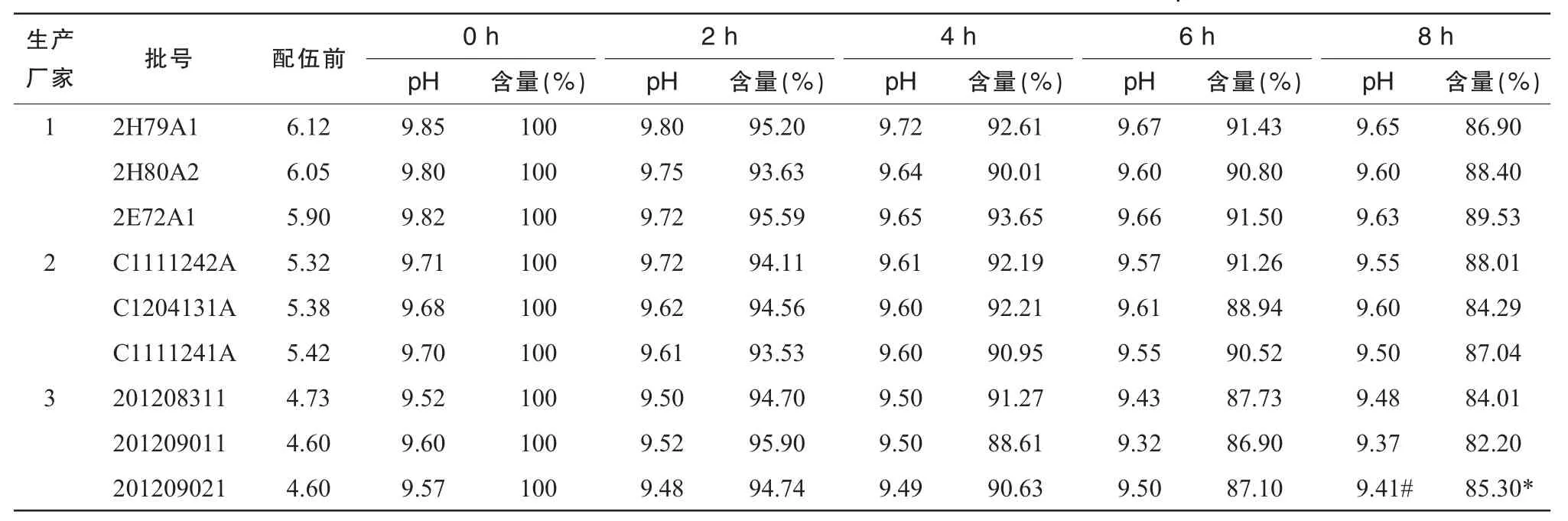
表3 25℃紫外光照射下奥美拉唑钠与不同生产厂家的0.9%NS配伍的pH值及含量
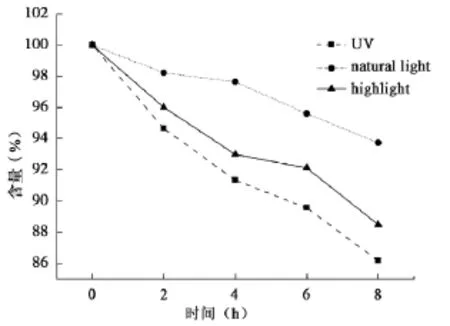
图1 自然光、强光、紫外光照射下奥美拉唑钠含量变化
2.4 不溶性微粒变化
在室温25℃条件下用智能微粒检测仪测定各空白输液的微粒,并于配伍后即刻(0 h)及8 h测定注射用奥美拉唑钠与输液配伍后的不溶性微粒(≥10 μm和≥25 μm),按照《中国药典》中不溶性微粒数的测定方法,每份溶液平行测定4次,第1次数据不计,取后3次测定结果的平均值。结果显示,配伍后不溶性微粒均符合《中国药典》规定,使用SPSS 16.0统计软件的t检验比较同一光照条件下不同厂家所有批号的溶液在0 h和8 h微粒变化,显示无统计学意义(P>0.05)。结果见表4。
3 讨论
奥美拉唑钠的结构属苯并咪唑类,具有亚磺酰基,是弱碱性化合物,在酸性溶液中不稳定、分解快,分解产物为其砜化物和硫醚化物[4]。25℃下其与100 m L 0.9%NS配伍后,在自然光、强光、紫外光照射下,8 h内所有溶液始终保持澄明无色。本研究选取了3个不同厂家不同批号的100 m L 0.9%NS作为配伍液,pH值范围为4.60~6.12,配伍后8 h内溶液pH值在9.0~10.0范围内波动,随时间变化逐渐降低。同一光照条件下,1号与3号厂家8 h时的pH值和含量经统计有统计学意义(P<0.05),说明注射用奥美拉唑钠的稳定性与输液的pH值密切相关,配伍液的pH值越高,稳定性越好,临床应用时尽量选择pH值较高的输液配伍。自然光下pH值波动范围较小,表明自然光下稳定性最好。
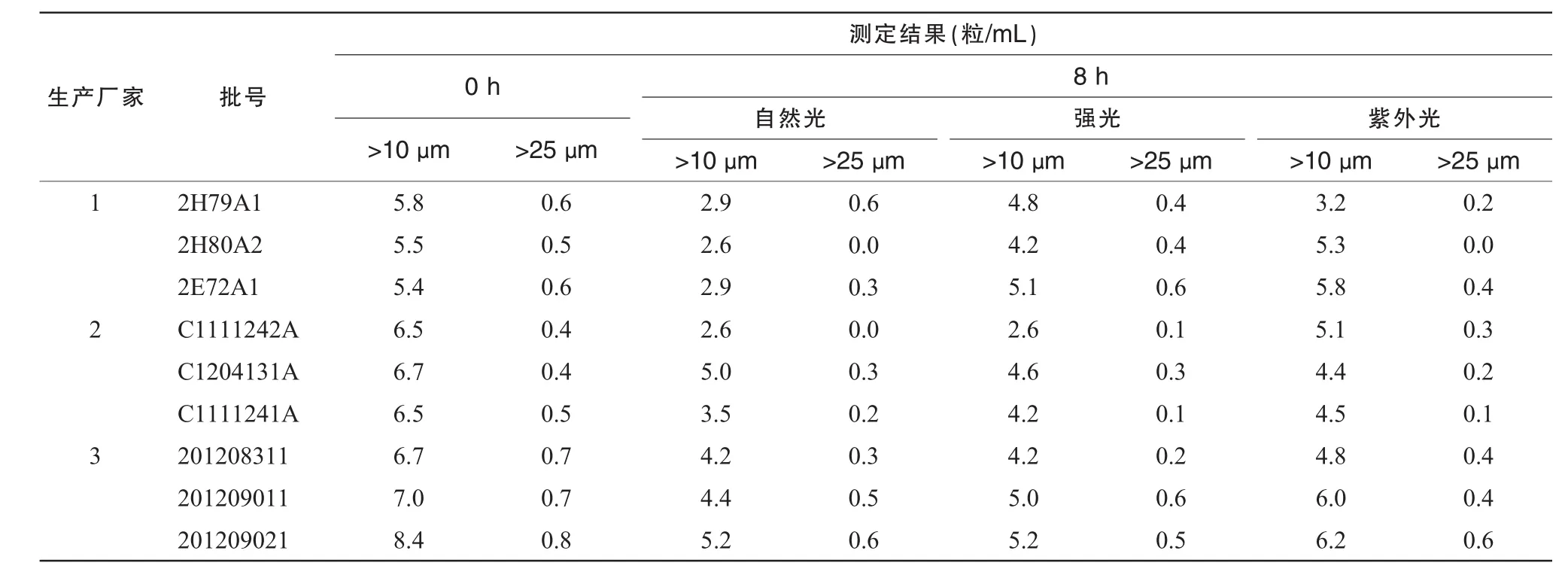
表4 25℃不同光照条件下奥美拉唑钠与不同生产厂家的0.9%NS配伍后不溶性微粒测定结果
不同光照条件下,各配伍液奥美拉唑钠含量逐渐减少,其中自然光下配伍后溶液含量下降相对缓慢,8 h接近10%,紫外光下含量下降明显,变化程度为紫外光>强光>自然光。说明输液应现用现配,配好的溶液应保存在自然光下,不宜长期暴露于强光及紫外光下,以保证临床用药的安全性。
[1]李顺炜,袁孔现,李国忠,等.盐酸氨溴索注射液与16种常用药物配伍稳定性考察[J].安徽医药,2008,12(5):400-402.
[2]国家药典委员会.中华人民共和国药典(2010年版)二部[S].北京:中国医药科技出版社,2010.
[3]肖卫红,何伟,卢全德.高效液相色谱法测定注射用奥美拉唑钠的含量[J].中国医院药学杂志,2006,26(6):771-772.
[4]李珍,胡晋红,金桂兰.注射用奥美拉唑注射液的配伍稳定性[J].华西药学杂志,1999,14(5-6):409-410.
The Impact on Com patible Stability of Omeprazole Sodium by 0.9%Sodium Chloride Injection Produced by Different Manufacturers
Xiao Ying,Xu Yangui,Zhang Yi,Li Shujuan(Pharmacy Department of the First Central Hospital of Tianjin,Tianjin 300192,China)
Objective:To study the impact on the compatible stability of omeprazole sodium for injection by 0.9% sodium chloride injection produced by different manufacturers.Methods:Omeprazole sodium for injection was added into 100 m l of 0.9%sodium chloride injection produced by different manufacturers and the m ixture was exposed under natural light,hard light and UV respectively.The changes of appearance,pH,content and insoluble particles were observed at 0,2,4,6,8 h after the addition.Results:Under three kinds of illum ination conditions,the m ixture of omeprazole sodium for injection and 0.9%sodium chloride injection produced by different manufacturers was all clear and colorless.The insoluble particles met with the requirements set forth in the Chinese Pharmacopoeia.PH showed much impact on the stability,the higher pH the better the stability was.The degree of content changes under three illum inations was UV>hard light>natural light.Conclusion:The compatible stability of omeprazole sodium for injection is related to the pH of infusion.
Omeprazole Sodium for Injection;0.9%Sodium Chloride Injection;Compatible Stability
10.3969/j.issn.1672-5433.2014.09.006
2014-07-12)
肖莹,女。研究方向:临床药学。
徐彦贵,女,主任药师。研究方向:临床药学。通讯作者E-mail:13920455619@139.com

