实验用金黄色葡萄球菌生物被膜体外模型的建立
张全凯,杨公明*,余 铭,杜 冰,吕小丽
(1.华南农业大学食品学院,广东 广州 510642;2.阳江职业技术学院 生命科学与技术系,广东 阳江 529500)
生物被膜(biofilm,BF)是细菌为适应自然环境在固态表面生长时所采取的一种保护性的群体生活方式。细菌生物被膜广泛存在于自然界中,其中金黄色葡萄球菌是较易形成生物被膜的菌种之一,也是食品加工过程中的重要污染源[1]。金黄色葡萄球菌(Staphylococcus aureus)是一种广泛存在于自然界的革兰氏阳性病原菌。在美国,金黄色葡萄球菌是第二大食源性病原菌,由金黄色葡萄球菌引起的食物中毒数量占细菌性食物中毒的33%[2]。目前,在食品加工中发现金黄色葡萄球菌生物被膜存在[3]。生物被膜是自然条件下细菌为适应环境而形成的与浮游状态细菌相对应的一种保护型生长方式,细菌将细胞不可逆的嵌入一个自我分泌的胞外聚合物基质中,该基质由多糖、蛋白质、核酸和芳香族氨基酸组成。生物被膜菌具有不同于浮游菌生长率和基因表达的表型,导致生物被膜表面化学性质的变化,因此BF菌对各种化学杀菌剂的敏感程度只有浮游菌的1/10~1/1 000,其耐热性也相应增加,对环境变化不敏感,感染部位难以彻底清除[4-7]。生物被膜的良好适应性可能导致毒力增强,在食品加工过程中增加了交叉污染的可能性,导致食品污染的风险增加[8-9]。通过优化金黄色生物被膜体外模型,探讨各种因素对金黄色葡萄球菌生物被膜形成的影响,了解该菌生物被膜形成规律,为研究金黄色葡萄球菌生物被膜的防治措施提供实验材料和理论依据。
1 材料与方法
1.1 材料与试剂
金黄色葡萄球菌(Staphylococcus aureus ATCC 6538):广东省微生物研究所;胰蛋白胨大豆肉汤(trypticase soy broth,TSB)培养基、胰蛋白胨大豆琼脂(tryptose soya agar,TSA)培养基:广东环凯微生物科技有限公司。
氢氧化钠(分析纯):东莞市东旺化玻仪器有限公司;结晶紫(分析纯):广州精科化玻仪器公司;琼脂、胰蛋白胨、大豆蛋白胨:上海中科昆虫生物技术开发有限公司。
1.2 仪器与设备
96孔酶标板:上海康宁公司;Bio-Rad 680酶标仪:美国Bio-Rad公司;SB32000超声仪:上海第三分析仪器厂;PYX-250S-A型生化培养箱:上海悦丰仪器仪表有限公司;SHZ-82A全温震荡培养箱(卧式):常州朗越仪器制造有限公司。
1.3 实验方法
1.3.1 菌种活化与菌悬液制备
将冻干保存的金黄色葡萄球菌接种于TSA培养基上,37℃过夜培养,取培养基上直径>1mm的菌落一环于无菌TSB培养基中,37℃条件下振荡培养至对数生长期。将复苏24h的菌种接种于TSB培养基中,37℃条件下培养24h,置于超声仪上重新使菌团分散均匀,参照麦氏比浊法,用pH值为7.3无菌磷酸盐缓冲液(phosphate buffer saline,PBS)调整菌悬液细菌密度约为108CFU/mL。
1.3.2 生物被膜形成与测定
接入一定量菌悬液于96孔板中,加入TSB培养基,盖上盖子,在37℃条件下恒温恒湿培养。培养一定时间后弃去96孔板中的培养物,用250μL无菌磷酸盐缓冲液(pH 7.3)冲洗3次,去除培养基和浮游状态的细菌。在孔中加入甲醇250μL加盖静置15min,吸除甲醇后在30℃环境下自然风干,固定吸附紧密的细菌。在每个孔中加入250μL结晶紫(1%结晶紫溶液),静置染色20min后弃去染色液,无菌磷酸盐缓冲液(pH 7.3)冲洗直至无色、晾干。在染色的孔中加入250μL、体积分数为95%的乙醇脱色,用空白孔以250μL TSB培养基作为空白调零,测定595nm波长处光密度值OD595nm,每孔做3个平行,取其平均值[10-13]。
1.3.3 金黄色葡萄球菌生物被膜活菌量的测定
取出培养一定时间的96孔板,用无菌磷酸缓冲溶液(pH 7.3)漂洗3次,在无菌状态下用无菌棉球擦拭培养孔数次,将棉球转入装有10mL PBS溶液的试管中,把试管放入超声仪中,在50Hz频率下超声15min,使棉球上的菌团分散于无菌水中。用无菌磷酸缓冲溶液(pH 7.3)进行梯度稀释后,在TSA平板上37℃培养24h后计数,结果以lg(CFU/mL)表示。
1.3.4 金黄色葡萄球菌生物被膜体外模型实验
(1)金黄色葡萄球菌生物被膜制备单因素实验
分别选择细菌接种浓度(105CFU/mL、106CFU/mL、107CFU/mL、108CFU/mL、109CFU/mL、1010CFU/mL)、培养基pH(4、5、6、7、8、9、10)、培养基质量分数(1%、2%、3%、4%、5%、6%、7%)、培养温度(20℃、25℃、30℃、35℃、40℃、45℃),培养时间(12h、24h、36h、48h、60h、72h、84h)5个因素来研究其对金黄色葡萄球菌成膜的影响,通过结晶紫染色法测定光密度值OD595nm,平行试验3次。
(2)二次回归正交旋转组合设计
综合考虑单因素实验结果,确定在细菌接种浓度109CFU/mL、培养基质量分数6%的条件下,选择培养温度(A)、培养时间(B)和培养基pH(C)建立关于生物被膜活菌数的三元二次回归模型,并寻求最优相应因子水平。二次正交旋转试验设计因素水平编码如表1所示。
1.3.5 金黄色葡萄球菌生物被膜吸光度与活菌数标准曲线
取两组不同培养条件培养出的金黄色葡萄球菌生物被膜96孔板,一组用结晶紫染色法测定96孔板的OD值,另一组用实验方法1.3.3测定金黄色葡萄球菌生物被膜活菌量,建立OD值和活菌量之间的线性关系。
2 结果与分析
2.1 金黄色葡萄球菌生物被膜制备单因素实验
2.1.1 细菌接种浓度对金黄色葡萄球菌生物被膜OD值的影响
在培养基pH值为7,培养基质量分数3%,培养温度37℃,培养时间48h条件下,不同细菌接种浓度对金黄色葡萄球菌生物被膜所测OD值的影响如图1所示。由图1可知,随着细菌接种浓度的增加,生物被膜OD值呈上升趋势,当细菌接种浓度由105CFU/mL增长到107CFU/mL时,生物被膜OD值显著增加;当初始菌悬液浓度由107CFU/mL增长到109CFU/mL时,生物被膜OD值缓慢增加;继续增加到1010CFU/mL对生物被膜OD值影响不大。当细菌接种浓度为109CFU/mL时,用酶标仪测得的OD值为2.586。说明初始菌悬液浓度增长有利于生物被膜的形成,但增长到一定程度后对生物被膜的生长影响不大。根据实验结果以及方便调整菌悬液浓度的原则,确定菌悬液浓度为109CFU/mL。
2.1.2 培养基pH对金黄色葡萄球菌生物被膜OD值的影响
在细菌接种浓度109CFU/mL,培养基质量分数3%,培养温度37℃,培养时间48h条件下,不同培养基pH值对金黄色葡萄球菌生物被膜所测OD值的影响如图2所示。由图2可知,培养基pH值为7,生物被膜的OD值最大,与其他培养基pH下形成的生物被膜的量有极显著差异(P<0.01)。说明培养基pH值为7左右最适宜生物被膜的生长。根据实验结果确定优化的培养基pH值为6~8。

表1 二次正交旋转试验设计因素水平编码Table 1 Factors and levels of quadratic orthogonal rotary experiment

图1 细菌接种浓度对金黄色葡萄球菌生物被膜OD值的影响Fig.1 Effect of suspension concentration on OD value of S.aureus biofilm
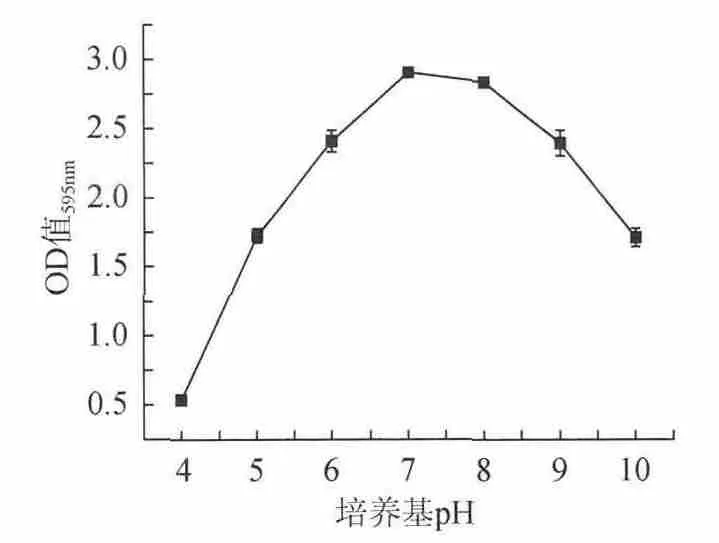
图2 培养基pH对生物被膜OD值的影响Fig.2 Effect of culture medium pH on OD value of S.aureus biofilm
2.1.3 培养基质量分数对金黄色葡萄球菌生物被膜OD值的影响
在细菌接种浓度109CFU/mL,培养基pH值为7,培养温度37℃,培养时间48h条件下,不同培养基质量分数对金黄色葡萄球菌生物被膜所测OD值的影响结果见图3。由图3可知,培养基质量分数由1%增长到5%时生物被膜OD值逐渐变大,培养基质量分数由5%增长到7%时生物被膜OD值变化不大。培养基质量分数为6%时培养出的生物被膜所测OD值为3.037。说明培养基质量分数增长的有利于生物被膜的形成,但增长到一定程度后生物被膜的生长进入稳定期。由此确定培养基质量分数为6%进行三元二次回归正交旋转试验。

图3 培养基质量分数对生物被膜OD值的影响Fig.3 Effect of medium concentration on OD value of S.aureus biofilm
2.1.4 培养温度对金黄色葡萄球菌生物被膜OD值的影响
在细菌接种浓度109CFU/mL,培养基pH 值为7,培养基质量分数6%,培养时间48h条件下,不同培养温度对金黄色葡萄球菌生物被膜所测OD值的影响结果见图4。由图4可知,培养温度为35~40℃之间,生物被膜所测的OD值最大,而在培养温度>40℃或<35℃时形成的生物被膜受到抑制,且高温条件对生物被膜生长抑制更为显著。由此说明培养温度为35~40℃最适宜生物被膜的生长,温度过低或者过高生物被膜都将被抑制。因此确定优化的培养温度为35~40℃,进行三元二次回归正交旋转试验。

图4 培养温度对生物被膜OD值的影响Fig.4 Effect of culture temperature on OD value of S.aureus biofilm
2.1.5 培养时间对金黄色葡萄球菌生物被膜OD值的影响
在细菌接种浓度109CFU/mL,培养基pH值为7,培养基质量分数6%,培养温度37℃条件下,不同培养时间对金黄色葡萄球菌生物被膜所测OD值的影响结果见图5。由图5可知,培养时间由12h增长到36h时,生物被膜OD值显著增加。培养时间36~60h时,生物被膜OD值缓慢增长。培养时间60~84h时,生物被膜OD值与培养时间呈负相关。原因可能是随着培养时间的延长大量消耗底物,当底物供应不足时,为适应不利环境,孔壁的生物被膜态菌会脱落、死亡或休眠一部分。根据试验结果,确定优化的培养时间为48~72h进行三元二次回归正交旋转试验。
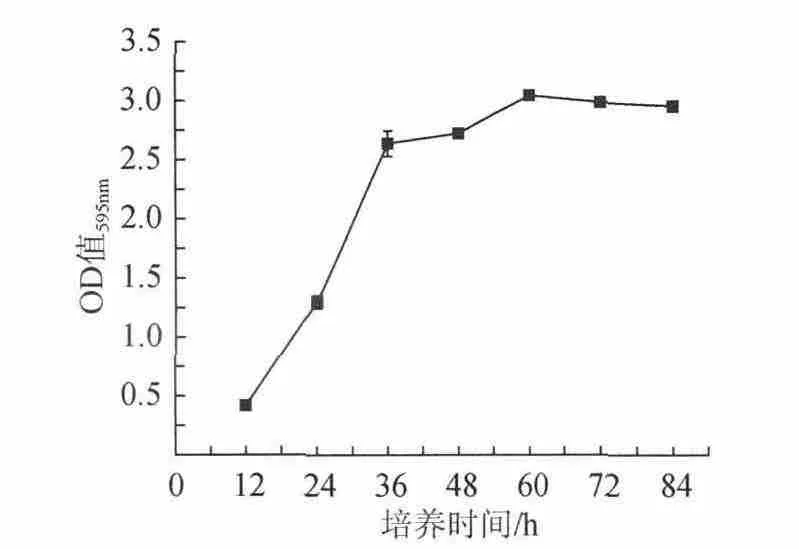
图5 培养时间对生物被膜OD值的影响Fig.5 Effect of culture time on OD of S.aureus biofilm
2.2 金黄色葡萄球菌生物被膜制备优化
二次正交旋转试验方案及结果如表2所示。采用Design Expert 8.0软件,通过其对其回归过程进行数据分析,寻求最优相应因子水平,并建立多元回归模型。

表2 二次正交旋转试验方案及结果Table 2 Design and results of quadratic orthogonal rotating test

表3 回归模型方差分析Table 3 Variance analysis of regression model
由表3可知,模型显著性检验P<0.05,表明该模型具有统计学意义。由图4知其自变量一次项A、B、C和二次项AB、AC、BC、A2、B2、C2显著(P<0.05)。校正决定系数R2adj(0.987 0>0.80)和变异系数(cofficient of variation,CV)为0.54%,说明该模型只有0.54%的变异能由该模型解释。利用Design-Expert 8.5 软件对试验结果进行统计分析,得到OD值与各因素之间的回归方程如下:

通过对各个变量求偏导,得出各参数的最优值为:A=37.49,B=64.9,C=7.3,此时的理论优化值为3.113 8。在此条件下进行验证试验,OD值为3.108,与测定值相差0.186%,说明结果真实可靠。
2.3 响应面立体图及分析
由图6可知,当培养时间为一定值时,生物被膜OD值随着培养温度的增加呈先上升后下降的趋势。当培养温度在较低水平时,培养时间对生物被膜OD值影响不大。当培养温度为37℃时,培养时间从48~72h,生物被膜OD值先显著增加,当达到最佳水平后,培养时间继续增大时,生物被膜OD值渐渐下降。

图6 培养温度及培养时间对OD值影响的响应面图及等高线Fig.6 Response surface plot and contour line of interaction between culture temperature and culture time on OD value
由图7可知,当培养基pH为一定值时,生物被膜OD值随着培养温度的增加呈先上升后下降的趋势。当培养温度在较低水平时,培养基pH对生物被膜OD值影响不大。当培养温度为37℃时,培养基pH6.0~8.0,生物被膜OD值先呈显著增加趋势,当达到最佳水平后,培养时间继续增大时,生物被膜OD值逐渐下降。
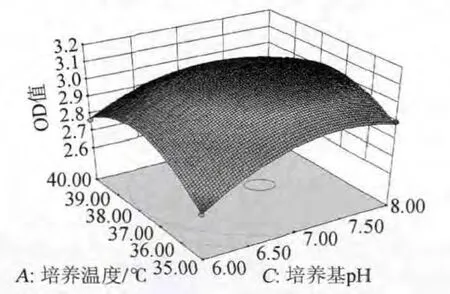
图7 培养温度及培养基pH对OD值影响的响应面图及等高线Fig.7 Response surface plot and contour line of interaction between culture temperature and medium pH on OD value
由图8可知,当培养基pH在较低水平时,培养时间对生物被膜OD值影响不大。当培养基pH在7.0~7.5左右时,生物被膜OD值随着培养时间的增加呈先显著上升,到达最佳水平后缓慢下降的趋势。当培养时间在66h左右时,生物被膜OD值随着培养基pH的增加呈先显著上升,到达最佳水平后缓慢下降的趋势。

图8 培养时间及培养基pH对OD值影响的响应面图及等高线Fig.8 Response surface plot and contour line of interaction between culture time and medium pH on OD value
2.4 金黄色葡萄球菌生物被膜吸光度与活菌数标准曲线测定
如图9所示,实验测定的金黄色葡萄球菌生物被膜OD值(X)与活菌数(Y)间关系为Y=2.115X+0.0474,R2=0.996 2。结果表明,金黄色葡萄球菌生物被膜OD值(X)与活菌数(Y)呈线性相关。

图9 生物被膜OD值与活菌数标准曲线Fig.9 Standard curve of biofilm OD value and living bacterium number
3 结论
实验表明,细菌接种浓度与金黄色葡萄球菌生物被膜的生长有关,细菌接种浓度大于107CFU/mL时更容易生成生物被膜。根据陈强等[14]研究,细菌粘附量与生物被膜的生长呈正比,初细菌接种浓度越高越有利于细菌的粘附;培养基的浓度越高越有利于生物被膜的形成,但培养基浓度达到一定浓度后生物被膜生长趋于稳定;培养基pH值在7.3左右时生物被膜最有利于生物被膜的生长,而pH值为7.4也是浮游态金黄色葡萄球菌的最适生长环境,这个结论与段韵涵等[15]的研究相符合;金黄色葡萄球菌在培养36h时既能形成较稳定的生物被膜,随着培养时间的增加生物被膜生长量先升后降,可能是因为随着培养时间的增加,营养物质被消耗,在不利环境中,生物被膜态菌会脱落、死亡一部分;培养温度在37.5℃时,最利于生物被膜生长。根据优化实验得出当温度为37.49℃,培养时间为64.9h,培养基pH值为7.3时生物被膜生长最佳,此时的理论优化值为3.113 8。该模型变异系数(CV)为0.54%,进一步说明模型拟合度较好,可用来对生物被膜生长情况进行初步分析和预测。通过建立金黄色葡萄球菌生物被膜吸光度值与活菌数标准曲线,改良微孔板法可以定量分析生物被膜的活菌数,实验拟合度较高。
[1]孙纪录,韩小雪,韩北忠.金黄色葡萄球菌生物被膜的控制方法研究进展[J].中国酿造,2011,30(6):1-3.
[2]丁 岚,侯晓彦,王小红,等.张永霞乳糖诱导葡萄球菌肠毒素A 基因在大肠杆菌中的表达[J].食品与生物技术学报,2011,30(2):255-260.
[3]SHARMA M,ANAND S K.Characterization of constitutive microflora of biofilms in dairy processing lines[J].Food Microbiol,2002,19(9):627-636.
[4]COSTERTON J W.Introduction to biofilm[J].Int J Antimicrob Agents,1999,11(3-4):217-221.
[5]SIBONI N,LIDOR M,KRAMARSKY-WINTER E,et al.Conditioning film and initial biofilm formation on ceramics tiles in the marine environment[J].FEMS Microbiol Lett,2007,274(1):24-29.
[6]DONLAN R M,COSTERTON J W.Biofilms:survival mechanisms of clinically relevant microorganisms[J].Clin Microbiol Rev,2002,15(2):167-193.
[7]LELIÉVRE C,LEGEGENTILHOMME P,GAUCHER C,et al.Cleaning in place:effect of local wall shear stress variation on bacterial removal from stainless steel equipment[J].Chem Eng Sci,2002,57 (8):1287-1297.
[8]李燕杰,杜 冰,董吉林,等.食品中细菌生物被膜及其形成机制的研究进展[J].现代食品科技,2009,25(4):435-438.
[9]WIRTAAEN G,SALO S.Disinfection in food processing efficacy testing of disinfectants[J].Rev Environ Sci Biotechnol,2003,2(2-4):293-306.
[10]钱群英.嗜水气单胞菌生物被膜形成和估算方法[D].南京:南京农业大学硕士论文,2006.
[11]O'TOOLE G A,KOLTER R.Flagellar and twitching motility are necessary for Pseudomonas aeruginosa biofilm development[J].Mol Microbiol,1998,30(2):295-304.
[12]HEILMANN C,GERKE C,PERDREAU-REMINGTON F,et al.Characterization of Tn917 insertion mutants of Staphylococcus epidermidis affected in biofilm formation[J].Infect Immun,1996,64(1):277-282.
[13]STEPANOVIC S,VUKOVIC D,DAKIC I,et al.A modified microtiter-plate test for quantification of staphylococcal biofilm formation[J].J Microbiol Meth,2000,40(2):175-179.
[14]陈 强,鄢庆枇,邹文政,等.环境因子对溶藻弧菌粘附大黄鱼表皮粘液影响的研究[J].海洋与湖沼,2007,38(4):361-366.
[15]段韵涵,韩北忠,杨葆华,等.培养条件对金黄色葡萄球菌生物被膜生长的影响[J].中国酿造,2008,27(3):17-20.

