内蒙古牧区乳酸球菌的分离鉴定及耐药表型分析
宋晓敏,李少英 *,马春艳,李 贞,李淑芬
(1.内蒙古农业大学 食品科学与工程学院,内蒙古 呼和浩特 010018;2.内蒙古农业大学 生命科学学院,内蒙古 呼和浩特 010018)
乳酸菌是一类发酵产物主要为乳酸的革兰氏阳性细菌的总称,具有增强免疫、防止胃黏膜病变、减轻过敏症状、预防肠道病原菌感染等保健功能[1],因此在食品工业上应用广泛。但目前工业上常用于发酵乳制品的乳酸球菌只有嗜热链球菌、乳酸乳球菌等少数菌株[2],急需更多的菌种来丰富发酵产品的种类。研究乳酸菌的生物多样性可为工业生产提供更多样、更优质的菌株选择。内蒙古民族乳制品有着品种多、样式广、风味独特等特点[3],而其中的乳酸菌更因菌种的多样性受到专家学者的关注。由于内蒙古民族乳制品的发酵是在自然状态下进行的,使得其中乳酸菌的生物学特性和基因多样性得到了很好的保留,微生物的区系组成更是牧区微生态环境的直接体现。
氟喹诺酮类药物在临床上广泛应用于治疗肠道感染,是肠道菌群最常接触到的抗生素之一[4]。而乳酸菌对氟喹诺酮类药物的自然耐药性可增强乳酸菌在肠道内的定植能力,使其免受到抗生素的干扰,为有益乳酸菌微生态制剂与氟喹诺酮类抗菌药制剂同时使用来维持肠道正常菌群、治疗肠道感染提供可能。
本实验对内蒙古牧区民族乳制品中的乳酸球菌进行分离纯化并分析菌株对氟喹诺酮类药物的耐药表型。筛选出对氟喹诺酮类药物有抗性的菌株进行生理生化鉴定和16S rRNA序列同源性分析,旨在为今后乳酸菌进一步应用于工业化生产提供优良菌种,丰富发酵乳制品的种类;并为乳酸菌安全性研究提供实验数据,为乳酸菌的安全应用提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
取自四子王旗(Siziwang Banner,SB)和达尔罕茂明安联合旗(Darhan Muminggan,DM)牧区的自然发酵乳制品,包括酸奶和稀奶油。
1.1.2 培养基
胆盐乳糖培养基(bile lactose,BL)培养基:1L培养基中含肝浸粉4.0g、蛋白胨5.0g、牛肉浸粉3.0g、酵母浸粉2.0g、胰酪蛋白胨5.0g、可溶性淀粉0.5g、L-半胱氨酸0.5g、葡萄糖10g、磷酸二氢钾1.0g、磷酸氢二钾1.0g、大豆胨3.0g、硫酸镁0.2g、硫酸亚铁0.01g、氯化钠0.01g、琼脂15.0g、硫酸锰0.006 7g、吐温-80 1.0mL。
TPY培养基:1L培养基中含胰蛋白胨8.0g、大豆蛋白胨3.0g、酵母粉5.0g、葡萄糖20.0g、L-半胱氨酸0.5g、磷酸氢二钾2.0g、磷酸二氢钾3.0g、六水合氯化镁0.5g、氯化钠5.0g、七水合硫酸亚铁0.01g、吐温80 1.0mL。
MRS培养基:1L培养基中含牛肉膏10.0g、蛋白胨10.0g、磷酸氢二钾2.0g、酵母浸膏5.0g、三水合醋酸钠5.0g、柠檬酸二铵2.0g、吐温-80 1mL、盐液A(七水合硫酸镁11.5g、四水合硫酸锰2.8g、蒸馏水1 000mL)5mL、葡萄糖20.0g。
双料MRS培养基:1L培养基中含牛肉膏20.0g、蛋白胨20.0g、磷酸氢二钾4.0g、酵母提取物10.0g、三水合醋酸钠10.0g、柠檬酸二铵4.0g、吐温-80 2mL、盐液A 10mL(七水合硫酸镁11.5g、四水合硫酸锰2.8g、蒸馏水1 000mL)、葡萄糖40.0g。
葡萄糖酵母膏蛋白胨(glucose yeast extract peotone,GYP)培养基:1L培养基中含葡萄糖20.0g、酵母提取物10.0g、蛋白胨10.0g、三水合醋酸钠5.0g、吐温-80 10mL、盐液(七水合硫酸镁40.0g、四水合硫酸锰2.0g、七水合硫酸亚铁2.0g、氯化钠2.0g、蒸馏水1 000mL)5mL。
1.1.3 抗生素标准品
实验所用抗生素标准品具体情况见表1。

表1 抗生素标准品的名称、生产批号及来源Table 1 Name,batch number and source of antibiotic standards
1.1.4 菌株
质控菌株为大肠埃希菌(Escherichia coli)ATCC 25922:美国典型培养物保藏中心。
标准菌株为粪肠球菌(Enterococcus faecalis)CICC 23658:中国工业微生物菌种保藏中心。
1.1.5 试剂
新型微量生化管:广东环凯微生物科技有限公司;细菌DNA基因组提取试剂盒:天根生化科技有限公司;2×EasyTaqSuper Mix:TRANS;DL2000 DNA Marker、6×Loading buffer、核酸染料:宝生物工程(大连)有限公司;琼脂糖:美国Sigma公司。
1.1.6 16s rRNA扩增引物
F:agagtttgatcctggctcag,R:aaggaggtgatccagcc,目的产物大小约为1 500bp。参照文献[6]所提供的引物。
1.2 仪器与设备
350mL厌氧培养袋:青岛海博生物技术有限公司;SPX-1500型恒温恒湿培养箱:上海博讯实业有限公司;OLYMPOSBX50型光学显微镜:日本OLYMPOS公司;FLC-3型超净工作台:哈尔滨市东联公司;快速梯度PCR仪:美国ABI公司;DYCP-31DN型电泳仪:北京市六一仪器厂;图像记录分析仪:普洛麦格(北京)生物技术有限公司。
1.3 方法
1.3.1 样品中乳酸球菌的分离纯化及保存
用划线法对样品中的乳酸球菌进行分离及纯化。对分离纯化得到的菌株进行真空冷冻干燥保存,方法参照文献[7]。
1.3.2 分离菌株的初步鉴定
对分离菌株进行初步鉴定以确定其为乳酸球菌,鉴定内容包括革兰氏染色并镜检、过氧化氢酶试验和脱脂乳发酵试验。
1.3.3 试验菌株对氟喹诺酮类药物的耐药性测定
用二倍稀释法测定最小抑菌浓度(minimum inhibitory concentration,MIC)。将3种氟喹诺酮类药物的抗生素标准品按照美国临床和实验室标准协会(clinical and laboratory standards institute,CLSI)的耐药标准进行溶解,制备成高浓度的抗生素贮存液,-20℃保存。按照二倍稀释法将抗生素贮存液进行稀释,设定药物质量浓度为800μg/mL、400μg/mL、200μg/mL、100μg/mL、50μg/mL、25μg/mL、12.5μg/mL、6.25μg/mL、3.13μg/mL、1.56μg/mL。
在无菌条件下将试验菌株接种于MRS液体培养基中,传代培养3代,并用空培养基稀释3代菌液至活菌数为107CFU/mL。按6%的接菌量接种于双料MRS液体培养基中混匀,并加入到等体积稀释好的药物中。设置培养基空白、菌空白、药物空白作为对照。37℃培养24h,用目视比浊法观察并记录最小抑菌浓度(MIC)。参照CLSI药敏判断标准中肠球菌属MIC解释标准对结果进行判读[8],做3次重复试验,解释判读标准见表2。

表2 肠球菌属MIC解释标准Table 2 MIC interpretation standards of Enterococcus
1.3.4 试验菌株的生理生化鉴定
试验菌株活化培养3代,按照文献[9]的方法进行葡萄糖产气试验、温度生长试验、pH生长试验、耐盐试验、精氨酸产气试验、发酵蔗糖产葡聚糖试验、糖发酵试验。
1.3.5 试验菌株的16S rRNA序列扩增及分析
将活化培养的第3代菌液,用细菌基因组DNA提取试剂盒进行基因组DNA的提取。对试验菌株的16S rRNA序列进行扩增,聚合酶链反应(polymerase chain reaction,PCR)扩增体系为50μL,其中2×EasyTaqSuper Mix 25μL、上下游引物各2μL、模板DNA 2μL、剩余无菌水补足。PCR循环参数为94℃预变性3min,94℃变性30s,57.4℃退火30s,72℃延伸90s,72℃末端延伸5min,35个循环。PCR扩增产物用1%琼脂糖凝胶电泳检测。将PCR产物测序,所得序列拼接后用美国国家生物技术信息中心(national center of biotechnology information,NCBI)上的基本局部比对搜索工具(basic local alignment search tool,BLAST)对其同源性进行分析,并用DNAstar软件绘制系统发育树。
2 结果与分析
2.1 分离菌株初步鉴定
初步鉴定结果显示,试验菌株均为革兰氏阳性球菌,且过氧化氢酶阴性,发酵脱脂乳阳性,可初步判定为乳酸菌。
2.2 试验菌株的耐药表型
2.2.1 试验菌株MIC测定结果
试验菌株的MIC测定结果如表3所示,MIC1、MIC2、MIC3分别为3次重复试验的测定结果。
由表3可知,对3种氟喹诺酮类药物显示耐药的试验菌株的MIC大部分超出了试验可测定的最大值400 μg/mL,试验菌株呈现高度耐药。

表3 试验菌株MIC测定结果Table.3 MIC determination results of tested strains
2.2.2 试验数据重复性分析
由于MIC测定所得数据非正态分布,故先将数据取对数使其符合方差分析的数据要求(>400 μg/mL按800 μg/mL计,<0.78 μg/mL按0.78 μg/mL计)。用SPSS软件对取对数后的MIC数据进行方差分析,以检测试验数据的重复性,18株试验菌株对3种氟喹诺酮类药物的平均标准差、均值、变异系数如表4所示。

表4 试验数据标准差及变异系数Table 4 Standard deviation and variation coefficient of experimental data
由表4方差分析结果可知,3种氟喹诺酮类药物药物的MIC测定的变异系数(coefficient of variation,CV)均<8%,试验重复性良好,结果可反映18株试验菌株的真实耐药情况。
2.2.3 试验菌株对抗生素的耐药结果判定
参照CLSI药敏判断标准中肠球菌属MIC解释(见表2),对18株试验菌株及质控菌株(大肠埃希氏菌)的MIC结果进行判读,结果如表5所示。

表5 试验菌株的耐药结果Table 5 Drug resistance of tested strains
由表5可知,除DM22和DM32外的其他试验菌株对左氧氟沙星、诺氟沙星、环丙沙星3种抗生素均呈现耐药。DM22对3种抗生素均为中介;DM32对左氧氟沙星和环丙沙星敏感,对诺氟沙星为中介。试验菌株对左氧氟沙星、诺氟沙星、环丙沙星的耐药率均高达88.9%。
2.3 耐药菌株的生理生化鉴定
筛选出对3种抗菌药的MIC均>400 μg/mL(所设定的最高浓度)的菌株SB4、SB26、DM33、DM41 及对3种抗菌药都处于中介的菌株DM22。对这5株菌进行生理生化鉴定,鉴定结果如表6、表7所示。
由表6可知,5株试验菌株均为同型发酵,在10℃和45℃均可生长,SB4、SB26、DM41在50℃也可生长;5株试验菌株在酸性(pH4.8)和碱性(pH9.6)条件下均可生长,耐6.5%的NaCl,均能分解精氨酸产氨气,其中DM22和DM33可发酵蔗糖产微量的葡聚糖。

表6 耐药菌株的生理生化鉴定结果Table 6 Physiological and biochemical identification results of drug resistant strain
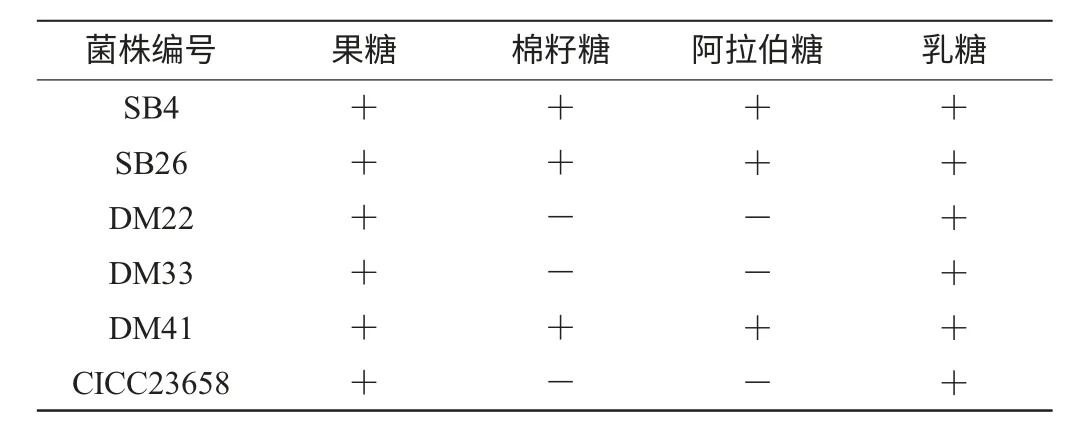
表7 糖发酵结果Table 7 Sugar fermentation results
由表7可知,5株耐药菌株均可发酵果糖和乳糖,此外,SB4、SB26、DM41还能发酵棉籽糖和阿拉伯糖。
根据文献[9]中的两歧法对试验菌株的属种进行判定,SB4、SB26、DM41 初步判定为屎肠球菌(Enterococcus faecium),DM22、DM33初步判定为粪肠球菌(Enterococcus faecalis),同时标准菌株CICC23658判定为粪肠球菌。
2.4 耐药菌株16S rRNA序列同源性
提取得到的试验菌株基因组总DNA经电泳检测,条带远大于2 000bp,符合试验预期。PCR产物电泳图见图1。由图1可知,产物条带约为1 500bp,与文献中该引物所扩增的目的产物大小相同。

图1 16S rRNA基因PCR产物电泳检测Fig.1 Electrophoresis detection of 16s rRNA gene PCR product
5株试验菌株和标准菌株的16S rRNA序列与GenBank中已知菌株的基因序列进行同源性比对,系统发育树见图2。
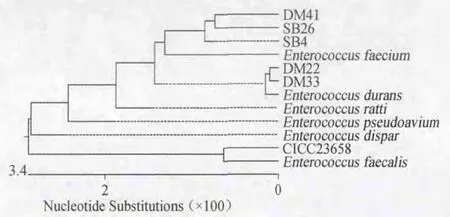
图2 试验菌株与其他乳酸菌的系统发育树Fig.2 Phylogenetic tree of tested strains and other lactic acid bacteria
图2结果表明,SB4、SB26、DM41与屎肠球菌同源性最高,由此可判定这3株菌为屎肠球菌(Enterococcus faecium)。DM22、DM33与坚强肠球菌同源性均高达99.4%,由此可判定DM22和DM33都为坚强肠球菌(Enterococcus durans),与生化鉴定结果有出入,可能的原因是生化鉴定不能有效鉴别部分亲缘关系近的菌种。同时,标准菌株CICC23658与粪肠球菌(Enterococcus faecalis)同源性为99.9%,说明试验结果可信。
3 讨论
肠球菌是人和动物肠道中的正常菌群,广泛存在于乳制品和发酵食品中[10-12]。据有关文献报道,在欧洲国家已有十多株肠球菌被允许用于食品中[13],随着微生态学理论的发展,肠球菌也可越来越多地用于微生态制剂的生产。另外,屎肠球菌和坚强肠球菌都可产生具有抑菌作用的肠球菌素[14]。因此,在肠球菌进行安全性评价的基础上,将其应用于乳制品、肉制品的发酵已成为发酵剂开发和研究的热点。
目前研究认为,细菌耐药性一般可以大致分为2种:一是固有性耐药,二是获得性耐药。固有性耐药一般不会发生转移;但获得性耐药菌株容易发生耐药基因的转移,可能转移到其他乳酸菌或致病菌中[15]。因此,研究耐药菌株是否为获得性耐药对耐药菌株今后的安全应用显得尤为重要。自然发酵乳中的乳酸菌对氟喹诺酮类药物产生耐药性的原因,以及会不会发生转移都有待进一步研究证实。
4 结论
从自然发酵乳中分离初步鉴定为乳酸菌的18株球菌对左氧氟沙星、诺氟沙星、环丙沙星呈现不同程度的耐药,耐药率均高达88.9%。对筛选出的4株高度耐药和1株中介菌株进行生理生化鉴定和16S rRNA序列同源性分析,鉴定结果显示SB4、SB26、DM41为屎肠球菌(Enterococcus faecium),DM22、DM33为坚强肠球菌(Enterococcusdurans)。
[1]TSAI Y T,CHENG P C,PAN T M.The immunomodulatory effects of lactic acid bacteria for improving immune functions and benefits[J].Appl Microbiol Biot,2012,96(4):853-862.
[2]闫 肃,吕嘉枥,郜洪涛.乳酸菌在食品工业中的应用[J].中国酿造,2010,29(12):1-3.
[3]李少英,乌 尼,李培锋,等.内蒙古牧区乳与乳制品中乳酸菌资源及其生态分布[J].生态学杂志,2006,25(12):1495-1499.
[4]赵汝霞,虞亦鸣,邓在春.喹诺酮类药物的研究进展[J].临床肺科杂志,2010,15(12):1769-1770.
[5]陈天寿.微生物培养基的制造及应用[M].北京:中国农业出版社,1995.
[6]张 刚.乳酸细菌——基础、技术和应用[M].北京:化学工业出版社,2006.
[7]叶 晴,尹光琳.用真空冷冻干燥法保存微生物菌株[J].现代科学仪器,2000,10(4):19-20.
[8]COCKERILL F.Performance standards for antimicrobial susceptibility testing;twenty-third informational supplement[M].Ithaca:clinical and laboratory standards institute,2013.
[9]内村泰,岗田草苗.乳酸菌试验手册(日文版)[M].东京:朝仓书店,1992.
[10]陈芝兰,杨吉霞,李梦寒,等.西藏地区传统发酵乳中乳酸菌多样性及微生物数量分析[J].食品科学,2013,34(17):140-145.
[11]马 燕,倪永清,卢士玲,等.新疆特色干酪中乳酸菌的分离鉴定[J].中国酿造,2011,30(8):38-40.
[12]杨希娟,樊明涛,师俊玲,等.西藏灵菇发酵乳中优势菌群的分离鉴定[J].中国酿造,2007,26(6):52-55.
[13]Commission of the European communities[C].List of the authorised additives in feeding stuffs published in application of article 9t(b)of council directive 70/524/EEC concerning additives in feeding stuffs,Brussels,2004.
[14]伍先绍,贺稚非,陈卫良.肠球菌素及其产生菌株在食品工业中的研究和应用现状[J].食品与发酵工业,2008,34(11):111-116.
[15]张灼阳,刘 畅,郭晓奎.乳酸菌耐药性研究进展[J].中国微生态学杂志,2007,19(5):478-480.

