植物-微生物联合修复石油污染土壤的实验室模拟研究
雒晓芳,樊国庆,王 瑾,王鸿雁,田丹妮,汪如婷
(1.西北民族大学 实验中心,甘肃 兰州 730030;2.西北民族大学 生命科学与工程学院,甘肃 兰州 730030)
随着我国石油工业的不断发展,石油污染土壤对生态环境造成了严重污染,它对土壤的影响是破坏土壤结构,影响土壤的通透性,而且还会损害植物根部,阻碍有氧呼吸的进行和对营养物质的吸收,最终将导致植物的死亡。再者,石油里的一些有毒物质若直接进入人的食物链中,势必会对人体的健康构成巨大威胁。所以,鉴于以上原因,石油污染土壤问题已经引起了全世界各国科学家的广泛关注。我国石油污染相当严重,石油污染土壤生物处理技术发展较晚。刘期松等[1]于1978年率先开展了石油污染区微生物生态及降解石油的研究,分离出126株细菌,60%菌株有解脂酶活性,真菌有71株,89%有解脂酶活性。对原油降解率分别为19%~33%和17%~45%,为石油污染生物处理奠定了基础。
目前,植物-微生物联合修复已成为石油污染土壤修复研究领域的热点,该技术可以将植物修复与微生物修复两种方法的优点相结合,从而强化根际有机污染物的降解。利用植物-微生物联合作用降解石油污染土壤,这是因为根际中植物-微生物的相互作用往往是互惠的。植物根表皮细胞的脱落、植物渗出物等为根际微生物提供了营养源、植物根系巨大的表面积也是微生物的寄宿之处[2],微生物的活动也会促进植物生长和根系分泌物释放。
植物可以促进根际微生物的降解转化作用,已经被很多研究所证实。植物为微生物提供了生存场所,并可转移氧气使根际的有氧呼吸作用能够正常进行;植物的根向根际释放碳水化合物、氨基酸和有机酸等,这些物质刺激了根际各种菌群的生长繁殖[3-4],增强了细菌的联合降解作用;根际土壤微生物数量一般是无根系土壤的5~20倍,有的高达100倍[5]。根际形成的有机碳可以阻止有机化合物向地下水转移,也可以增加微生物对石油污染物的矿化作用;某些情况下植物根分泌物也可作为天然的共代谢底物促进污染物的降解。此外,植物根系可以伸展到不同层次的土壤中,因此无需混合土壤就可使降解菌分散在土壤中[6]。另一方面,根际微生物的活动也会促进根系分泌物的释放,并可保护植物免受化学物质的伤害。
本研究通过盆栽实验,研究了土壤中不同质量分数石油对土壤中微生物数量的影响,以及对土壤残油量进行了测定;以便为以后的石油污染土壤的治理和控制提供理论基础和实践指导。
1 材料与方法
1.1 材料与试剂
以陕西姬塬油田附近被石油污染的土壤为样本,以石油为唯一碳源,通过富集培养和特殊培养基分离法,最终分离筛选出具有高效石油降解能力的八株菌,这八株菌暂时命名为S1、S2、X1和X2、Q1、Q2、J1、J2,将八株菌按照均量配比制备为混合菌剂,待用。
1.2 仪器与设备
QH2-98A全温度振荡培养箱:江苏太仓华美生化仪器厂;HVE-50高压湿热灭菌锅:日本Hirayama公司;DHP-9162电热恒温培养箱:上海一恒科学仪器有限公司;ES-300E电子天平:长沙湘平科技发展有限公司;BCD-235型冰箱:青岛海尔股份有限公司;DK-S24电热恒温水浴锅:上海精宏实验设备有限公司;XW-80A漩涡混合器:江苏海门市麒麟医用仪器厂。
1.3 实验设计
利用盆栽实验,共设置15个样品,其中6个为对照(CK)。将取自陕西姬塬油田的石油分别配制成为2.0%、4.0%、8.0%三个质量分数梯度,将上述菌剂配制成0.5%、1.5%、3.0%。实验组合方式见表1。
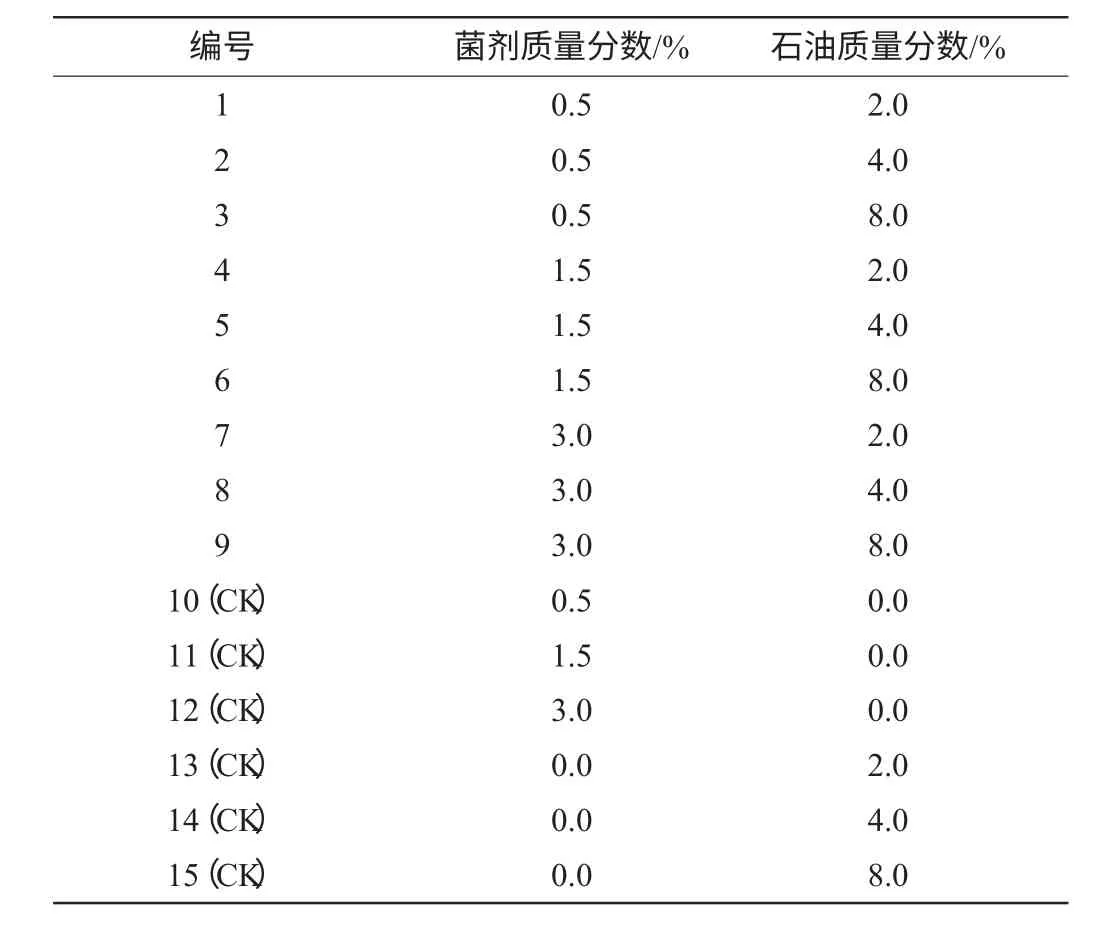
表1 实验组合方式Table 1 Combination ways of the experiment
1.3.1 土壤处理与播种
首先,将取得的土壤粉粹,并将其过40目筛,每个花盆2 kg土壤。将原油分别配制成质量分数为2.0%、4.0%、8.0%,菌剂质量分数为0.5%、1.5%、3.0%。每盆播种10粒种子,待发芽1 d后接种微生物。
1.3.2 土壤采样
本实验采用五点取样法对花盆中的土样进行取样,土样分别取自0 d、7 d、14 d、21 d、28 d、35 d、42 d、49 d和56 d的土壤。然后倒入250 mL灭菌三角烧瓶中,混匀,让其自然风干。
1.3.3 微生物数量的测定
A:培养基的配制
(A1)酵母培养基采用麦氏培养液:葡萄糖1.0 g,氯化钾1.8 g,酵母浸膏2.5 g,醋酸钠8.2 g,蒸馏水1 000 mL。
(A2)细菌培养基采用营养肉汤培养基:蛋白胨5.0 g,牛肉浸取物3.0 g,氯化钠5.0 g,蒸馏水1 000 mL。
B:微生物数计数
将采取的1 g土壤于10 mL无菌水中,稀释成10-4、10-5、10-6三个梯度,分别取这三个梯度的菌悬液0.1 mL接种于相应培养基中,于37 ℃培养箱中培养48 h后观察记录菌落数量。酵母菌培养温度为28 ℃,培养时间为3~5 d;细菌培养温度为35 ℃,培养时间为1~2 d。
根据不同培养基中生长出的菌落数统计细菌和酵母菌数量,结合土壤样品的稀释倍数,按照公式:土壤微生物浓度(CFU/g)=(菌落平均数×稀释倍数)/每皿菌液加入量(mL),求得土壤中真菌、细菌和放线菌浓度[7]。
1.3.4 石油残留量的测定
A:土壤预处理
采用五点采样法采取土壤样品,待其自然风干、磨碎、过100目筛,称取10 g土壤于折叠好的滤纸筒中,将旋转蒸发瓶洗净,烘干,称质量记为G1。
B:残油的提取
①将滤纸筒放入索氏提取器中,加入150 mL左右的正己烷于70 ℃水浴锅上回流6 h,待提取液无色,即回流完毕,将收集到滤液于旋转蒸发仪上蒸干正己烷。
②将旋转蒸发瓶于95 ℃烘箱中烘干,然后置于干燥器中冷却30 min后称质量,记为G2。
③G2-G1即为提取物(石油),计算出土壤中石油含量,从而可以用下式计算出石油降解率。
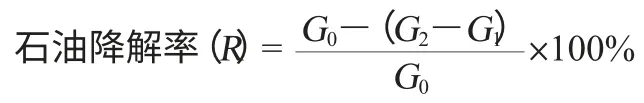
式中:R表示石油降解率,%;G0表示原始含油量,g;G1表示烧瓶净质量,g;G2表示提取物质量,g;(G2-G1)表示提取的石油质量,g。
2 结果与分析
从图1可以看出,在0~7 d内微生物的数量增长的较慢,主要是由于微生物刚刚接种到含石油的土壤中,微生物对这种特殊环境有一个适应阶段。所以微生物在此阶段基本上不表现出菌体数量的增加。此阶段微生物数量最大为(3.0%菌剂+8.0%石油)组,最大值为20.0×106个/g土壤。

图1 不同石油浓度和菌剂浓度在不同培养时间下的微生物数量(×106个每克土壤)Fig.1 Number of microorganisms at different petroleum density,microorganism addition and culture time
在7~14 d内微生物的数量几乎呈指数式增长,此阶段微生物对周围的石油环境已经适应,开始利用有机物进行生长代谢。此时微生物的生长很平衡,即细胞内各种成分按比例有规律的增加,对石油污染物的降解速率也是最快的。在14~28 d内微生物数量继续增加,但增长速率不是太快。最明显的变化是(3.0%菌剂+4.0%石油)组的生长速率超过了(3.0%菌剂+8.0%石油)组,由此可知,8.0%质量分数的石油对微生物产生了毒性。再者,此阶段由于营养物质(石油污染物)开始缺乏,使微生物生长速率较前一阶段小。当微生物生长到28 d时,微生物数量达到最大值:95.8×106个/g土壤;对应的石油降解率为74.5%。此时细菌的数量为111.0×106个/g土壤;酵母菌数量为80.5×104个/g土壤。在28~56 d这段时间,由于微生物次级代谢产物的积累、营养物质消耗殆尽、土壤板结、pH值变化等因素,导致微生物的生理代谢需求得不到满足,甚至直接造成微生物的死亡(有些微生物产生的抗生素也会杀死一些微生物)。所以此阶段微生物数量开始下降,最低降至2.8×106个/g土壤。
在对照组(图2)中,微生物数量最多的为只加3.0%菌剂的组,最大值达到14.5×106个/g土壤。该组没有加石油,但是它的微生物数量的基数(3.0%菌剂)是最大的,所以它的微生物数量大于其他组。而在实验组中,(3.0%菌剂+4.0%石油)组微生物数量为95.8×106个/g土壤。对比二者可以发现,在同样的菌剂浓度(3.0%)下,限制微生物增长的主要因素为营养物质(石油)的质量分数。
另外,只加入石油的组微生物数量也出现了波动,4.0%石油质量分数的组同样在28 d达到最大值11.5×106个/g土壤;而且可以看出8.0%石油质量分数的组微生物数量的最大值为9.5×106个/g土壤。8.0%石油质量分数组的微生物数量<4.0%石油质量分数的组,进一步说明了8.0%质量分数的石油确实会对微生物产生毒害作用,而且有可能一些微生物在刚刚加入石油污染物的时候就已经被毒死,该组(8.0%石油)的微生物数量降至所有对照组最小值:4.5×106个/g土壤。还应该指出的是,只加石油的组微生物是土壤中的一些土著微生物种群。
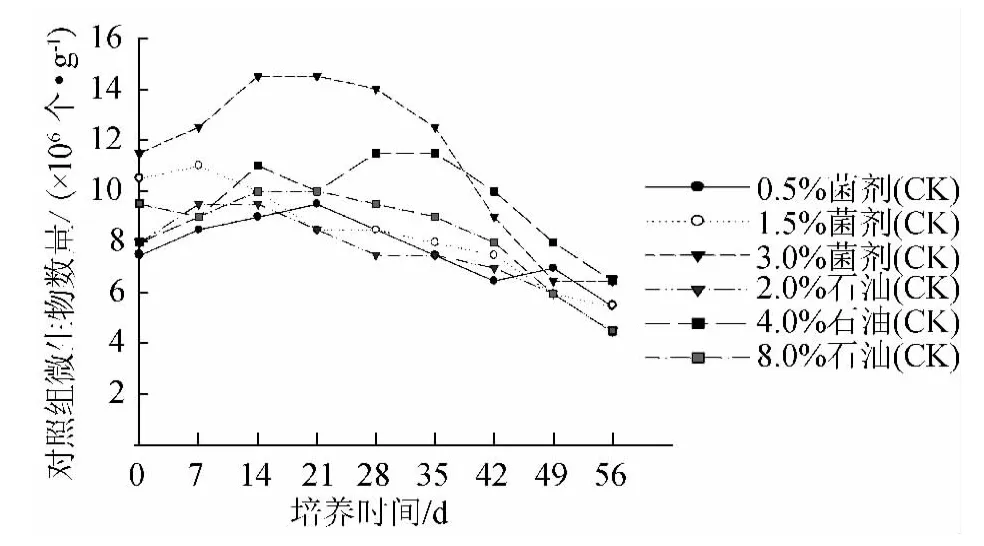
图2 不同石油浓度和培养时间下的对照组微生物数量(×106个每克土壤)Fig.2 Number of microorganisms of the control group at different petroleum density,microorganism addition and culture time
从图3可知,微生物对石油的降解曲线类似于图1中微生物的数量增长曲线,表现出一定的规律性,总的趋势是从低到高,再从高到低。第7天时测得微生物对石油的降解率最低组(0.5%菌剂+2.0%石油)为11.4%;最高组(3.0%菌剂+4.0%石油)为28.9%。造成此阶段石油降解率偏低的主要原因是微生物的数量还不够多,此阶段的微生物正处于适应期,并且这里测定的石油降解率主要是石油自身挥发造成的,因为很少微生物在这个阶段能够利用石油进行代谢反应。
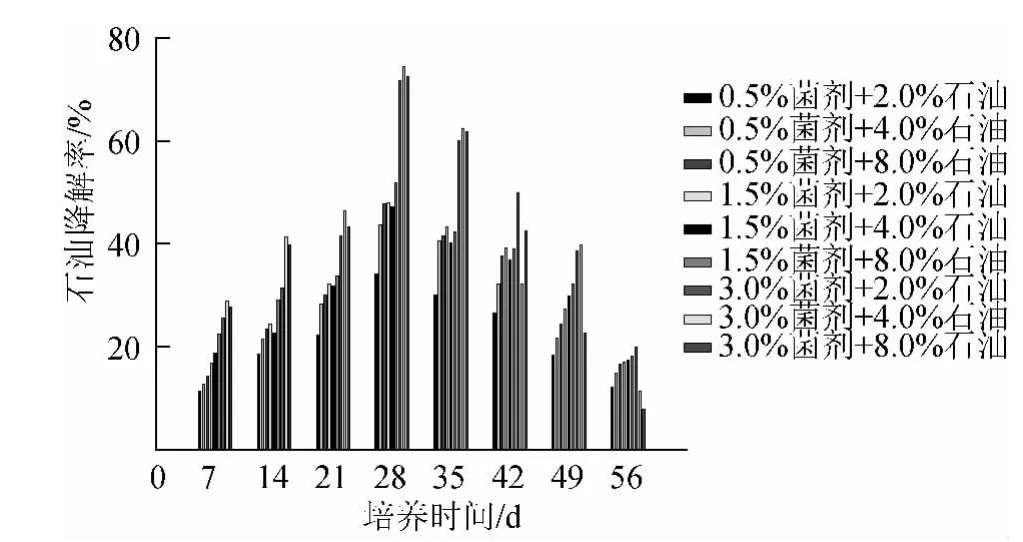
图3 在不同石油浓度、菌剂浓度以及不同培养时间下的石油降解率Fig.3 Effects of different petroleum density,microorganism addition and culture time on petroleum degradation
随着微生物数量的增加,在14~28 d内石油降解率稳步上升。同样,在微生物数量最多的时候(28 d)达到最大石油降解率74.5%;此时石油降解率较高的还有72.4%和71.8%,它们对应的微生物数量分别为95.8×106个/g土壤、76.0×106个/g土壤、68.8×106个/g土壤;在相同的石油质量分数(4.0%)下,微生物对石油的降解率受菌剂浓度的直接影响,如在28 d时,(3.0%菌剂+4.0%石油)组的石油降解率为74.5%,而(1.5%菌剂+4.0%石油)组下的石油降解率仅为47.1%,所以在一定的程度上,菌剂浓度越高,对石油的降解率就越大。
但是,白云等[8]通过实验发现,降解60 d后,接种量为0、5 mL、10 mL、15 mL、20 mL、25 mL、30 mL石油烃降解率分别为22%、46%、54%、60%、64%、74%、70%。通过以上数据可以看出,并非投加量越大,对去除促进就越大,即高效菌的投加量与降解率之间存在一个适宜的投加值。
土壤中广泛分布着可降解石油的微生物菌种,它们是土壤生物修复作用的主角。因为石油系天然有机物,故而微生物发展了利用石油的能力是不足为奇的。但是数量上相差很大,一般为细菌总数的0.13%~0.50%[9-10]。土壤中降解石油微生物的数量与污染物的存在有着密切的关系。它们能够适应环境,然后进行选择性富集并发生遗传改变,从而导致烃类降解菌所占比例及编码降解烃类基因的质粒数量增加[11]。
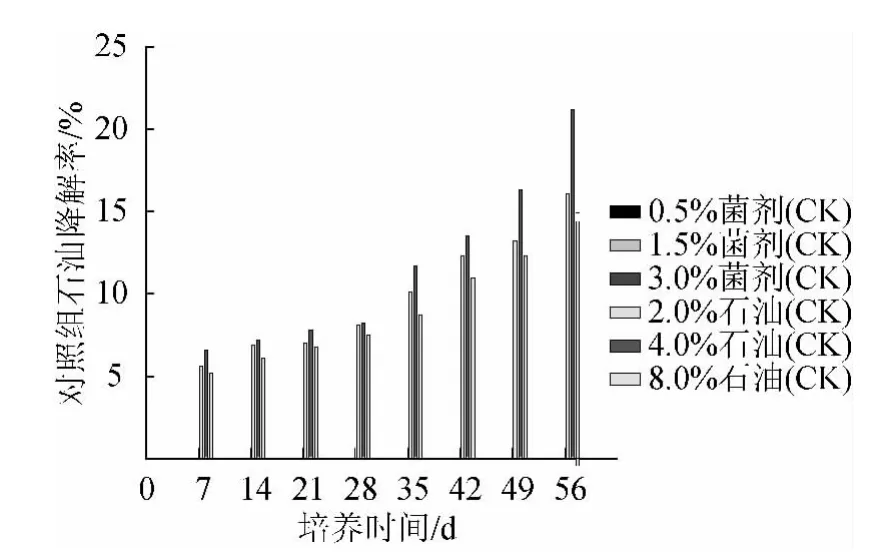
图4 在不同石油浓度、菌剂浓度以及不同培养时间下对照组的石油降解率Fig.4 Effects of different petroleum density,microorganism addition and culture time on petroleum degradation of the control group
从图4可知,对照组处理(2.0%、4.0%、8.0%石油质量分数)中虽然没有加入菌剂,但是加入的石油污染物使土壤状况得到改善,刺激了土著微生物的生长,所以对石油具有一定的降解率。4.0%的石油比8.0%的石油降解的更快,在56 d时分别为21.2%、14.9%;出现此结果的原因可能是8.0%的石油黏度比较大,从而挥发性>4.0%的石油,二者石油降解率的差异实质上是石油挥发度不同造成的;此时微生物(实为土著微生物)的数量分别为6.5×106个/g土壤和4.5×106个/g土壤,这两个数据相差不大,在无外源微生物菌剂加入时,可以认为土著微生物对石油的降解作用很小。
对于土著微生物对石油降解率的影响,倪娜[12]认为,土著微生物长期在污染的环境中生长,自身具备对石油烃较好的适应能力和较高的降解能力,因此从石油污染的土壤中分离出具有石油降解能力的土著微生物,将其富集后重新投入到石油污染土壤中进行生物强化实验理论上效果应该更优。UENO A等[13]从做过生物刺激实验的土壤中分离出有高效降解能力的菌株J,将其富集后重新投放回原污染土壤中进行生物强化实验,最终总石油烃(total petroleum hydrocarbon,TPH)降解率为50%左右,比同等条件下用外源菌株WatG的强化处理效率高。ATAGANAH I等[14]采用从杂芬油污染土壤中分离出的5种真菌进行本土生物强化实验,结果发现在生物强化处理中,4环和5环多环芳烃(polycyclic aromatic hydrocarbon,PAHs)在70 d的实验后降解率可达90%,比其他用细菌等进行的生物强化效率高出很多。这些结果均说明在应用土著微生物进行生物强化实验时比用外源微生物强化时有较明显的优势。
3 讨论
当石油质量分数相同时,随着菌剂浓度的提高,微生物数量有明显的增加。本实验以石油为唯一碳源,所以在一段时间内,微生物的数量在某种程度上取决于微生物加入时的基数;当菌剂浓度相同时,石油质量分数高的样品微生物增加更快。所以,在微生物的耐受范围内,碳源物质的增加有利于微生物繁殖。当菌剂浓度和石油质量分数进一步提高时,微生物数量增加得快,但也减小得快。从代谢的角度考虑,是因为微生物体内积累了不少的次级代谢产物,诸如抗生素等物质。这些物质对大多数微生物都有毒害作用,有的甚至直接杀死微生物,导致微生物的数量下降,从而也导致了石油降解率的下降。
当有足够可利用的石油污染物时,在一定时间内微生物不断繁殖,可以使石油降解率达到最大,这是生物修复过程中最希望出现的最佳状况[15]。但是这种情况出现的条件是石油污染物浓度不是太大,否则会对微生物直接产生毒害作用。在对照组实验中,仅仅加石油或菌剂对微生物数量无太大影响。因为只加入菌剂的样品无营养物质(本实验为石油污染物)的供应,所以导致微生物几乎无法生长,从而没有微生物数量大量的积累;而只加入石油(营养物质)却没有微生物的消耗利用,也不会有微生物数量的积累,积累的仅仅是一些数量不多的土著微生物。由于土壤微生物在降解过程中产生的酸性物质在土壤中一般有累积效应,则会导致pH进一步降低,所以在偏酸性石油污染土壤的生物修复中,为了提高微生物的代谢活性和降解石油的速率,可以在土壤中加入一些酸碱缓冲液调整土壤的pH[16]。
4 结论
当石油污染物的最适质量分数范围介于4.0%~8.0%之间,菌剂浓度在3.0%时,植物-微生物联合降解石油污染物有较好的效果,微生物数量介于68.8×106~95.8×106个/g土壤;石油降解率介于72.4%~75.4%。如果石油质量分数>8.0%会对微生物产生毒害作用,有的甚至直接杀死微生物。多数情况下,需要对石油污染物进行稀释处理,然后再加入菌剂,这样可以避免因石油浓度过高而杀死微生物,造成微生物菌剂的浪费。
[1]刘期松,齐恩山,张春桂,等.石油污水灌区的微生物生态及其降解石油的研究[J].环境科学,1981,2(3):1-6.
[2]高彦征.土壤多环芳烃污染植物修复及强化的新技术原理研究[D].杭州:浙江大学博士论文,2004.
[3]LEIHG M B,FLETCHER J S,FU X,et al.Root turnover:An important source of microbial substrates in rhizosphere remediation of recalcitrant contaminants[J].Environ Sci Technol,2002,36(7):1579-1583.
[4]AYOTAMUNO J M,Kogbara R B,Agoro O S.Biostimulation supplemented with phytoremediation in the reclamation of a petroleum contaminated soil[J].World J Microbiol Biotechnol,2009,25(9):1567-1572.
[5]赵爱芬,赵 雪,常学礼.植物对污染土壤修复作用的研究进展[J].土壤通报,2000,31(1):43-45.
[6]ROMANTSCHUK M,SARAND L,PETANEN T,et al.Means to improve the effect of in situbioremediation of contaminated soil:an overview of novel approachs[J].Environ Pollut,2000,107(2):179-185.
[7]顾传辉,陈桂珠.石油污染土壤生物降解生态条件研究[J].生态科学,2000,1(4):67-71.
[8]白 云,李 川,焦昭杰.石油污染土壤生物修复室内模拟试验[J].三峡环境与生态,2011(33):27-28.
[9]JONES D M.The recognition of biodegraded petroleum 2 derived aromatic hydrocarbons in recent marine sediment[J].Pollut Bull,1983,14:103-108.
[10]PINHOTT Y,STRUWE S,KJOLLER A,et al.Microbial changes during oil decomposition in soil[J].Ecography,2006,2(3):195-200.
[11]刘 鹏.石油降解功能菌的筛选,驯化及其应用[D].成都:四川大学硕士论文,2006.
[12]倪 娜.降解柴油酵母菌的分离纯化及性质研究[D].曲阜:曲阜师范大学硕士论文,2011.
[13]UENO A,ITO Y,YAMAMOTO I.Isolation and characterization of bacteria from soil contaminated with diesel oil and the possible use of these in autochthonous bioaugmentation[J].World J Microb Biot,2007,23(12):1739-1745.
[14]ATAGANA H I,HAYNES R J,WALLIS F M.Fungal bioremediation of creosote-contaminated soil:a laboratory scale bioremediation study using indigenous soil fungi[J].Water Air Soil Poll,2006,172:201-219.
[15]安 淼,周 琪,李 晖,等.土壤污染生物修复的影响因素[J].土壤与环境,2002,11(4):397-400.
[16]姜 梅.黄土地区石油污染物的微生物降解[D].兰州:西北师范大学硕士论文,2003(4):14-15.

