主动脉夹层术后早期急性肾损伤的危险因素分析
王 肇,高长青,肖苍松,龚志云
解放军总医院 心血管外科全军心脏外科研究所,北京 100853
主动脉夹层术后早期急性肾损伤的危险因素分析
王 肇,高长青,肖苍松,龚志云
解放军总医院 心血管外科全军心脏外科研究所,北京 100853
目的 探讨主动脉夹层手术后早期发生急性肾损伤的围术期危险因素。方法回顾性收集2006年1月- 2013年6月在本院心血管外科接受主动脉夹层手术的104例患者的临床资料,根据KDIGO分级诊断标准将患者分为急性肾损伤组和非急性肾损伤组,采用Logistic多因素回归分析术后发生急性肾损伤的危险因素。结果术后48 h内发生急性肾损伤78例(75.0%),12例(11.5%)术后需肾替代治疗,住院死亡5例(4.8%)。Logistic回归分析提示:体外循环时间、高血压和深低温停循环时间>40 min是主动脉夹层术后发生急性肾损伤的独立危险因素。结论主动脉夹层术后急性肾损伤的发生概率高。体外循环时间、高血压和深低温停循环时间>40 min是主动脉夹层术后发生急性肾损伤的独立危险因素。
主动脉夹层;急性肾损伤;深低温停循环;危险因素
急性肾损伤(acute kidney injury,AKI)是心脏大血管手术后常见的并发症。既往研究显示,术后发生AKI的患者的近期死亡率明显增加,行肾替代治疗的患者短期死亡率更高,可达64%[1-3]。即使肾功能部分或完全恢复,AKI患者的远期死亡率较非AKI患者也明显升高[4-6]。主动脉夹层手术作为一类复杂的大血管手术,常常需要在深低温停循环下进行,体外循环时间相对较长,与其他心脏手术相比,术后发生AKI的风险更高。2002年以来国际上先后提出了针对AKI的RIFLE和AKIN诊断标准,2012年,改善全球肾病预后组织(KDIGO)在兼顾了RIFLE和AKIN标准优点的基础上又制定了新的KDIGO标准。既往已有报道采用RIFLE或AKIN标准分析主动脉夹层术后AKI。而本研究采用KDIGO标准对主动脉夹层术后AKI的发生情况进行评估,并分析AKI发生的围术期危险因素。
对象和方法
1 对象 回顾性分析2006年1月- 2013年6月在我科接受主动脉夹层手术的107例患者的临床资料。除去有慢性肾功能不全史(1例)和临床资料缺失(2例)的患者3例,共有104例患者纳入本项研究。
2 方法 回顾性分析患者的一般情况(年龄、性别)、主动脉夹层分型、既往病史(高血压、糖尿病、慢性肺疾病、脑血管病)、术前心功能、手术相关情况(急诊或择期手术、手术类型、体外循环时间、主动脉阻断时间、深低温停循环时间)、实验室相关指标(术前肌酐值、术前血红蛋白、术后48 h内肌酐值峰值、围术期输血量)以及术后相关变量(肾替代治疗情况、住院病死率)。AKI按照KDIGO标准进行界定,其诊断标准:肾功能在7 d内迅速减退,血肌酐(Scr)增高至基础值的1.5倍或48 h内绝对值升高26.5 μmol/L或持续6 ~ 12 h尿量<0.5 ml/(kg·h)[7]。根据术后是否发生AKI将患者分为AKI组和非AKI组。将整理的临床变量进行分析并计算主动脉夹层术后发生AKI的危险因素。
3 手术过程 所有患者均在静脉复合全身麻醉体外循环下施行手术。监测有创血压、中心静脉压、肺动脉和楔压。根据术前评估情况行右侧腋动脉或升主动脉插管。经右心房插腔房管,经右上肺静脉放置左心引流管,建立体外循环。根据术前评估、术中探查情况决定是否行深低温停循环以及同时行脑部灌注。深低温停循环时肛温降至20℃、鼻咽温降至18℃。根据主动脉夹层病变情况行升主动脉、主动脉弓、弓上三支或降主动脉重建。若合并其他病变则在术中同期处理。排气后开放主动脉阻断钳,心脏复苏,完成手术。
4 统计学分析 全部数据采用SPSS19.0统计软件进行统计分析,定义双侧P<0.05有统计学意义。计量资料根据正态性分布情况采用或中位数和四分位数范围表示,组间比较采用t检验或Mann-Whitney U检验;计数资料用频数和率表示,组间比较采用χ2检验。危险因素分析先采用单因素分析进行筛选,再将有统计学差异的变量进行Logistic多因素回归分析,计算OR值与95%置信区间。
结 果
1 患者一般情况 本组104例中男性87例(83.7%),平均年龄(45.8±11.2)岁。诊断主动脉夹层De BakeyⅠ型83例(79.8%),De BakeyⅡ型18例(17.3%),De BakeyⅢ型3例(2.9%)。既往有高血压76例(73.1%),糖尿病2例(1.9%),脑血管病5例(4.8%),慢性肺疾病2例(1.9%),既往心脏手术1例(1.0%)。术前血红蛋白(131.2±19.4) g/L,肌酐值(104.9±60.6) μmol/L,术后48 h内肌酐值峰值(228.9±170.8) μmol/L。所有患者的心功能均在正常范围。手术部位包括主动脉近端或升主动脉103例(99.0%),主动脉弓73例(70.2%),降主动脉24例(23.1%),合并处理主动脉瓣37例(35.6%),冠脉旁路移植10例(9.6%),二尖瓣1例(1.0%),左心房占位1例(1.0%)。74例(71.2%)为急诊手术,82例(78.8%)应用深低温停循环技术。体外循环时间为(213.2±79.7) min,主动脉阻断时间为(133.4±52.3) min,深低温停循环时间为34(24,68) min。输红细胞7.5(4,12) U。
2 术后AKI的发生情况及危险因素 术后78例(75.0%)发生AKI(表1),12例(11.5%)术后需肾替代治疗。AKI组患者住院死亡5例(6.4%),非AKI组无死亡,但两组差异无统计学意义。AKI组与非AKI组单因素分析结果显示:年龄、高血压、De BakeyⅠ型夹层、De BakeyⅡ型夹层、体外循环时间、主动脉阻断时间、应用深低温停循环技术、深低温停循环时间、深低温停循环时间>40 min以及围术期输血有统计学差异。将单因素分析中有统计学差异的变量进一步行Logistic多因素分析,结果提示:高血压(OR=13.93;95% CI,2.13 ~ 91.33)、体外循环时间(OR=1.03;95% CI,1.00 ~ 1.06)、深低温停循环时间>40 min(OR=24.24;95% CI,1.07 ~ 548.60)是主动脉夹层术后发生AKI的独立危险因素。见表2。
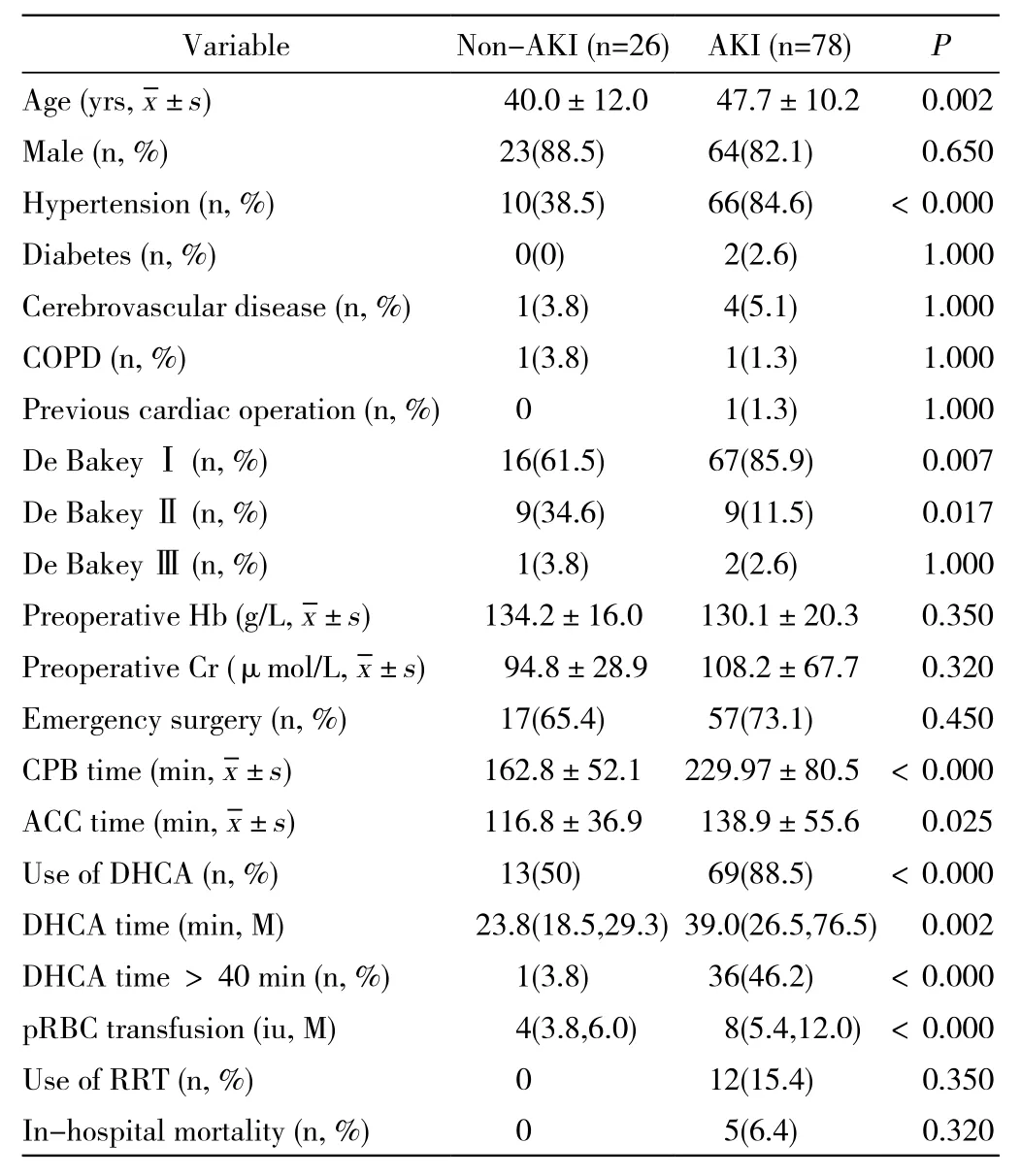
表1 两组患者临床资料比较Tab. 1 Comparison of patients’clinical data in two groups

表2 术后发生AKI的Logistic多因素回归分析Tab. 2 Multivariate analysis of risk factors of postoperative AKI
讨 论
主动脉夹层术后AKI的发生率高,其发病机制与肾的易感性、体外循环引起的供氧失衡、炎性反应和栓塞有关[8]。而主动脉手术后AKI的发生率以及危险因素不尽一致,这与AKI的诊断方法、研究方法、研究对象等多方面因素有关[8]。既往研究显示主动脉手术后AKI发生率为18% ~ 54%,而本研究AKI的发生率为75%,比以往高出许多,这可能是不同研究采用的AKI诊断标准不同所致[9-12]。既往研究大多采用RIFLE诊断标准,而我们采用的KDIGO标准只要术后7 d内肌酐值峰值大于基线值的1.5倍或48 h内绝对值升高26.5 μmol/L就能诊断AKI,使得敏感性较RIFLE标准升高[7]。同时,本组患者病情大多复杂,手术操作时间长,且部分需同期处理主动脉瓣、二尖瓣、左心房占位或同时行冠脉旁路移植术,使深低温停循环时间和体外循环时间相应延长,这也可能是AKI发生率高的原因之一。全组患者术后行肾替代治疗12例(11.5%),住院死亡5例(4.8%),发生率与文献报道基本一致[9,11,13]。
在本研究中,多因素Logistic回归分析结果提示高血压、体外循环时间和深低温停循环时间>40 min是主动脉夹层术后发生AKI的独立危险因素。高血压在主动脉夹层患者中非常常见,但其导致AKI的机制并不明确。有研究显示高血压肾损害所致的肾功能储备下降以及高血压-动脉粥样硬化相关的血栓栓塞是可能的发生机制[14]。合并高血压的主动脉夹层患者术前基础血肌酐值可能并不能反映其真实的肾功能状态,因此,术前计算肾小球滤过率是有必要的。同时,应该非常重视重要动脉的粥样硬化情况。术前通过CT等检查详细评估以及术中小心操作避免斑块掉落引起的栓塞事件是有效的预防方法。
体外循环时间也是主动脉夹层术后发生AKI的独立危险因素。首先,体外循环介导的炎性反应会引起AKI,而炎性介质可以直接引起肾小管损害[15-16]。同时,由于体外循环转机时红细胞暴露于非生理性的管道表面以及管道内血流剪切力所导致的溶血,血红蛋白会堵塞肾小管并引起小管细胞坏死,从而出现血红蛋白尿[17-18]。Sreeram等[19]在体外循环冠状动脉旁路移植手术中进行经颅超声检查并对栓子信号进行计数,发现栓子数量与血肌酐值变化明显相关,提示体外循环引起的栓子可能也是导致AKI的原因之一。另外,当体外循环复温时,肾代谢需求量同时升高,而肾相对低流量供血所致的供氧失衡也会继发引起肾损害[20]。也有研究显示体外循环转机时体温<27℃可能与AKI的发生直接相关[21]。本组患者病情大多复杂,平均体外循环转机时间长,术后发生AKI的风险相应增加。因此,术中尽量减少体外循环转机时间,复温时保证足够的灌注流量是积极预防AKI的重要方法。
既往研究认为深低温停循环时缺氧性肾损伤是AKI的发病机制[22]。本研究也发现深低温停循环时间>40 min也是主动脉夹层术后发生AKI的独立危险因素。另外,深低温停循环时间越长,体外循环时间也越长,这提示手术过程中应尽量减少深低温停循环时间。而深低温停循环时的肾保护措施还有待进一步研究。
本研究的不足是相对较小的样本量可能导致检验功效较低,在AKI的定义分组上,仅通过血肌酐值来进行区分,未考虑尿量的变化,而且只收集了术后48 h的肌酐值,这在以后的研究中还有待改进。总之,主动脉夹层手术作为一类复杂的心脏手术,术后AKI的发生率高。体外循环时间、高血压和深低温停循环时间>40 min是主动脉夹层术后发生AKI的危险因素。术前仔细评估肾功能、术中尽量减少体外循环转机时间和深低温停循环时间以及保持平稳的体外循环灌注流量是有必要的。
1 Chertow GM, Burdick E, Honour M, et al. Acute kidney injury,mortality, length of stay, and costs in hospitalized patients[J]. J Am Soc Nephrol, 2005,16(11):3365-3370.
2 Kuitunen A, Vento A, Suojaranta-Ylinen R, et al. Acute renal failure after cardiac surgery: evaluation of the RIFLE classification[J]. Ann Thorac Surg, 2006,81(2):542-546.
3 Chertow GM, Levy EM, Hammermeister KE, et al. Independent association between acute renal failure and mortality following cardiac surgery[J]. Am J Med, 1998,104(4):343-348.
4 Hobson CE, Yavas S, Segal MS, et al. Acute kidney injury is associated with increased long-term mortality after cardiothoracic surgery[J]. Circulation, 2009,119(18):2444-2453.
5 Brown JR, Cochran RP, MacKenzie TA, et al. Long-term survival after cardiac surgery is predicted by estimated glomerular filtration rate[J]. Ann Thorac Surg, 2008,86(1):4-11.
6 Brown JR, Kramer RS, Coca SG, et al. Duration of acute kidney injury impacts long-term survival after cardiac surgery[J]. Ann Thorac Surg, 2010,90(4):1142-1148.
7 Improving Global Outcomes (KDIGO) acute kidney injury work group. KDIGO clinical practice guideline for acute kidney injury[J]. Kidney Int Suppl, 2012,2(1):1-138.
8 Mariscalco G, Lorusso R, Dominici C, et al. Acute kidney injury: a relevant complication after cardiac surgery[J]. Ann Thorac Surg,2011,92(4):1539-1547.
9 Roh GU, Lee JW, Nam SB, et al. Incidence and risk factors of acute kidney injury after thoracic aortic surgery for acute dissection[J]. Ann Thorac Surg, 2012,94(3):766-771.
10 Englberger L, Suri RM, Greason KL, et al. Deep hypothermic circulatory arrest is not a risk factor for acute kidney injury in thoracic aortic surgery[J]. J Thorac Cardiovasc Surg, 2011 ,141(2):552-558.
11 Arnaoutakis GJ, Bihorac A, Martin TD, et al. RIFLE criteria for acute kidney injury in aortic arch surgery[J]. J Thorac Cardiovasc Surg, 2007,134(6):1554-1561.
12 Mori Y, Sato N, Kobayashi Y, et al. Acute kidney injury during aortic arch surgery under deep hypothermic circulatory arrest[J]. J Anesth, 2011,25(6):799-804.
13 Perreas K, Samanidis G, Dimitriou S, et al. Outcomes after ascending aorta and proximal aortic arch repair using deep hypothermic circulatory arrest with retrograde cerebral perfusion: analysis of 207 patients[J]. Interact Cardiovasc Thorac Surg, 2012,15(3):456-461.
14 Augoustides JG, Pochettino A, Ochroch EA, et al. Renal dysfunction after thoracic aortic surgery requiring deep hypothermic circulatory arrest: definition, incidence, and clinical predictors[J]. J Cardiothorac Vasc Anesth, 2006,20(5):673-677.
15 Sheridan AM, Bonventre JV. Cell biology and molecular mechanisms of injury in ischemic acute renal failure[J]. Curr Opin Nephrol Hypertens, 2000,9(4):427-434.
16 Paparella D, Yau TM, Young E. Cardiopulmonary bypass induced inflammation: pathophysiology and treatment. An update[J]. Eur J Cardiothorac Surg, 2002,21(2):232-244.
17 Valeri CR, MacGregor H, Ragno G, et al. Effects of centrifugal and roller pumps on survival of autologous red cells in cardiopulmonary bypass surgery[J]. Perfusion, 2006,21(5):291-296.
18 Moussavian MR, Slotta JE, Kollmar O, et al. Hemoglobin induces cytotoxic damage of glycine-preserved renal tubules[J]. Transpl Int, 2007,20(10):884-894.
19 Sreeram GM, Grocott HP, White WD, et al. Transcranial Doppler emboli count predicts rise in creatinine after coronary artery bypass graft surgery[J]. J Cardiothorac Vasc Anesth, 2004,18(5):548-551.
20 Pathi VL, Morrison J, MacPhaden A, et al. Alterations in renal microcirculation during cardiopulmonary bypass[J]. Ann Thorac Surg, 1998,65(4):993-998.
21 Boodhwani M, Rubens FD, Wozny D, Nathan HJ. Effects of mild hypothermia and rewarming on renal function after coronary artery bypass grafting[J]. Ann Thorac Surg, 2009,87(2):489-495.
22 Devarajan P. Update on mechanisms of ischemic acute kidney injury[J]. J Am Soc Nephrol, 2006,17(6):1503-1520.
Analysis of risk factor of acute kidney injury in early stage after aortic dissection surgery
WANG Zhao, GAO Chang-qing, XIAO Cang-song, GONG Zhi-yun
Department of Cardiovascular Surgery, Institute of Cardiac Surgery of People's Liberation Army, Chinese PLA General Hospital, Beijing 100853, China
GAO Chang-qing. Email:gaochq301@yahoo.com
ObjectiveTo explore the risk factors of acute kidney injury in early stage after aortic dissection surgery.MethodsClinical data of 104 patients who underwent aortic dissection surgery admitted to our hospital from January 2006 to June 2013 were retrospectively analyzed. The patients were divided into two groups (AKI group and Non-AKI group) according to the KDIGO defnition criteria and perioperative variables were analyzed in both groups. The risk factors of acute kidney injury were evaluated by multivariate logistic regression analysis.ResultsAKI occurred in 78 patients (75.0%) within early 48 hours postoperatively, 12 patients (11.5%) received renal replacement therapy and 5 patients (4.8%) died in hospital. The logistic regression analysis revealed that hypertension, cardiopulmonary bypass time and deep hypothermic circulatory arrest time over 40 minutes were the independent risk factors of acute kidney injury in early stage after aortic dissection surgery.ConclusionAKI is a very common complication after aortic dissection surgery. Hypertension, cardiopulmonary bypass time and deep hypothermic circulatory arrest time over 40 minutes are the independent risk factor of acute kidney injury in early stage after aortic dissection surgery.
aortic dissection; acute kidney injury; deep hypothermic circulatory arrest; risk factors
R 654.2
A
2095-5227(2014)07-0692-04
10.3969/j.issn.2095-5227.2014.07.013
时间:2014-03-21 15:38
http://www.cnki.net/kcms/detail/11.3275.R.20140321.1538.001.html
2014-02-19
王肇,男,在读硕士。研究方向:心血管外科。Email:sophmood@126.com
高长青,男,主任医师,教授,博士生导师。Email:gaochq301@yahoo.com

