过表达泛素偶联酶(UBE2C)对小鼠胚胎发育的影响
向云龙,张 亮,陈 卓
(河南师范大学 生命科学学院,河南 新乡453007)
泛素偶联酶2C(Ubiquitin- conjugating enzyme 2C,UBE2C) 能够优先对底物赖氨酸进行多聚泛素化,特异性降解有丝分裂过程中细胞周期蛋白等短周期蛋白从而使细胞退出分裂期,起到调控有丝分裂检验点以及控制细胞周期进程的作用[1]。同时,在临床肿瘤病例以及癌细胞系中,均在染色体上发现UBE2C 多拷贝以及表达上调,提示UBE2C可以在一定程度上作为肿瘤标记分子[2,3]。研究表明,在细胞系中过表达UBE2C 导致细胞忽略有丝分裂纺锤体检验点,失去基因组稳定性从而导致肿瘤发生[4]。但UBE2C在小鼠早期胚胎中的作用尚未见报道。
小鼠以及其他哺乳动物卵母细胞在发育过程中会逐渐积累mRNA、蛋白质等母源物质,从而达到卵母细胞成熟[5]。这些母源物质对随后的受精以及胚胎发育过程至关重要。尽管母源蛋白在卵母细胞向受精卵转变后,通过泛素化[6,7]或者巨自噬途径[8]开始逐渐降解,但部分母源物质仍然需要维持一定时间,以渡过合子基因组激活前转录的空隙期[9]。如果母源物质过早缺失则会严重影响早期胚胎的发育,导致一系列的发育迟缓甚至发育停滞[10]。
既往研究证明,UBE2C 能够靶向降解多种蛋白,参与诸如细胞周期进程、抗原递呈、转录和细胞凋亡等[11,12]细胞活动。本试验通过在受精卵时期过表达UBE2C,观察随后胚胎发育进程,从而初步探索UBE2C 在小鼠早期胚胎发育过程中的影响。
1 材料与方法
1.1 材料与试剂
ICR 小鼠(北京维通利华公司) ; 促性腺激素(宁波第二激素厂) ; 载体(Clontech) 、内切酶、RT- PCR 试剂(日本TAKARA 公司) ; 鼠抗GAPDH 和UBE2C 抗体(台湾Abnova 公司) ; 反转录酶(美国Promega 公司) ; 转录、纯化试剂盒(德国QIAGEN 公司) ; ECL 底物发光试剂盒(英国Pierce 公司) ; 其他试剂除特别说明外均购自美国Sigma 公司。
1.2 溶液配制
KSOM 培养液配制: 95 mmol/L NaCl,2.5 mmol/L KCl,0.35 mmol/L KH2PO4,0.2 mmol/L MgSO4·7H2O,0.2 mmol/L 葡萄糖,10 mmol/L 乳酸钠,25 mmol/L NaHCO3, 0.2 mmol/L丙酮酸钠,1.71 mmol/L CaCl2·2H2O,0.01 mmol/L EDTA,1 mmol/L L-谷氨酰胺,BSA 1 g/L,酚红0.001 g/L,青、链霉素。
蛋白裂解液配制: 50 mmol/L Tris-HCl(pH 7.5) ,150 mmol/L NaCl,1%脱氧胆酸钠,1% Triton X- 100,0.1% SDS,5 mmol/L EDTA,1 mmol/L Na3VO4,5 ~10 mmol/L NaF。
1.3 方法
1.3.1 小鼠卵母细胞及胚胎获取
ICR 雌性小鼠于下午注射孕马血清促性腺激素(PMSG) ,48 h 后注射人绒毛膜促性腺激素(hCG) 后合笼,次日检查阴道栓。颈椎脱臼处死小鼠,打开腹腔,按超排及见栓时间分别获取卵巢、输卵管、子宫置于PBS中,收集卵母细胞及胚胎。
1.3.2 mRNA 提取以及RT-PCR
使用微量mRNA 磁珠提取试剂盒提取mRNA。预制磁珠,加入100 μL裂解液将样品完全溶解,之后加入20 μL 预制的磁珠,室温混匀5 min; 置于磁铁上去除悬液,加100 μL洗涤液A,重悬洗涤2 次; 去悬液后加100 μL洗涤液B,转移至新离心管,洗涤2 次; 使用13 μL去RNA 酶的水重悬,保持置于冰上。加入预制反转录体系,37 ℃反转录15 min,85 ℃、5 s灭活反转录酶,备用。
1.3.3 免疫印记
加入蛋白裂解液裂解细胞,离心后测定蛋白浓度,取20 μg组织总蛋白(卵母细胞及胚胎则分别各取100 个) 上样; 120 V 电泳2 h至结束,之后转移至PVDF 膜上,5%脱脂牛奶室温封闭1 h; 一抗1 ∶1 000 稀释,4 ℃过夜孵育; 次日PBST 洗涤3 次,每次5 min; 随后二抗室温孵育1 h,洗涤3 次后使用化学发光试剂盒显色、曝光。
1.3.4 细胞免疫荧光化学
收集卵母细胞和胚胎,4%多聚甲醛固定1 h,PBS 洗涤3 次后置于0.1% Triton X-100 中打孔1 h; PBS 洗涤3 次,5%驴血清室温封闭1 h 后,1∶100 加入UBE2C 抗体4 ℃孵育过夜; 洗涤3 次,每次5 min,二抗1∶200 稀释,室温孵育1 h 后,再次洗涤3次后置于PBS 稀释的染料(Hoechst,2 μg/mL) 中染核10 min,压片备用。
1.3.5 UBE2C 过表达载体构建
通过两步法构建UBE2C 和绿色荧光蛋白独立表达的体外转录载体。以卵巢cDNA为模板,用高保真DNA 聚合酶扩增全长的Ube2c ORF 序列,经过EcorI 和BamHI 双酶切后插入到真核表达载体Pirse2- Zsgreen1中。构建成功的质粒,测序正确后,通过PCR 将ube2c- IRES- GFP 序列扩增,经EcorI 和AscIS 双酶切连接到可以体外转录的经改造后的Pcs2(+)-myc 载体中。阳性克隆测序。正确的克隆线性化后备用。
1.3.6 mRNA 转录及显微注射
使用 mMESSAGE mMACHZNE kit(Ambion) 转录UBE2C- eGFP mRNA,使用RNeasy MinElute Cleamup Kit(QiaGen) 纯化回收。分别制备固定针外径约80 μm、内径20 μm,注射针外径小于1 μm。单个受精卵注射约5 pL mRNA,之后置于KOSM 培养液中培养。
2 结果
2.1 UBE2C 在小鼠组织中的mRNA 与蛋白表达
如图1 所示,UBE2C 的mRNA 以及蛋白水平在小鼠脾脏组织中的表达最高,在子宫以及卵巢中呈现较高的表达水平。在脑、肌肉、心脏等器官均无明显表达。提示UBE2C 在小鼠脾脏以及雌性生殖系统中具有重要作用。
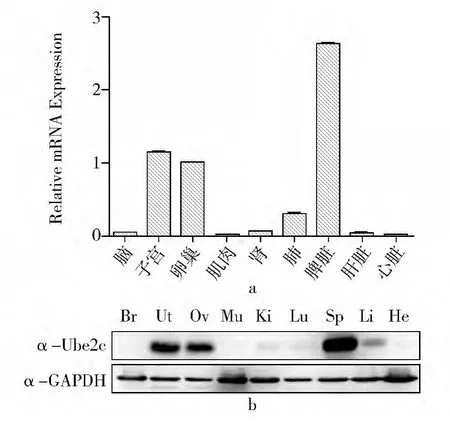
图1 UBE2C 在小鼠组织中的表达模式a,RT-PCR 显示mRNA 表达水平b,UBE2C 在组织中的蛋白表达水平
2.2 UBE2C 在小鼠卵母细胞以及早期胚胎中的表达图谱
以前的研究表明,卵母细胞在成熟过程中不断积累母源物质,这些母源物质在随后的受精、卵裂中具有重要作用。母源RNA以及蛋白质在卵母细胞向合子转变过程中被逐渐降解。UBE2C 作为一种泛素偶联酶,能够降解一些短周期底物蛋白。其在小鼠卵巢中也呈现较高的表达水平,通过RT- PCR以及免疫荧光分析UBE2C 从小鼠卵母细胞到囊胚的发育过程,如图2a 所示,其mRNA与蛋白质表达水平在受精之后均呈现逐渐上升,在桑椹胚时到达最高,随后在囊胚时期下降到较低水平(图2) 。提示UBE2C 可能具有降解母源物质的作用,从而促进小鼠早期胚胎发育进程顺利进行。

图2 UBE2C 在卵母细胞以及早期胚胎中的表达
2.3 过表达UBE2C 导致2-细胞发育阻滞
构建UBE2C-EGFP 过表达载体,体外转录纯化RNA 后,注射入受精卵中并置于KSOM 培养液中培养48 h,之后检测绿色荧光蛋白表达来选取过表达UBE2C 的胚胎。如图3 结果表明,与注射去离子水的对照组相比,过表达UBE2C 后所有胚胎均停滞在2-3细胞,对照组均达到桑椹胚时期。提示卵母细胞在注射入UBE2C 后可能发挥了泛素化E2 酶的功能,对包含母源蛋白在内的一些蛋白进行降解,从而引起胚胎卵裂、合子基因组启动障碍,导致早期胚胎发育停滞。

图3 受精卵过表达UBE2C 并培养2 d 后导致2-细胞发育阻滞
3 讨论
由于在临床肿瘤以及癌细胞系中,均能检测到UBE2C 的显著异常升高[13],提示着UBE2C 可能与癌变以及细胞恶性转化相关。Okamoto Y,Pallantep 等 人[14]相继证明,UBE2C 的高表达加快细胞生长速率,促进增殖,使得UBE2C 在体细胞的细胞周期调控以及癌症相关作用取得了更多的关注。但对其在胚胎中的功能却知之甚少。受精卵作为一种全能性细胞,UBE2C 在其卵裂过程中发挥了什么样的功能仍然未知。通过构建UBE2C 过表达载体,之后体外转录mRNA并注射入胚胎中,我们发现过表达UBE2C能导致胚胎发生2-3 细胞阻滞,提示其在胚胎中的功能与癌细胞系中不尽相同。既往研究表明,早期胚胎发育需要多种母源蛋白的参与,这些母源物质在随后的卵裂、去甲基化、合子基因组激活等过程中具有重要作用,过早的缺失母源物质均能导致胚胎阻滞在2-细胞到囊胚期间的多种时期。
以上结果表明,在小鼠早期胚胎发育过程中,UBE2C 可能通过降解卵母细胞储存的母源物质,从而确保小鼠胚胎正常发育。但其在胚胎中对细胞周期的调控作用以及是否影响染色体整倍性仍需要进一步研究。
[1]Zhonglin Hao,Hui Zhang,John Cowell.Ubiquitin-conjugating enzyme UBE2C: molecular biology role in tumorigenesis,and potential as a biomarker [J].Tumor Biol,2012,33: 723-730.
[2]Okamoto Y,Ozaki T,Miyazaki K,et al.UbcH10 is the cancer related E2 ubiquitin- conjugating enzyme[J].Cancer Res,2003,63(14) : 4167-4173.
[3]Wagner KW,Sapinoso LM,El- R,et al.Overexpression,genomic amplification and therapeutic potential of inhibiting the UbcH10 ubiquitin conjugase in human carcinomas of diverse anatomic origin [J].Oncogene,2004,23(39) : 6621-6629.
[4]Van Ree JH,Jeganathan KB,Malureanu L,et al.Overexpression of the E2 ubiquitin-conjugating enzyme UbcH10 causes chromosome missegregation and tumor formation [J].J Cell Biol,2010,188(1) : 83-100.
[5]De Leon V,Johnson A,Bachvarova R.Half- lives and relative amounts of stored and polysomal ribosomes and poly(A) + RNA in mouse oocytes [J].Dev Biol,1983,98: 400-408.
[6]Suzumori N,Burns K H,Yan W,et al.RFPL4 interacts with oocyte proteins of the ubiquitin- proteasome degradation pathway [J].Proc Natl Acad Sci USA,2003,100: 550-555.
[7]Roest H P,Baarends W M,Grootegoed J A,et al.The ubiquitin-conjugating DNA repair enzyme HR6A is a maternal factor essential for early embryonic development in mice [J].Mol Cell Biol,2004,24: 5485-5495.
[8]Xie Z,Klionsky DJ.Autophagosome formation: core machinery and adaptations [J].Nat Cell Biol,2007,9: 1102-1109.
[9]Alizadeh Z,Kageyama S,Aoki F.Degradation of maternal mRNA in mouse embryos: selective degradation of specific mRNAs after fertilization [J].Mol Reprod Dev,2005,72: 281-290.
[10]Lei Li,Ping Zheng,Jurrien Dean.Maternal control of early mouse development [J].Development.2010,137: 859-870.
[11]Jesenberger V,Jentsch S.Deadly encounter: ubiquitin meets apoptosis [J].Nat Rev Mol Cell Biol,2002,3(2) : 112-21.
[12]Williamson A,Wickliffe K E,Mellone B G,et al.Identification of a physiological E2 module for the human anaphase- promoting complex [J].Proc Natl Acad Sci USA,2009,106: 18213-8.
[13]Okamoto Y,Ozaki T,Miyzaki K,et al.UbeH10 is the cancer-related E2 ubiquitin-conjugating enzyme[J].Cancer Res,2003,63(14) : 4167-4173.
[14]Pallante P,Berlingieri MT,Troncone G,et al.UbcH10 overexpression may represent a marker of anaplastic thyroid carcinomas [J].Br J Cancer,2005,93(4) : 464.

