膀胱尿路上皮癌中CXCL1、CXCR2的表达及临床意义
翟晓利 章艳斐 施红旗 楼善贤
(金华市中心医院,浙江金华 321000)
膀胱尿路上皮癌中CXCL1、CXCR2的表达及临床意义
翟晓利 章艳斐 施红旗 楼善贤
(金华市中心医院,浙江金华 321000)
目的探讨膀胱尿路上皮癌中CXCL1及其受体CXCR2蛋白的表达与膀胱尿路上皮癌患者各临床病理因素之间的关系。方法采用免疫组织化学EnVision法检测90例膀胱尿路上皮癌和20例癌旁正常膀胱黏膜中CXCL1、CXCR2的表达情况。结果在膀胱尿路上皮癌组织中CXCL1、CXCR2蛋白的表达阳性率分别为65.6%、31.1%,显著高于癌旁正常膀胱黏膜组织,差异有统计学意义(P<0.01);与肿瘤分化程度,临床病理分期以及复发有关(P<0.01)。癌组织中CXCL1的表达与CXCR2呈正相关(r=0.487,P<0.05)。生存曲线显示,CXCL1阴性组的3、5、10年的生存率分别明显高于CXCL1阳性组的3、5、10年生存率(P=0.006)。结论CXCL1和CXCR2在膀胱尿路上皮癌中的高表达与肿瘤的临床分期及复发有关。检测CXCL1在膀胱尿路上皮癌中的表达对患者预后评估可提供帮助。
膀胱尿路上皮癌;CXCL1;CXCR2;免疫组织化学
膀胱癌是泌尿系统最常见的恶性肿瘤,大约50%的患者前来就诊时已属中晚期,常形成复发和转移。趋化因子CXCL1(CXC ligand1),即CXC的配体1,属于趋化因子CXC家族的重要成员,在大肠癌、胃癌、皮肤恶性黑色素瘤和乳腺癌等多种肿瘤中呈异常表达[1-3],但在膀胱癌中的表达情况鲜有报道。本组检测了90例膀胱尿路上皮癌中CXCL1及其受体CXCR2的表达情况,旨在探讨其表达在膀胱癌发生、发展、转移中的意义。
1 资料与方法
1.1 一般资料 收集浙江省金华市中心医院2005年1月~2007年1月存档膀胱尿路上皮癌病例组织石蜡包埋标本90例(所有病例均经病理学证实为膀胱尿路上皮癌,且术前均未行放、化疗)和癌旁正常膀胱黏膜组织标本20例,所有病例均有完整的临床及病理资料,每例随访至今,生存时间为3~120个月,根据Kaplan-Meier生存曲线法计算患者的中位生存期为44.8个月。其中男60例,女30例。年龄49~78岁,平均(64.5±3.9)岁,≥60岁47例,<60岁43例。根据WHO(2004版)尿路上皮肿瘤组织学分类,低级别尿路上皮癌18例,高级别尿路上皮癌72例。根据2002版国际抗癌联盟(UICC)的TNM临床分期标准进行分期,其中T1~T2期52例,T3~T4期38例。90例膀胱癌患者中,无复发者50例,有复发者40例;单发肿瘤77例,多发肿瘤13例。按肿瘤大小,<3.0cm者56例,≥3.0cm者34例。对照组为癌旁正常膀胱黏膜组织20例,取自距离行膀胱切除术标本边上3.0~5.0cm的膀胱黏膜组织,病理HE染色证实为正常膀胱黏膜组织。
1.2 方法 鼠抗人CXCL1单克隆抗体及CXCR2抗体购自北京中杉生物技术有限公司,EnVision试剂盒以及DAB显色试剂盒均购自福州迈新生物技术开发公司。采用免疫组织化学EnVision法。石蜡包埋的组织4微米连续切片;二甲苯脱蜡,乙醇梯度水化;3%过氧化物消除内源性过氧化物酶;EDTA修复;正常羊血清室温下封闭;加入即用型一抗(鼠抗人CXCL1单克隆抗体及CXCR2抗体)4℃冰箱过夜;PBS清洗,加入二抗温育0.5小时,冲洗后DAB显色,苏木精对比染色,中性树胶封片。采用已知阳性片作对照,以PBS液代替一抗作空白对照。
1.3 结果判定 CXCL1及CXCR2均以细胞膜和细胞浆出现棕黄色颗粒为阳性。参照Miyake等[4]报道的文献资料,采取二次计分法:每例标本随机计数10个高倍视野(×400),计数每个高倍视野中阳性细胞所占百分比并计分。首先将染色强度计分:0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色。再将阳性细胞百分比计分,0分为阴性,1分为阳性细胞1%~40%,2分为41%~75%,3分为76%~100%。用染色强度得分和细胞数得分的乘积作为判断标准,若积分≤1为阴性,>1为阳性。免疫组化结果由两位病理医生采用独立双盲法判定。
1.4 统计学处理 采用SPSS17.0统计软件进行数据分析。在膀胱尿路上皮癌组织中CXCL1及CXCR2的表达与各临床病理因素的关系以及两个指标之间的相关性采用χ2和Pearson线性相关分析。
2 结 果
2.1 膀胱尿路上皮癌中CXCL1的表达与各临床病理指标的关系 CXCL1蛋白主要定位于尿路上皮癌癌细胞的胞膜和胞浆,为黄色或棕黄色颗粒。在尿路上皮癌中,CXCL1的阳性率为65.6%(59/90),对照组癌旁正常膀胱黏膜组织中未见CXCL1的表达,两组阳性率比较差异有统计学意义(χ2=28.28,P<0.01)。CXCL1的表达与患者的性别、年龄、肿块数目等因素无关(P>0.05);随着CXCL1的表达程度的增高,癌组织的分化越差、临床分期越晚、更易出现复发(P<0.01),见表1。CXCL1阴性组中位生存期为62.3个月,其中9例死亡,3、5、10年生存率为88.3%、78.8%、71.0%;CXCL1阳性组中位生存期为35.6个月,其中38例死亡,3、5、10年生存率为61.9%、47.1%、35.2%,两组间比较差异有统计学意义(P=0.006),生存曲线见图1,显示CXCL1阴性组预后好于CXCL1阳性组。
2.2 膀胱尿路上皮癌中CXCR2表达与各临床病理指标的关系 在尿路上皮癌中,CXCR2的阳性率为31.1%(28/90),对照组癌旁正常膀胱黏膜组织中未见CXCR2的表达,两组阳性率比较差异有统计学意义(χ2=8.35,P<0.01)。CXCR2的阳性率与膀胱尿路上皮癌患者的性别、年龄、肿块数目及大小之间差异均无统计学意义(P>0.05)。随着癌组织的分化程度的降低,CXCR2的阳性率升高,差异有显著性(P<0.01);出现复发的病例组中CXCR2的阳性率为57.5%(23/40),无复发的病例组中,CXCR2的阳性率仅为10.0%(5/50),两组比较差异有统计学意义(P<0.01)。pTNM分期T1~T2期CXCR2阳性率为0%(0/52),T3~T4期CXCR2阳性率为73.7%(28/38),CXCR2阳性患者pTNM分期更晚(P<0.01,表1)。CXCR2阴性组中位生存期为59个月,其中45例死亡,3、5、10年生存率为78.0%、45.9%、27.0%;CXCR2阳性组中位生存期为46个月,其中19例死亡,3、5、10年生存率为70.9%、42.1%、29.3%,两组间比较差异无统计学意义(P=0.096),生存曲线见图2,显示CXCR2的表达与预后关系不明显。
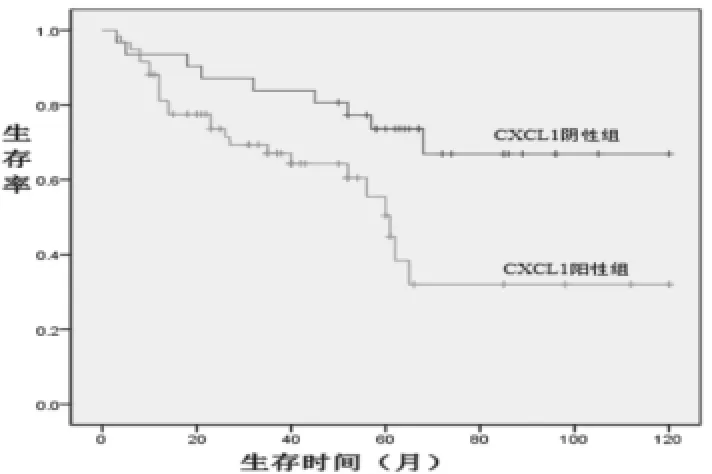
图1 膀胱尿路上皮癌CXCL1阴性组和CXCL1阳性组生存曲线的比较
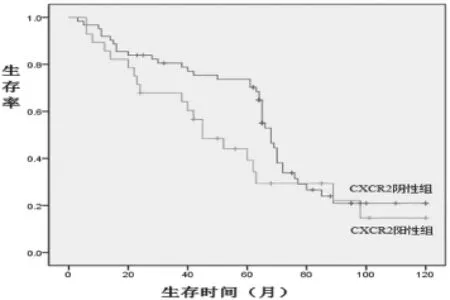
图2 膀胱尿路上皮癌CXCR2阴性组和CXCR2阳性组生存曲线的比较
2.3 膀胱尿路上皮癌中CXCL1与CXCR2的表达之间的关系 Pearson相关分析显示,膀胱尿路上皮癌组织中CXCL1与CXCR2的表达呈正相关(r=0.487,P<0.05)。
3 讨 论
CXCL1即趋因子生长调节基因1,属于趋化因子CXC家族[5-7]。CXCL1在巨噬细胞、中性粒细胞和上皮细胞中表达,并呈现中性粒细胞趋化活性,CXCR2是CXCL1的趋化因子受体,与CXCL1结合后表现出趋化作用[2],研究表明CXCL1及其受体CXCR2可能参与多种肿瘤细胞的发生和转移等一系列事件,文献报道[1-4]CXCL1的持续表达可促进黑色素瘤的形成;以CXCL1基因转染鳞癌细胞后发现转染后癌细胞生长和转移能力均增强;在乳腺癌、卵巢癌、腺泡性横纹肌肉瘤中也均高表达CXCL1及CXCR2。
Kawanishi等[8]检测了67例膀胱尿路上皮癌中CXCL1的表达水平,显示CXCL1是膀胱癌有无浸润的独立影响因子。本组90例膀胱尿路上皮癌中,CXCL1的阳性率为65.6%(59/90),并且在分化差、临床分期晚、有复发的病例中,其表达程度明显高于分化好、临床分期早、无复发的病例,并有统计学意义,这些结果与相关文献[3-4]报道基本一致。进一步的分析显示,膀胱尿路上皮癌组织中CXCL1与CXCR2的表达呈正相关性(r=0.487,P<0.05),且在低分化肿瘤及临床T2、T3期患者更进一步高表达,提示CXCL1-CXCR2途径可能介导了膀胱癌的发生、发展及转移,如进一步研究针对CXCL1-CXCR2的靶向治疗,可进一步增强疗效,减少毒副作用。本组研究显示,CXCL1阴性组中位生存期为64.7个月,其中3例死亡,3、5、10年生存率分别为92.3%、92.3%、72.8%;CXCL1阳性组中位生存期为26.1个月,其中9例死亡,3、5、10年生存率分别为58.9%、47.1%、35.3%,两组间比较差异有统计学意义(P=0.006),显示CXCL1阴性组预后好于CXCL1阳性组。提示CXCL1的阳性表达与患者预后相关,可作为其预后的预测指标。
近年来,研究人员围绕肿瘤血管形成进行了大量的试验研究,相继发现了血管内皮生长因子等一系列的肿瘤血管生成促进因子及相关受体,其中CXC趋化因子及受体更是近年抗肿瘤相关研究的热点之一。研究表明[2],阻断CXCR2可以引起肿瘤组织的坏死,阻断CXCR2的小鼠模型,肿瘤相关的新血管生成以及肿瘤的转移均得到了明显的抑制,而近年来有关抑制肿瘤血管生成的靶向治疗已成为热点。本组结果表明,膀胱癌组织中CXCL1及CXCR2均高表达,揭示了CXCL1及CXCR2与膀胱癌生长、恶性程度、预后及临床病理特征的关系,为进一步阐明CXCL1及CXCR2的致病机制,研究基因或药物干预的作用奠定了基础。
[1]Verbeke H,Geboes K,Van Damme J,et al.The role of CXC chemokines in the transition of chronic inflammation to esophageal and gastric cancer.Biochim Biophys Acta,2012,1825(1):117
[2]Verbeke H,Struyf S,Laureys G,et al.The expression and role of CXC chemokines in colorectal cancer.Cytokine Growth Factor Rev,2011,22(5-6):345
[3]Lerebours F,Vacher S,Andrieu C,et al.NF-kappa B genes have a major role in inflammatory breast cancer.BMC Cancer,2008,8:41
[4]Miyake M,Lawton A,Goodison S,et al.Chemokine(C-X-C)ligand 1(CXCL1)protein expression is increased in aggressive bladder cancers.BMC Cancer,2013,13:322
[5]张玮,黄宁,王琪,等.黑色素瘤生长趋化因子1对卵巢癌细胞生物学功能的影响.中华肿瘤杂志,2013,35(2):109
[6]黄宁,王琪,张玮,等.卵巢肿瘤组织CXCLl基因表达与临床病理的相关性探讨.中华肿瘤防治杂志,2011,18(1):85
[7]Booth CM.Optimizing care and outcomes of patients with muscle-invasive bladder cancer.Can Urol Assoc J,2013,7(9-10):E625
[8]Kawanishi H,Matsui Y,Ito M,et al.Secreted CXCL1 is a potential mediator and marker of the tumor invasion of bladder cancer.Clin Cancer Res,2008,14(9):2579

