卵巢无性细胞瘤7例临床病理观察
周荣璟 徐如君
卵巢无性细胞瘤7例临床病理观察
周荣璟徐如君
【摘要】目的探讨卵巢无性细胞瘤的临床病理特征、诊断及鉴别诊断。 方法回顾性分析7例卵巢无性细胞瘤的临床病理资料。 结果7例患者最常见的腹部症状及体征为腹部包块(6例,85.71%),腹水(5例,71.43%),腹痛(2例,28.57%)。实验室检查LDH升高4例,NSE升高4例,β-HCG升高2例,CA125升高2例,AFP升高1例;7例均为手术切除标本,均行术中冰冻切片检查,镜下表现为瘤细胞为大小一致的圆形、多角形细胞组成,胞质丰富淡染,瘤细胞排列成条索状、巢状、岛屿状,其间均可见纤维组织间隔分隔,间隔内见多少不一淋巴细胞浸润。免疫组化示肿瘤细胞PLAP、CD117、OCT4、NSE呈不同程度阳性。 结论卵巢无性细胞瘤是一种少见的恶性生殖细胞肿瘤,其临床表现无特异性,易误诊,需结合临床表现及实验室检查,确诊需依赖病理学检查及免疫组化。该病多见于年轻女性,尤其对于需保留生殖功能的女性,术中冰冻检查的形态学鉴别诊断尤为重要。
【关键词】无性细胞瘤卵巢临床病理学
无性细胞瘤属于卵巢的恶性生殖细胞肿瘤,占卵巢肿瘤的0.7%~3.7%[1],多见于年轻女性,临床表现无特异性,易延误诊断。为提高对该病的认识,本文回顾性分析了7例卵巢无性细胞瘤的临床病理资料,探讨其诊断与鉴别诊断,现报道如下。
1 资料和方法
1.1一般资料2008-01—2012-12收住杭州市肿瘤医院的无性细胞瘤患者7例,年龄14~27岁,平均(20.43±4.09)岁;已婚2例,未婚5例。7例患者中,出现腹部包块6例(85.71%),腹水5例(71.43%),尿频3例(42.86%),腹痛 2例(28.57%),恶心、纳差 2例(28.57%),胸水1例(14.29%),胸闷、气急 1例(14.29%)。实验室检查乳酸脱氢酶(LDH)升高4例,神经元特异性烯醇化酶(NSE)升高4例,血清绒毛膜促性腺激素(β-HCG)升高2例,CA125升高2例,AFP升高1例。
1.2方法所有患者均行手术切除,标本经4%中性甲醛溶液固定,取材,常规脱水,石蜡包埋,切片经HE染色制片,光镜观察。免疫组化一抗选用PLAP(胎盘碱性磷酸酶)、CD117、OCT4、NSE、β-HCG、AFP、CK、EMA、ainhibin、CD30和Ki-67,采用EnVision法染色。所有试剂均为即用型,购自福州迈新生物技术开发有限公司。用PBS代替一抗作阴性对照,操作步骤严格按照说明书进行。
2 结果
2.1巨检肿瘤最大者22cm×13cm×13cm,最小者10cm×8cm×7cm;发生在左侧2例,右侧5例;7例切面均为灰白,实性鱼肉样,其中5例表面光滑,被膜完整,另2例突破卵巢被膜,肿瘤浸润输卵管伞端,并累犯盆底及直肠表面。
2.2镜检镜下可见肿瘤细胞呈条索状、巢状2例(图1),岛屿状4例,均可见纤维组织间隔分隔,间隔内见多少不一淋巴细胞浸润,1例术前行紫杉醇与顺铂联合化疗方案(TP)化疗后,瘤细胞由大小混合的多角形细胞组成,呈散在排列,间质大量淋巴细胞浸润,无纤维间隔(图2);瘤细胞核形态一致,胞质丰富,细胞边界清楚,核圆居中,核仁明显,核分裂像多少不等;2例伴有坏死,1例瘤细胞巢边缘可见增生的卵泡。
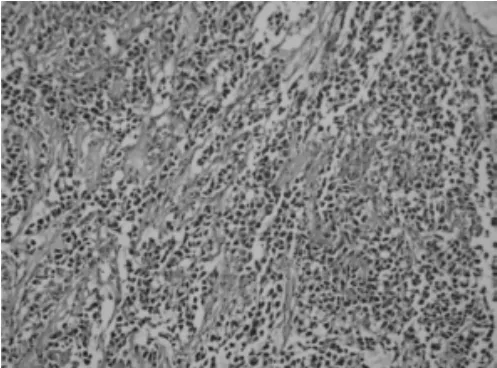
图1 肿瘤细胞呈条索状、巢状排列,其间可见纤维组织间隔分隔,间隔内见少量淋巴细胞浸润;瘤细胞核形态一致,核圆居中(HE染色,×200)

图2 经TP方案化疗后无性细胞瘤,瘤细胞由大小混合的多角形细胞组成,呈散在排列,间质大量淋巴细胞浸润,无纤维间隔(HE染色,×200)
2.3免疫组化7例标本的肿瘤细胞PLAP均阳性(7/ 7)、CD117(图3、4)均阳性(7/7)、OCT4(图5、6)均阳性(7/7),其中6例NSE阳性(6/7);Ki-67增殖指数为20%~40%,局灶CK阳性有2例(2/7),a-inhibin 1例局部阳性(1/7),β-HCG 1例局灶阳性(1/7);7例标记AFP、EMA、CD30均呈阴性表达。
3 讨论
卵巢无性细胞瘤是一种由原始生殖细胞异常增生而形成的恶性肿瘤,多见于10~30岁的年轻女性,平均年龄20岁[2],属于非普查对象,早期诊断较为困难。本病的最常见的首发症状为腹痛、腹胀或发现腹部包块,部分伴阴道流血或原发性闭经等,少数合并性腺发育不良。其生长快,约2/3患者局限于一侧卵巢[3]。本资料中腹部症状、体征为腹部包块6例,腹水5例,腹痛2例,左侧2例,右侧5例,与文献报道一致[4],以单侧为主,好发于右侧,可能与右侧性腺发育分化、发育比左侧慢有关[5]。肿瘤多为圆形或椭圆形,常保持卵巢原形,直径3~ 50cm,质如软橡皮样,切面为实性鱼肉样,有不同程度的出血、坏死或囊性变,常有完整的被膜,晚期可突破被膜,本资料有2例突破卵巢被膜并累及盆底及直肠表面。镜下可见瘤细胞弥漫分布并被纤维间隔分隔成松散的巢、索和片状,并常伴明显的淋巴细胞浸润。瘤细胞胞浆丰富,核大中位,核仁大而嗜酸,核分裂多少不等。少数可合并存在内胚窦瘤、未成熟畸胎瘤、胚胎性癌、绒癌以及性腺母细胞瘤等其他类型生殖细胞肿瘤成分[6]。本资料中肿瘤细胞呈条索状、巢状2例,岛屿状4例,1例术前行TP方案化疗后,瘤细胞由大小混合的多角形细胞组成,呈散在排列;2例伴有坏死,1例瘤细胞巢边缘可见增生的卵泡,易误诊为合并性腺母细胞瘤。本组患者均经充分取材未见合并其他生殖细胞肿瘤成分。
本病临床症状无特异,在病理诊断过程中,应结合实验室指标,β-HCG、AFP、LDH、NSE、CA125等的检测,生殖细胞肿瘤患者可伴有血清β-HCG升高,提示具有两种细胞的克隆,一种是合胞体滋养层,如绒毛膜上皮癌等,另一种是合体滋养层巨细胞,常见于精原细胞瘤或无性细胞瘤,β-HCG无特异性,本资料中有2例升高。生殖细胞肿瘤患者血清AFP常升高,对无性细胞瘤亦无特异性。而LDH是一种与各种实体肿瘤生长与消退相关的糖分解酶,其升高具有辅助诊断价值,本资料中升高4例,可能与病例少有关。本资料中血清NSE升高4例,NSE抗体阳性表达率85.71%,赵玲玲等[7]报道其阳性率为70.09%,认为NSE抗体研究可作为无性细胞瘤的组织学诊断,而血清NSE水平测定可能有助于监测无性细胞瘤的临床过程及临床诊断。测定CA125对卵巢恶性肿瘤具有辅助诊断价值,特别是卵巢上皮癌,而对卵巢无性细胞瘤无特异性[8]。

图3 无性细胞瘤中CD117阳性表达,定位于细胞膜(EnVision法,×400)
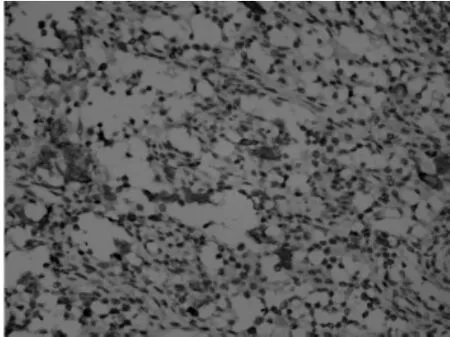
图4 经TP方案化疗后无性细胞瘤CD117阳性表达,定位于细胞质(EnVision法,×200)

图5 无性细胞瘤中OCT4阳性表达,定位于细胞核(EnVision法,×200)
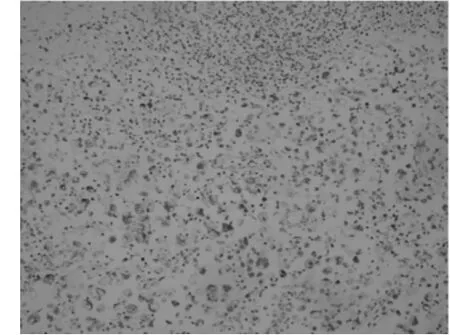
图6 经TP方案化疗后无性细胞瘤OCT4阳性表达,定位于细胞核(EnVision法,×200)
免疫组化在无性细胞瘤的诊断中有很大帮助,卢金镶等[9]报道PLAP表达率为97.37%,本资料中其表达率为100%,与赵玲玲等[7]报道一致,提示PLAP可作为卵巢无性细胞瘤的重要标记物。田冰等[10]认为CD117是卵巢无性细胞瘤很好的标记,卵巢生殖细胞肿瘤若有CD117阳性表达,尤其是典型的细胞膜上的阳性表达应考虑其含有无性细胞瘤成分,反之如果卵巢生殖细胞肿瘤中CD117无表达则非无性细胞瘤可能性大,本资料7例患者CD117均为阳性,与田冰等[10]报道一致,6例定位于细胞膜,1例经TP方案化疗后定位于细胞质,其中的意义有待积累更多病例进一步研究。本资料中OCT4表达率为100%,与Looijenga等[11-12]研究结果一致,有文献认为OCT4是无性细胞瘤的一个特异度和敏感度均较高的标记物[13-14];而CD30均未见表达,与滕梁红等[13]报道一致。
卵巢无性细胞瘤在冰冻诊断中形态学鉴别尤为重要,首先与胚胎性癌鉴别,胚胎性癌细胞形态不同,间质散在淋巴细胞无肉芽肿,瘤细胞中等至大、多边形、胞界不清,它们经常形成合胞体细胞团块伴有中心坏死,合体滋养层细胞样巨细胞常见,核居中、多形性、含一个或多个大的核仁,核分裂常见,大约2/3患者有激素影响症状,血清β-HCG水平通常升高;而无性细胞瘤细胞形态及结构一致,间质内有淋巴细胞及肉芽肿,合体滋养层细胞样巨细胞少见。其次是卵巢恶性淋巴瘤,其最常见于年龄较大的女性,多累及双侧卵巢,由形态不同的淋巴瘤细胞弥漫分布形成,缺乏纤维间隙,细胞核经常出现卷曲;而无性细胞瘤之小细胞型由小圆形细胞组成,间质中有淋巴细胞浸润;前者多见于中年以上女性,后者多见于年轻女性。本组病例中1例术前行TP方案化疗肿瘤细胞仅见少量大细胞呈团或散大分布,间质大量小淋巴细胞浸润,酷似霍奇金淋巴瘤,因此术中冰冻检查对病史及临床治疗情况的了解同样很重要。卵巢性腺母细胞瘤最常见于10~30岁年轻女性,大多具有闭经或早期发生的继发性闭经,这种肿瘤在1/3以上病例为双侧,单侧病例显示右侧稍居多,镜下一般出现大量界限完好的细胞巢,每个巢由厚的基底膜包被且包埋于纤维结缔组织中,可见大生殖细胞,伴有支持或颗粒样细胞,排列呈滤泡状,腺腔内有嗜酸性透明物质及钙化灶;而无性细胞瘤缺乏这些特征。卵巢透明细胞癌由透明细胞和鞋钉细胞组成,透明细胞胞质透明,易与无性细胞瘤之大细胞型混淆,注意鉴别。
综上所述,卵巢无性细胞瘤是一种少见的恶性生殖细胞肿瘤,其临床表现无特异性,易误诊,需结合临床表现及实验室检查,确诊需依赖病理学检查及免疫组化。该病多见于年轻女性,尤其对于需保留生殖功能的女性,术中冰冻检查的形态学鉴别诊断尤为重要。
4 参考文献
[1]范琅娣.卵巢临床与病理[M].天津:天津科学技术出版社,1993:251-256.
[2]曹泽毅.中华妇产科学[M].北京:人民卫生出版社,1999:1945.
[3]张惜阴.临床妇科肿瘤学[M].2版.上海:复旦大学出版社,2002:254.
[4] 戴莉萍,徐国萍.卵巢无性细胞瘤6例临床病理分析[J].中国医药导刊, 2010,12(3):382-383.
[5]刘复生,刘彤华.肿瘤病理学[M].北京:北京医科大学、中国协和医科大学联合出版社,1997:1562-1568.
[6]刘复生.中国肿瘤病理学分类[M].北京:科学技术文献出版社,2001:555.
[7]赵玲玲,赵涌,李圆圆,等.卵巢无性细胞瘤PLAP,NSE和WT1检测的临床病理意义[J].现代妇产科进展,2004,13(2):117-119.
[8]段萍,王华英.CA125检测对卵巢上皮癌的诊断及随访复发的价值[J].上海医科大学学报,2000,27(5):415-416.
[9]卢金镶,申培红,张全武.卵巢无性细胞瘤PLAP,NSE和PRL检测的临床意义[J].医药论坛杂志,2007,28(8):48-49.
[10]田冰,粟占三.卵巢无性细胞瘤CD117的表达及其鉴别诊断意义[J].医学临床研究,2008,25(10):1839-1840.
[11]Looijenga L H,Stoop H,de Leeuw H P,et al.Pou5f1(Oct3/4)identifies cells with pluripoteential in human germ cell tumors[J].Cancer Res,2003,63(9):2244-2250.
[12]Cheng L,Thomas A,Roth L M,et al.Oct4:a novel biomarker for dysgerminoma of the ovary[J].Am J Serg Pathol,2004,101(9): 1341-1346.
[13]滕梁红,卢德宏,徐庆中,等.OCT4、CD117、CD30在生殖细胞肿瘤中的表达及鉴别诊断意义[J].中华病理学杂志,2005,34(11):711-715.
[14]Hattab E M,Tu P H,Wilson J D,et al.OCT4 immunohistoo chemistry issuperiortoplacentalalkalinephosphatase(PLAP)in the diagnosis of central nervous systemgerminoma[J].AmJSurgPathol,2005,29 (3):368-371.
(本文编辑:沈昱平)
收稿日期:(2013-12-25)
作者单位:310002杭州市肿瘤医院病理科(周荣璟);杭州市第一人民医院病理科(徐如君)
Clinicopathology of ovarian dysgerminoma:a report of 7 cases
ZHOU Rongjing,XU Rujun.Department of Pathology,Hangzhou Cancer Hospital,Hangzhou 310002,China
【 Abstract】ObjectiveTo investigate the clinicopathologic features,diagnosis and differential diagnosis of ovarian dysgerminoma.MethodsThe clinicopathological data of 7 cases of ovarian dysgerminoma were retrospectively analyzed.Results The abdominal symptoms and signs included abdominal mass(n=6),ascites(n=5)and abdominal pain(n=2).The laboratory tests showed elevated serum lactate dehydrogenase(LDH),neuronspecific enolase(NSE),chorionic gonadotropin(β-HCG),carbohydrate antigen 125(CA125)and alpha fetoprotein(AFP)in 4,4,2,2 and 1 cases respectively.All the cases underwent surgical excision of the ovary and frozen sections were made.Microscopically,tumor cells were composed of uniform size circular,polygonal cells with rich and light-stain cytoplasm;tumor cells were ranged as cords,nests and islands and separated by fibrous belts which were thin and contained infiltrated lymphocytes.Immunohistochemistry showed different extent of positive stain of PLAP, CD117,OCT4 and NSE in tumor cells.ConclusionOvarian dysgerminoma is a rare malignant germ cell tumor with no specific clinical manifestations;the diagnosis depends on pathological examination and immunohistochemistry.
【Key words】DysgerminomaOvarianClinical pathology

