龙葵多糖对 CCl4致急性肝损伤小鼠的保护作用研究
杨 云, 胡筱希, 周凌凌, 高书林, 丁 霞
(南京农业大学理学院, 江苏 南京 210095)
龙葵多糖对 CCl4致急性肝损伤小鼠的保护作用研究
杨 云, 胡筱希, 周凌凌, 高书林, 丁 霞*
(南京农业大学理学院, 江苏 南京 210095)
目的 研究龙葵多糖 ( water-soluble polysaccharides from Solanum nigrum L.) 对四氯化碳 ( CCl4) 致急性肝损伤小鼠的保护作用。 方法 采用 CCl4诱导小鼠急性肝损伤模型, 连续给药 7d 后, 收集小鼠血清及肝组织标本, 测定血清中谷丙转氨酶 ( ALT)、 谷草转氨酶 ( AST) 和碱性磷酸酶 (ALP) 的活性; 检测肝组织中超氧化物歧化酶(SOD)、 过氧化氢酶 (CAT) 和谷胱甘肽过氧化物酶 (GSH-Px) 以及丙二醛 ( MDA) 的水平; 计算肝脏指数并同时对肝组织进行病理学检查。 结果 多糖高、 中剂量显著性抑制 CCl4所致急性肝损伤小鼠血清中 ALT、 AST和 ALP活性的升高 (P<0.01), 显著性降低肝组织中 MDA的水平 ( P<0.01), 并显著性升高 SOD、 GSH-Px和 CAT的活力(P<0.01)。 肝组织病理切片显示, 多糖一定程度减轻肝脏组织病理性改变。 结论 龙葵多糖对 CCl4造成的急性肝损伤小鼠具有显著的保护作用,其保护机制可能与清除自由基,抑制脂质过氧化有关。
龙葵多糖; 保肝; 四氯化碳 (CCl4); 急性肝损伤
龙葵 Solanum nigrum L.为茄科茄属草本植物, 一年至 多年生, 几乎遍布于全国 各地。 龙葵全草 皆可入 药, 其性寒,味苦、微甘,亦有小毒,归肺、肾经。具有清热解毒、利水消肿以及活血化瘀的功效[1]。 临床上龙葵主要是与其他一些中药配伍用于治疗肝癌[2]、 晚期胃癌[3]、 肺癌[4]等癌症,疗效确切。在中医治疗慢性乙型肝炎的复方中,龙葵也是经常被用到的一味药材。龙葵全草含有生物碱、皂苷、多糖、维生素 A类、 维生素 C、酚类化合物等化学成分[5-6]。
多糖是一种非常重要的信息分子的受体,广泛存在于生物有机体内,它参与一些关键过程的调节,如分子的识别、细胞的黏附以及机体的防御等。现有的研究成果证实多糖具有多种多样的药理活性,如调节免疫、抗肿瘤、抗病毒以及降血糖等[7-8]。 多糖显示了极为广阔的开发应用前景,引起了人们越来越大的兴趣,现在多糖已经成为了保健品和天然药物研发中的重要部分。
文献报道龙葵的水提取物对四氯化碳诱导的肝损伤大鼠和硫代乙酰胺 ( thioacetamide, TAA) 诱导的肝纤维化小鼠均有显著的保护作用,然而其保肝活性的物质基础仍不明确[9-10]。 多糖是水提取物 中的主要成分 之 一, 通 过前期的实 验 发 现, 龙 葵 水 溶 性 多 糖 ( water-soluble polysaccharides from Solanum nigrum L.) 有显著的保肝活性, 所以本实验进一步研究了龙葵水溶性多糖对 CCl4致急性肝损伤小鼠的保护作用并对其保肝机制进行了初步的研究,为龙葵多糖的开发应用提供重要的实验依据。
1 材料
1.1 药物和试剂 龙葵饮片 (批号 121114-1) 购于苏州市天灵中药饮片有限公司,经江苏省中医药研究院鉴定为茄科茄属植物龙葵 ( Solanum nigrum L.) 的全 草。 联苯 双酯滴丸, 北京协和药厂生产, 批号 12060103; 龙葵多糖, 实验室自制;四氯化碳购于南京化学试剂有限公司;谷丙转氨酶 (ALT) 试剂盒、 谷草转氨酶 (AST) 试剂盒、 碱性磷酸酶 (ALP) 试剂盒、 超氧化物歧化酶 (SOD) 试剂盒、过氧化氢酶 (CAT)、 谷胱甘肽过氧化物酶 (GSH-Px) 试剂盒、 丙二醛 (MDA) 试剂盒及考马斯亮蓝试剂盒均购于南京建成生物工程研究所。
1.2 动物 雄性 ICR小鼠, 体质量 (20 ±2) g, 清洁级,购于南京市江宁区汤山青龙山动物繁殖场,动物合格证号: SCXK (苏) 2008-0009。
1.3 仪器与设备 电子天平 (美国双杰兄弟有限公司); T-6 新世纪紫外可见分光光度计 (北京普析通用仪器有限责任公司); 低速离心机 (北京雷勃尔有限公司);KQ-500超声波清洗器 (昆山市超声仪器有限公司);RM2235 型石蜡切片机 (德国 Leica公司);LEICA DM 1000 光学显微镜(德国 Leica公司)。
2 方法
2.1 龙葵多糖的制备 龙葵饮片粉碎成粗粉后, 用 80%乙醇加热回流提取2次,过滤后得到龙葵残渣。取干燥后的龙葵残渣, 加 15 倍量的蒸馏水煎煮 2 次, 每次 4 h。 合并提取液, 减压浓缩至适量体积, 加入 95%乙醇至最终乙醇体积分数为 80%, 4 ℃静止过夜, 离心 (8 000 r/min),收集沉淀物。再将沉淀物溶解在适量的蒸馏水中,利用盐酸法[11]除去粗多糖中大量的游离蛋白质, 大孔树脂 D-900进行脱色后,乙醇沉淀、离心,收集沉淀物,并依次用无水乙醇、丙酮、乙醚抽洗,沉淀真空干燥,即得灰白色龙葵水溶性精制多糖。
2.2 CCl4诱导的小鼠急性肝损伤模型的建立 取 60 只雄性 ICR小鼠, 随机分成 6 组, 每组 10 只, 分别为正常对照组,四氯化碳损伤模型组,龙葵多糖的低、中、高剂量组(100、 200、 400 mg/kg) 以及联苯双酯组 (150 mg/kg)。龙葵多糖和联苯双酯均用 0.5%CMCNa溶液混悬, 按 10 mL/kg体积灌胃给药, 正常组及模型组给予等量的 CMCNa溶液, 每日一次, 连续7 d。 于末次给药 2 h后, 除正常组外其余各组小鼠均腹腔注射 0.2%CCl4的橄榄油溶液 10 mL/kg。 禁食不禁水, 16 h 后, 摘眼球取血, 对小鼠予以脱臼处死,解剖取得肝脏。
2.3 生化指标的检测与方法
2.3.1 肝脏指数的计算 用 4 ℃生理盐水洗尽肝脏的残血,除去表面结缔组织,滤纸拭干后称质量,按下式计算肝脏指数。
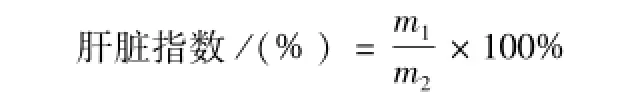
式中:m1为肝脏质量 (g);m2为小鼠体质量 (g)。
2.3.2 血清及肝组织中相关酶活力的检测 采集到的血样在室 温 放 置 2 h 后 , 以 3 000 r/min 离 心 10 min 分 离 出 血清, 赖氏法测定血清中 ALT、 AST和 ALP的活性。 取0.2 g肝脏组织 , 加冰生 理 盐 水 1.8 m L, 制 备 10%的 组 织 匀 浆 ,以 3 000 r/min 离 心 10 min 后 取 上清液, 依照试剂 盒 说明书来测定 SOD、 CAT和 GSH-Px的活性以及 MDA的水平, 利用考马斯亮蓝比色法测定肝匀浆中总蛋白质的水平。
2.3.3 肝组织病理学检查 取小鼠肝左叶大致相同部位的一小块肝组织, 用 10%甲醛溶液固定后, 石蜡包埋, 切片( 片厚 5 μm) , 苏木素-伊红 (HE) 染 色, 然 后 在光镜下观察肝脏组织病理学改变。
2.4 统计学分析 实验数据用 SPSS 16.0 软件 处 理, 以() 表示, 多 组数据间的 比较采用单因素方 差分析,P<0.05 表示有显著性差异。
3 结果与分析
3.1 龙葵多糖对急性肝损伤小鼠血清生化指标和肝脏指数的影响 模型组小鼠血清中 ALT、 AST和 ALP的活性较正常对照组明显升高 ( P<0.01), 说明本次实验模型造模成功。 龙葵多糖各剂量均能降低肝损伤小鼠血清中 ALT、AST和 ALP的活性, 高、 中剂量组与模型组比较均具有统计学差异,且高剂量组的降酶效果与联苯双酯组相当。模型组小鼠的肝脏指数显著高于空白组 (P<0.01), 说明模型组小鼠肝脏发生肿胀。龙葵多糖的高、中剂量组能显著降低由 CCl4升高的肝脏指数, 说明龙葵多糖对小鼠肝脏肿胀有一定的缓解作用,见表1。
3.2 龙葵多糖对急性肝损伤小鼠肝组织中 SOD、 GSH-Px、CAT的活性以及 MDA的水平的影响 与正常组比较, 模型组小鼠肝组织中 SOD、 GSH-Px和 CAT的活性显著降低(P<0.01, 0.001), MDA水平显著升高 (P<0.01), 说明本次实验的小鼠急性肝损伤模型造模成功。与模型组比较, 龙葵多糖高、 中剂量均能升高肝组织中 SOD、 GSH-Px和 CAT的活性, 以及降低肝组织中 MDA的水平, 且差异具有统计学意义, 见表2。
表 1 龙葵多糖对急性肝损伤小鼠血清 AST、 ALT、 ALP和肝脏指数的影响 (, n=10)
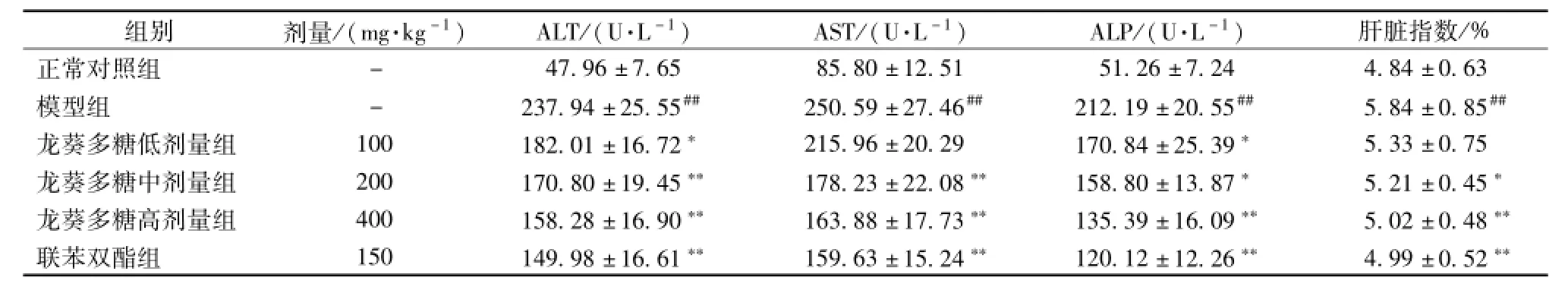
表 1 龙葵多糖对急性肝损伤小鼠血清 AST、 ALT、 ALP和肝脏指数的影响 (, n=10)
注: 与正常对照组比较,*P <0.05,**P <0.01;与模型组比较,#P <0.05,##P <0.01。 下表同
组 别 剂量 /( mg·kg-1) ALT/( U·L-1) AST/( U·L-1) ALP/( U·L-1) 肝脏指 数 /% 47.96 ±7.65 85.80 ±12.51 51.26 ±7.24 4.84 ±0.63模型组 - 237.94 ±25.55## 250.59 ±27.46## 212.19 ±20.55## 5.84 ±0.85##龙葵多糖低剂量组 100 182.01 ±16.72* 215.96 ±20.29 170.84 ±25.39* 5.33 ±0.75龙葵多糖中剂量组 200 170.80 ±19.45** 178.23 ±22.08** 158.80 ±13.87* 5.21 ±0.45*龙葵多糖高剂量组 400 158.28 ±16.90** 163.88 ±17.73** 135.39 ±16.09** 5.02 ±0.48**联苯双酯组 150 149.98 ±16.61** 159.63 ±15.24** 120.12 ±12.26** 4.99 ±0.52正常对照组-**
,n=10)表 2 龙葵多糖对急性肝损伤小鼠肝脏中 SOD,GSH-Px,CAT和 MDA水平的影响 (

,n=10)表 2 龙葵多糖对急性肝损伤小鼠肝脏中 SOD,GSH-Px,CAT和 MDA水平的影响 (
组 别 剂量 /( mg·kg-1) SOD/( U·mg-1) GSH-Px/( U·mg-1) CAT/( U·mg-1) MDA/( nmol·mg-1)39.54 ±5.89 85.71 ±8.96 220.79 ±19.93 5.12 ±0.73模型组 - 14.26 ±2.17## 29.70 ±3.87## 133.99 ±18.81## 14.31 ±1.31##龙葵多糖低剂量组 100 17.37 ±3.64 34.95 ±6.30 135.38 ±17.93 11.19 ±1.65**龙葵多糖中剂量组 200 20.54 ±3.32** 39.25 ±3.82** 155.22 ±17.07** 8.48 ±1.14**龙葵多糖高剂量组 400 25.71 ±3.68** 50.27 ±5.13** 172.56 ±18.19** 7.75 ±0.57**联苯双酯组 150 28.02 ±5.30** 58.81 ±6.80** 182.32 ±10.29** 7.06 ±0.75正常对照组-**
3.3 龙葵多糖对急性肝损伤小鼠肝组织病理学的影响 病理切片结果表明,正常对照组小鼠的肝组织结构正常,肝细胞没有变性、 坏死等病理性变化 (图 1-A)。 模型组小鼠的肝组织结构明显被破坏,大部分肝细胞出现浑浊肿胀,细胞质疏松化,肝细胞灶性或者片状坏死以及伴炎性细胞浸润等病理性改变 (图 1-B)。 龙葵多糖高、 中剂量组小鼠的肝细胞坏死,变性以及炎性细胞浸润等病变得到了很大程度的减轻 (图 1-E, 1-F), 表明龙葵多糖高、 中剂量具有较好的保护肝细胞作用, 见图1。
4 讨论
CCl4致肝损伤是经典的化学性肝损伤动物模型。 在CCl4致急性肝损伤动物模型中, 主要的肝损伤机制是脂质过氧化反应。 CCl4在体内一系列酶的作用下, 生成三氯甲基自由基 ( · CCl3) 、 二氯甲基自由基 ( · CCl2) 及 过 氧化甲基自由基 ( ·OOCCl3)。 产生的这些自由基会攻击位于肝 细 胞 膜 上 的 多 不 饱 和 脂 肪 酸 ( polyunsaturated fatty acid), 从而引发一系列脂质过氧化反应, 导致肝细胞膜通透性改变, 肝细胞内的 ALT和 AST等转氨酶就会大量释放到血液中,从而导致血清中这些酶的水平急剧上升。因此,血清中 ALT、 AST和 ALP的水平被广泛用作于临床诊断肝脏炎性损伤程度的敏感指标[12]。
肝细胞损伤是很多种肝脏疾病共有的病理基础,其中氧化应激过程在肝细胞损伤中占有很重要的地位。因而,对氧化应激导致肝细胞损伤的科学研究便成为治疗肝脏疾病的重要途径之一[13]。 SOD、 GSH-Px和 CAT是生物机体内重要的内源性抗氧化酶,它们分工或者合作共同抵御机体的外源性或内生的氧化应激损伤。其活力降低之后将会造成机体抗氧化能力一定程度的下降,从而使自由基的清除出现障碍,这将导致自由基的堆积,最终一定程度损伤肝细胞。 MDA是脂质过氧化反应产生的终产物, 其水平的高低可以反映出体内脂质过氧化的程度。
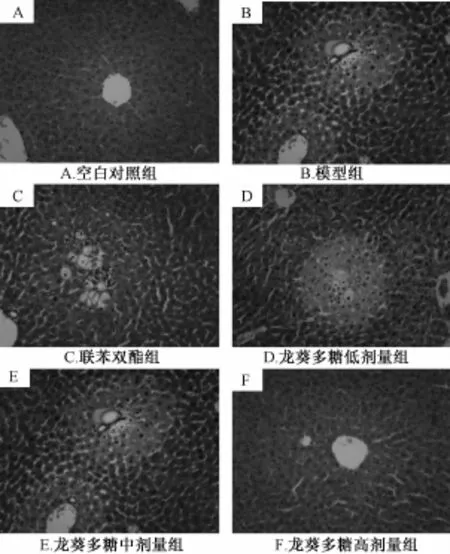
图 1 龙葵多糖对 CCl4致急性肝损伤小鼠肝脏病理改变的影响
实验结果显示, CCl4肝损伤模型组小鼠的肝组织出现严重的损伤,肝小叶结构有明显的破坏,大量炎性细胞浸润其中,大部分肝细胞出现浑浊肿胀等病理性改变,并且血清中 AST、 ALT和 ALP的活性也显著升高。 龙葵多糖各剂量组小鼠肝细胞受损程度明显减少, 血清中 AST、 ALT和 ALP的水平显著低于 CCl4模型组, 且降酶效果具有剂量依赖性,表明龙葵多糖具有保护肝细胞膜,一定程度对抗肝损伤的作用。
此外, CCl4肝损伤模型组小鼠肝组织中 SOD、 GSH-Px和CAT的活性显著降低, MDA的水平显著上升, 说明细胞清除自由基的能力大幅降低,机体内脂质过氧化反应加快,受自由基攻击的损伤程度增大。而龙葵多糖可显著提高肝组织中 SOD、 GSH-Px和 CAT的水平, 降低 MDA的水平,表明龙葵多糖能够提高机体清除自由基的能力,并且一定程度抑制脂质过氧化反应的发生。
龙葵多糖对 CCl4致急性肝损伤小鼠保护作用的研究,目前国内外尚未有报道。其对肝细胞的保护可能是通过保护细胞膜、清除自由基、抑制脂质过氧化反应来发挥作用的。
[1] 梅全喜.广东地产药材研究[M].广东: 广东科技出版社,2011:247-250.
[2] 赵晓琴,曾祥法.龙葵片对原发性肝癌治疗作用的临床研究[J].辽宁中医杂志, 2002, 29(11):671-672.
[ 3 ] 杜洪彬, 宋 慧.扶正消瘤汤合并 MAF治疗晚期胃癌 31例[J].黑龙江中医药, 2004, 11(3):13-14.
[ 4 ] 谢远明, 张长富.加味一贯煎治疗肺癌症 106 例[J].陕西中医, 2002, 23(04):302-303.
[5] 周新兰,何祥久,周光雄,等.龙葵全草皂苷类化学成分研究[J].中草药, 2006, 37(11):1618-1621.
[ 6 ] 赵 莹, 刘 飞, 娄红祥.龙葵化学成分研究[J].中药材,2010, 33(4):555-556.
[ 7 ] 韩果萍, 段玉峰.我国天然活性多糖药理研究进展[J].中药材, 2003, 10(2):138-141.
[ 8 ] 王玉华, 袁久荣.中药多糖的化学研究概况[J].中成药,2004, 26(6):496-497.
[13] 方积年, 丁 侃.天然药物—多糖的主要生物活性及分离纯化方法[J].中国天然药物, 2007, 5(5):338-347.
[ 9 ] Lin H, TsengH, Wang C, etal.Hepatoprotective effectsof Solanum nigrum Linn extract against CCl4-iduced oxidative damage in rats[ J].Chem Biol Interact, 2008, 171(3):283-293.
[10] Hsieh C, Fang H, Lina W.Inhibitory effect of Solanum nigrum on thioacetamide-induced liver fibrosis in mice[ J] .J Ethnopharmacol, 2008, 119(1):117-121.
[11] 王 珊, 黄胜阳.植物多糖提取液脱蛋白方法的研究进展[ J] .食品科技, 2012, 37(9) :188-191.
[12] Quan J, Yin X, Xu H.Boschniakia rossica prevents the carbon tetrachloride-induced hepatotoxicity in rats[ J] .Exp Toxicol Pathol, 2011, 63(1/2):53-59.
[13] 赵文玺, 金梅花, 李 天, 等.草苁蓉水萃取物对四氯化碳致肝损伤小鼠肝脏氧化应激的干预作用[J].中国中药杂志, 2013, 38(6):875-878.
R285.5
:B
1001-1528(2014)12-2602-04
10.3969/j.issn.1001-1528.2014.12.036
2013-10-12
中央高校基本科研业务费专项基金 (KYZ201220)
杨 云 (1987—), 男, 硕士, 研究方向: 中药物质基础。 E-mail:yuny-ok@126.com
*通信作者: 丁 霞 (1963 —) , 女, 副教授, 硕士生导师, 研究方向: 中药物质基础。 E-mail:dingxianjau@126.com
日期:2014-01-26
网络出版地址:http://www.cnki.net/kcms/detail/31.1368.R.20140126.1452.003.html

