MSPD-HPLC法测定金线吊乌龟中千金藤素
汪亚勤, 殷嘉珺, 谢道涛, 康 云, 翁伟宇, 黄建明*
(1.复旦大学药学院, 上海 201203; 2.华东理工大学, 上海 200237)
MSPD-HPLC法测定金线吊乌龟中千金藤素
汪亚勤1, 殷嘉珺1, 谢道涛1, 康 云1, 翁伟宇2, 黄建明1*
(1.复旦大学药学院, 上海 201203; 2.华东理工大学, 上海 200237)
目的 建立基质固相分散-高效液相色谱法 (MSPD-HPLC) 测定千金藤属植物金线吊乌龟块根中千金藤素的量。 方法 样品的前处理采用 MSPD法, 以碱性氧化铝为吸附剂, 甲醇为洗脱溶剂。 HPLC分析采用 Phenomenex Gemini C18色谱柱 (250mm ×4.60 mm, 5 μm) , 流动相为乙腈-缓冲液 (0.5%三乙胺水溶液用磷酸调节 pH至 10.7) , 体积流量 1.0mL/min, 检测波长 282 nm, 柱温 40 ℃。 结果 千金藤素在 14.88 ~238 μg/mL范围内呈良好线性关系(r=0.999 4), 平均回收率为 98.2%, RSD 3.0% (n=6)。 结论 所建 MSPD-HPLC法简便、 快速, 可用于金线吊乌龟中千金藤素的定量分析。
金线吊乌龟;千金藤素;基质固相分散法;高效液相色谱法
金线吊乌龟 Stephania cepharantha Hayata为防己科千金藤属植物,又名头花千金藤、白药、山乌龟等,其块根为民间常用药材,味苦性寒,具有清热解毒、消肿止痛的功效,主治咽喉肿痛、风湿痹痛、 腹痛 泻 痢 等 疾 病[1-2]。 该 植 物 块 根 富 含 生 物碱, 其中千金藤素 ( cepharanthine, 又名头花千金藤碱)是重要的活性成分,具有升高白细胞、抗炎、 抗癌、 抗 HIV-1 和增强免 疫 调 节 等 作用[2-9]。金线吊乌龟中千金藤素的测定方法有 TLCS 和HPLC法, 样品前处理先以冷浸或回流法提取,再以有机溶剂萃取生物碱, 均较耗时、 繁复[10-11]。
基质 固 相 分 散 法 ( Matrix solid-phase dispersion, MSPD) 是一种新型的样品处理技术, 该法将提取和净化过程合二为一,从而简化了操作步骤, 缩短了处 理时间[12-15]。 本 实 验建立了 MSPDHPLC法测定金线吊乌龟中的千金藤素, 该法简便、快速、准确、重复性好,为金线吊乌龟的质量评价提供了参考。
1 仪器与试药
1.1 仪器 Agilent 1200 型高效液相色谱仪 ( 安捷伦科技有限公司), 10 管固相萃取装置 (安捷伦科技有限公司),Thermo fisher FE20 pH计 ( 梅特勒-托利多仪器有限公司), EL104 电子天平 (上海梅特勒-托利多仪器有限公司)。
1.2 试药 金线吊乌龟样品 1 和 2 的产地均为四川,采集时间分别为 2010 年 11 月和 2011 年 10月,经复旦大学药学院康云博士鉴定为金线吊乌龟S.cepharantha Hayata.的干 燥块 根, 凭证标本保存于复旦大学药学院生药学教研室。千金藤素对照品 (中 国 药 品 生 物 制 品 检 定 所, 批 号111647200301)。 碱性氧化铝 (150 μm,天津博纳艾杰尔科技有限公司), C18和硅胶 (40 ~50 μm,天津博纳艾杰尔科技有限公司)。 甲醇 (色谱级,江苏汉邦科技有限公司); 乙腈 (色谱级,中国医药集团上海化学试剂公司); 超纯水 ( 美国 Millipore公司的 Milli-Q超纯水系统制得); 其余试剂均为分析纯。
2 方法与结果
2.1 色谱条件 采用 Phenomenex Gemini C18色谱柱 (250 mm ×4.60 mm, 5 μm), 流动相为乙腈-缓冲液 (0.5%三乙胺水溶液用 10%磷酸调节 pH至 10.7) (70 ∶30), 体积流量 1.0 mL/min, 检测波长 282 nm, 柱温 40 ℃, 进样量 20 μL。该色谱条件下对照品和供试品的色谱图 (图1) 显示, 千金藤素分离度良好、峰形对称。
2.2 对照品溶液的制备 取千金藤素对照品适量,精密称定,用甲醇配制成 2.38 mg/mL的对照品贮备液。
2.3 供试品溶液的制备 取药材干燥粉末 (过 60目筛) 0.25 g, 精密称定, 置玻璃研钵中, 加入碱性氧化铝 1 g,用玻璃研杵研磨 5min, 形成细腻匀质的药材-填料混合粉末。将混合粉末转移至垫有筛板的固相萃取小柱中,顶部盖上另一筛板并压实,用甲醇 8 m L洗脱,收集洗脱液, 定容至10 m L, 离心 (10 000 r/min, 5 min), 取上清液,即得。
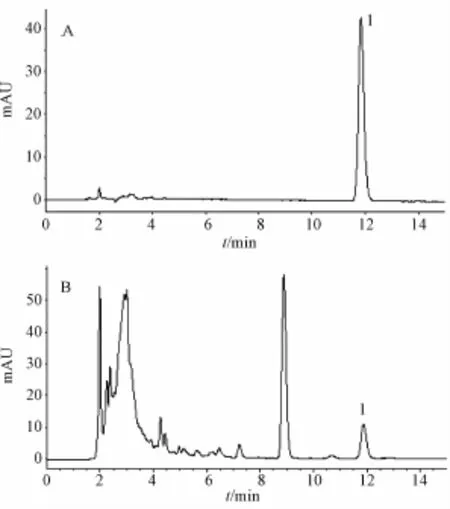
图1 千金藤素对照品 (A) 和金线吊乌龟供试品 (B) 的 HPLC图谱Fig.1 HPLC chrom atogram s of cepharan thine(A) and S.cepharantha (B)
2.4 方法学考察
2.4.1 线性关系考察 将 “2.2” 项下的千金藤素对照品贮备溶液用甲醇稀释成 238、 119、 59.5、29.75、 14.88 μg/mL的对照品工作溶液,分别进样分析。 以质量浓度 (C, μg/mL) 对峰面积 (A)进行线性回归, 得回归方程 A=12.33 C+17.48,相关系数 r=0.999 4, 表明千金藤素在 14.88 ~238 μg/mL范围内线性关系良好。
2.4.2 检测限 将千金藤素对照品贮备溶液用甲醇稀释成一定质量浓度, 作 HPLC分析。 按照信号噪音比 (S/N) ≥ 3 确定千金藤素的检测限为0.97 μg/mL。
2.4.3 精密度试验 取 238、 59.5、 14.88 μg/m L的千金藤素对照品溶液在确定条件下分析。每个质量浓度日内测 3 次, 连续测3 日。 日内测定的 RSD分别为 0.4%、0.4%、 0.9%, 日间测定的 RSD分别为 2.3%、 2.4%、 1.4%。 结果表明, 仪器的精密度良好。
2.4.4 重复性试验 取金线吊乌龟 1 号样品 0.25g 6 份, 按 “2.3” 项下方法制备供试品溶液进样分析。 结果, 千金藤素的 RSD为 4.7% (n=6),方法的重复性良好。
2.4.5 稳定性试验 取贮存于0 ~4 ℃的对照品溶液 (238、 59.5、 14.88 μg/mL) 和 供 试品溶液,在 0、 24、 48 h 分别进样分析, 测得对照品溶液的RSD分别为 2.7%、 2.4%、 1.7% (n=3), 供试品溶液的 RSD为1.1% (n=3), 显示对照品和供试品溶液中的千金藤素至少在48 h内稳定。
2.4.6 加样回收率试验 取金线吊乌龟 1 号样品0.125 g 6 份, 精密称定, 准确加入 125 μL对照品储备液 (2.38 mg/m L), 按 “2.3” 项下方法制备供试品溶液,进样分析,计算加样回收率,结果见表1。
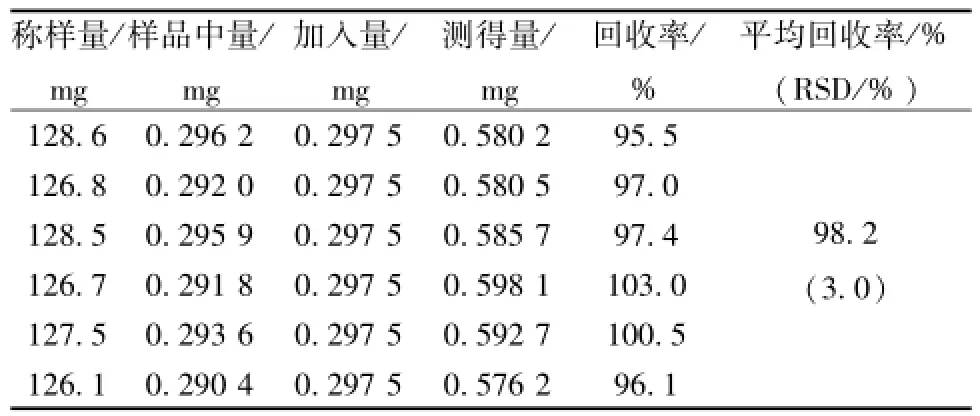
表 1 千金藤素的加样回收率 (n=6)Tab.1 Results of recovery tests for cepharanthine( n=6)
2.5 样品测定 按 “2.3” 项下方法制备供试品溶液, 进行 HPLC分析, 金线吊乌龟 1 号和 2 号样品中 千 金 藤 素 的 量 分 别 为 ( 2.303 ± 0.067 )mg/g, (1.708 ±0.022) mg/g(n=3)。
3 讨论
3.1 样品处理方法的选择与优化 比较了 MSPD法 ( <10 min)、 索氏提取法 (6 h) 和超声提取法(30 min), 3 种方法对千金藤素的提取率无差别,但是索氏提取法和超声提取法需要较大量的提取溶剂, 耗时长, 且提取液的颜色较深; 而 MSPD法消耗的溶剂量少,耗时短,且提取液的颜色较浅,提示样品较洁净。 因此, 本实验选择 MSPD法。
同时对 MSPD法的研磨时间、 吸附剂与洗脱剂进行了优化。 研磨是 MSPD法与常规固相萃取法( solid-phase extraction, SPE) 的 区 别 步 骤 之 一。MSPD法将固体样品与吸附剂研磨混合后即可提纯; 而 SPE需用合适的方法提取出目标成分后才可进行。研磨可使样品均化、细胞破裂、待测成分充分吸附到载体上,因而研磨时间的长短对提取效果有影响。 考察了研磨 1、 3、 5 min 的结果, 5 min可以得到高且稳定的提取率,因此本实验选择研磨5 min。
MSPD法中的吸附剂对千金藤素的提取效果有显著影响。 以碱性氧化铝、 C18和硅胶为吸附剂时,提取得到的千金藤素分别为 (2.303 ± 0.067)mg/g、 (2.057 ±0.071)mg/g、 (1.960 ±0.192)mg/g(n=3), 碱性氧化铝的提取效果最佳。
洗脱剂考察了甲醇、 80%甲醇、 0.125%氨化甲醇,3种溶剂对千金藤素的提取率无显著差别,本实验选择最简便的甲醇为洗脱剂。
洗脱剂甲醇的体积比较了 6、8、10 mL,6 mL洗脱所得千金藤素的稳定性欠佳, 8 和10 m L的洗脱效果无显著差别, 因此选择8 mL为洗脱剂体积。
3.2 色谱条件的优化 生物碱的峰形和分离度受流动相pH值的影响较大, 因而实验中首先考察了pH 7 ~11 的水相,结果, pH在 10.5 以上时, 千金藤素的峰形对称、 分离度较好,本实验以 pH 10.7 的三乙胺-硫酸缓冲液作为水相。 其次, 比较了甲醇和乙腈两种有机相,乙腈的分离效果更好且柱压较低,因此选择乙腈作为有机相。
[1] 中国科学院中国植物志编辑委员会.中国植物志:第三十卷[M].北京: 科学出版社, 1996:57.
[2] 黄泰康, 丁志遵, 赵守训.现代本草纲目[M].北京: 中国医药科技出版社, 2001:842-844.
[ 3 ] Furusawa S, Wu J H.The effects of biscoclaurine alkaloid cepharanthine on mammalian cells:implications for cancer,shock, and inflammatory diseases[ J].Life Sci, 2007, 80(12) :1073-1079.
[ 4 ] Harada T, Harade K, Ueyama Y.The enhancement of tumor radioresponse by combined treatment with cepharanthine is accompanied by the inhibition of DNA damage repair and the induction of apoptosis in oral squamous cell carcinoma[ J] .Int J Oncol, 2012, 41(2) :565-572.
[ 5 ] Uto T, Nishi Y, Toyama, etal.Inhibitory effect of cepharanthine on dendritic cell activation and function[ J] .Int Immunopharmacol, 2011, 11(11) :1932-1938.
[ 6 ] Matsuda K, HattoriS, Komizu Y, etal.Cepharanthine inhibited HIV-1 cell-cell transmission and cell-free infection viamodification of cellmembrane fluidity.Bioorg Med Chem Lett[ J]. 2014, 24(9) :2115-2117.
[ 7 ] Haginaka J, Kitabatake T, Hirose I, et al.Interaction of cepharanthine with immobilized heat shock protein 90a(Hsp90a) and screening of Hsp90a inhibitors[ J] .Anal Biochem, 2013, 434(1) :202-206.
[ 8 ] Huang H L, Hu G X, Wang C F, et al.Cepharanthine, an alkaloid from Stephania cepharantha Hayata, inhibits the inflammatory response in the RAW264.7 cell and mouse models[ J] .Inflamm, 2014, 37(1) :235-246.
[ 9 ] Zhou E, Fu Y, Wei Z, et al.Cepharanthine attenuates lipopolysaccharide-induced mice mastitis by suppressing the NF-κB signaling pathway[ J].Inflamm, 2014, 37(2) :331-337.
[10] 朱兆仪, 冯毓秀, 何丽一, 等.中国防己科千金藤属药用植物 资 源 利用研 究 [J].药学 学 报, 1983, 18 (6) : 460-467.
[11] 阮德媋, 张雪梅, 赵春景, 等.千金藤属植物生物碱的高效液相色谱定量分析[J].云南植物研究, 1991, 13(2) : 225-230.
[12] Barker S A.Matrix solid phase dispersion ( MSPD) [ J].J Biochem Biophys Methods, 2007, 70(2) :151-162.
[13] Capriotti A L, Cavaliere C, Giansanti P, et al.Recent developments inmatrix solid-phase dispersion extraction[J] .JChromatogr A, 2010, 1217(16) :2521-2532.
[14] Shi X, Jin Y, Liu J, et al.Matrix solid phase dispersion extraction of ginsenosides in the leaves of Panax ginseng C.M. Mey[ J] .Food Chem, 2011, 129(3) :1253-1257.
[15] Atlabachew M, Torto N, Chandravanshi B S, et al.Matrix solid-phase dispersion for the HPLC-DAD determination of psychoactive phenylpropylamino alkaloids from Khat( Catha edulis Forsk) chewing leaves[ J] .Chromatographia, 2013, 76 ( 7/ 8) :401-408.
Determ ination of cepharanthine in Stephania cepharantha Hayata by MSPD-HPLC
WANG Ya-qin1, YIN Jia-jun1, XIE Dao-tao1, KANG Yun1, WENG Wei-yu2, HUANG Jian-ming1*
(1.School of Pharmacy, Fudan University, Shanghai 201203, China;2.School of Pharmacy, East China University of Science and Technology,Shanghai200237, China)
AIM To establish a matrix solid-phase dispersion ( MSPD) extraction method followed by HPLC for the determination of cepharanthine in Stephania cepharantha Hayata.METHODS The sampleswere preparedby an optimized MSPD procedure using basic alumina as the sorbent and methanol as the elution solvent.The HPLC separation was carried out on a Phenomenex Gemini C18column (250 mm ×4.60 mm, 5 μm) with an isocratic mobile phase consisting of acetonitrile-0.5%triethylamine aqueous solution adjusted to pH 10.7 with phosphoric acid (70 ∶30).The flow rate was1.0 mL/min, the detection wavelength was setat282 nm, and the column temperature was 40 ℃.RESULTS The calibration curve of cepharanthine was linear in the range of 14.88 ~238 μg/mL(r=0.9994).The average recovery was 98.2%with RSD 3.0% (n=6) .CONCLUSION The MSPD-HPLCmethod is simple, rapid, and applicable to the quantification of cepharanthine in S.cepharantha.
Stephania cepharantha;cepharanthine;matrix solid-phase dispersion;HPLC
R284.1
:A
1001-1528(2014)12-2557-04
10.3969/j.issn.1001-1528.2014.12.025
2014-08-01
国家自然科学基金项目 (31100238); 复旦大学青年教师科研能力提升项目 (20520133180)
汪亚勤 ( 1983—), 女, 实验师, 主 要从 事中 药质量 评价 与 活性成 分 的研究。 Tel:13585543024, E-mail:wangyq1219@ 126.com
*通信作者: 黄建明, 女, 副教授, 硕士生导师, 主要从事中药质量评价与活性成分的研究。 Tel: ( 021) 51980132, E-mail:jmhuang @shmu.edu.cn

