循环机械压力诱导下兔椎间盘退变器官模型的建立及意义*
徐宏光章平治宋俊兴胡斌赵泉来吕坤钟民张梦莹所起凤
(皖南医学院附属弋矶山医院 1.脊柱外科;2.中心实验室,安徽芜湖 241001)
循环机械压力诱导下兔椎间盘退变器官模型的建立及意义*
徐宏光1**章平治1宋俊兴1胡斌1赵泉来1吕坤2钟民2张梦莹2所起凤2
(皖南医学院附属弋矶山医院 1.脊柱外科;2.中心实验室,安徽芜湖 241001)
背景:力学因素是导致椎间盘退变(IDD)的重要诱因,建立力学相关性 IDD 的器官模型能为 IDD 机制的研究提供理想的模型基础。
目的:建立兔椎间盘器官模型,并施以循环机械压力,探究循环机械压力载荷对IDD 的影响。
方法 :6 月龄新西兰大白兔随机分为加力组和对照组,静脉给予 1.3 ml肝素(5000 U/ml),待肝素体内循环 5 min 后处死。无菌条件下完整取出带部分椎骨的腰段椎间盘,放入 20%胎牛血清的培养液中培养。加力组应用加力器施以 0.2 MPa 压力值,每日加压 1 次 ,每次 30 min。经 过 各 个 时 段 的 培 养后,苏 木 精-伊红(HE)染色观察椎间盘 大 体 组 织 形 态 学变化;氯化硝基四氮唑蓝(NBT)染色及 4',6-二眯基-2-苯基吲哚(DAPI)复染检测椎间盘细胞成活率;Realtime RT-PCR 和Western-blotting 检测蛋白多糖(AGN)、Ⅱ型胶原(COLⅡ)的 mRNA 和蛋白表达。
结果:对照组和加力组培养至第 7 d的组织形态学无明显变化,培养至第 14 d均表现为组织形态学破坏,且以加力组表现更为明显。对照组培养至第 7 d 的细胞成活率及 AGN、COLⅡ表达与 0 d 相比无明显变化;对照组培养第 14 d与 0 d 比较,培养第 7 d 加力组与对照组比较,培养第 14 d加力组与对照组比较,均表现为细胞成活率明显下降,AGN、COLⅡ表达下调。
结论:成功建立短周期兔椎间盘体外器官模型,并在此模型基础上阐明循环机械压力载荷可直接导致椎间盘退变样改变。
器官培养;循环机械压力;椎间盘退变
Background:The mechanical factor is the main incentive of intervertebral disc degeneration.The establishment of an in vitro organ culture model can provide a basic condition for studying the mechanism of intervertebral disc degeneration.
Objective:To develop an in vitro organ culture model of rabbit intervertebral disc,and to investigate the relationship between cyclic mechanic pressure and intervertebral disc degeneration.
Methods:New Zealand white rabbits aged 6 months old were randomly divided into cyclic mechanical pressure group and control group.Heparin(5000 U/ml,1.3 ml)were intravenously infused,then the animals were killed 5 minutes later.Then intervertebral discs were taken out with part of the vertebrae from lumbar spines by asepsis and cultured in medium with 20%fetal bovine serum supplemented.Cyclic mechanical pressure at 0.2 MPa was applied once every 30 minutes in a day. The change of histomorphology,cell viability and mRNA and protein expression levels of aggrecan,typeⅡcollagen within intervertebral disc tissue were assessed by HE staining,NBT-DAPI,real time RT-PCR and Western-blotting,respectively,at different periods.
Results:In the control group,there were no significant defferences in terms of the changes in histomorphology,cell viability and mRNA and protein expression levels of aggrecan and typeⅡ collagen before culture and 7 days after culture.Obvious damage in histomorphology were seen in both control group and cyclic mechanical pressure group 14 days after culture,especially in later one.The cell viability and the expression level of typeⅡcollagen and aggrecan were significantly decreased at 7,14 days after culture in the cyclic mechanical pressure group and 14 days in the control group.
Conclusions:The short-term in vitro organ culture of rabbit intervertebral disc is successfully performed in the study.Cyclic mechanical pressure can induce degeneration of the intervertebral disc in this model.
椎间盘退变(intervertebral disc degeneration,IDD)是脊柱退行性疾病最常见的病因[1-3],年龄、营养、基因、力学等因素与 IDD 密切相关[4-6]。研究发现,将不平衡的压力施于颈椎可导致不同程度 IDD 的发生[7-9],我们可以认为异常应力是导致IDD的重要因素。
随着对 IDD 研究的不断深入,建立一种较好的IDD模型对于研究其退变机制具有重要意义。众多学者研究指出,IDD的在体动物模型不利于对细胞和基 质 代 谢 疾 病 以 及 信 号 传 导 异 常 的 探 究[10-13]。 另 一些学者亦发现,体外单层细胞培养由于失去了特有的细胞外基质环境而致细胞表型丢失,且细胞增殖率低[5,14]。近年来,国内外学者对椎间盘器官整体培养渐趋重视[15],Haschtmann 等[16]通过实验研究证明,带有完整软骨终板的椎间盘模型培养的时间较长,不失为研究IDD机制的优质体外模型。本研究拟建立类似于体内生理环境的兔椎间盘器官模型,并在此模型基础上施以一定值一定周期的循环机械压力(cyclic mechanic pressure,CMP)载荷,研究压力刺激与 IDD 的关系 ,探索力学刺激相关性 IDD 器官培养的实用技术。
1 材料与方法
1.1 实验动物
40只清洁级新西兰大白兔,6月龄,雌雄不限,体重 1800~2100 g,由南京市江宁区青龙山动物繁殖场提供[合格证号:SCXK(苏)2012-0008]。
1.2 试剂和仪器
动物椎间盘加力器(专利号:ZL 2011 2 0575941. X;专利权人:徐宏光)。青链双抗(Gibico 公司,美国);DMEM/F12(Gibico 公司 ,美 国);胎 牛 血 清(Gibico 公司,美国);苏木素伊红(HE)染色试剂盒(碧云天生物技术研究所,中国);氯化硝基四氮唑蓝(NBT)(Amresco,美国);4’,6-二眯基-2-苯基吲哚(DAPI)(Sigma,美国);Trizol(Invitrogen,美国);PCR 反应体系和反转录试剂盒(Fermentas,美国);Realtime-PCR 仪(Roche,瑞士);Realtime-PCR 试剂盒(Takara,日本);BCA蛋白定量试剂盒(北京康为世纪生物技术公司,中国);蛋白多糖(aggrecan,AGN)、Ⅱ型胶原(type Ⅱ collagen,COL Ⅱ)多克隆抗体(Abcam公司,美国);Odyssey红外扫描仪(LICOR Biosciences,美国);5%CO2培养箱(Forma公司,美国);倒置相差显微镜(Olympus,日本);荧光显微镜(Nikon,日本);石蜡切片机(Leica,德国)。
1.3 实验方法
1.3.1 循环压力刺激下的兔椎间盘整体器官的获得与培养:每次随机选取 4 只新西兰大白兔,静脉给予 1.3 ml肝素(5000 U/ml),待肝素体内循环 5 min 后行空气注射法处死[17]。无菌条件下手术完整取出带部分椎骨的L1-2、L2-3、L3-4 及 L4-5 椎间盘,并分别作为一个整体器官,共16个。随机分为加力组和对照组各8个,置入含有 20%胎牛血清(FBS)、DMEM/F12(1:1)、青链双抗(青霉素 50 U/ml和链霉素 50 μg/ml)培养液的培养皿里,再放进37℃和5%CO2培养箱进行培养,每天更换1次培养液,培养时间依次为0、7、14 d。根据相 关文献提示,对包括兔的小型动物脊柱施以 0.1~0.3 MPa,每 12~24 h 加压 1 次,每次 30~120 min 的循环 压 力 是 一 较 合 理 的 区 间[18-22]。 本 研 究 根 据 以 上 观点结合试验摸索,将加力组椎间盘器官在无菌条件下 安 装 好 加 力 器 ,每 次 给 予 压 力 刺 激 值 为 0.2 MPa,每日加压 1 次,每次 30 min。
1.3.2 观察两组椎间盘器官的组织学改变:分别取出培养 0、7、14 d 对照组和加力组的椎间盘器官,10%福尔马林固定,石蜡包埋后按椎间盘器官矢状面进行切片,切片厚度为 7 µm。应用标准苏木精-伊红(hematoxylin-eosin staining,HE)染色法在光镜下观察两组椎间盘的组织学变化,并根据汤普森分级系统对所观察图像进行退变程度分级[23](表 1)。
1.3.3 观察两组椎间盘器官的细胞成活率:分别于培养 0、7、14 d 在对照组和加力组椎间盘器官培养液中加入浓度为 10 mg/ml的 NBT 液 240 µl,吹打混匀,8 h后取出椎间盘,PBS液漂洗3次,10%福尔马林固定48 h,石蜡包埋切片,切片厚度为 7 µm,光镜观察并获取图像,核荧光DAPI复染,通过荧光显微镜观察并获取同一视野内图像。仅被NBT着色细胞视为活细胞,DAPI荧光着色细胞视为活细胞与死亡细胞总和,即总细胞数,按下面公式计算成活细胞百分比:
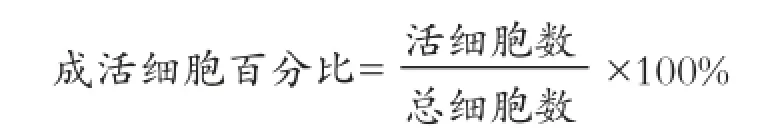
1.3.4 观察两组椎间盘器官 AGN 和 COLⅡ的表达变化:① Realtime RT-PCR 检测:测定两组椎间盘组织培养各时段的软骨细胞标志性基因AGN和COLⅡ的mRNA表达量。各组分别取250 µg研磨成组织匀浆 ,按 Trizol试 剂 盒 说 明 提 取 总 RNA,取 3 μg 按 Revert AidTMFirst Strand cDNA Synthesis试剂盒说明书行一步法反转录合成cDNA。将 cDNA稀释5 倍,进行 Realtime RT-PCR,各基因的引物序列及扩增片段见 表 2。 反 应 条 件 :95℃ 预 变 性 30 s;95℃ 变 性 5 s、60℃退火延伸 25 s,扩增 50 个循环。溶解曲线分析:95℃ 0 s,65℃ 15 s,95℃ 0 s;溶解曲线为单一峰说明是特异性扩增。灭菌超纯水作为阴性对照,每个模 板做 3 个复孔,三 磷 酸甘油醛脱 氢 酶(Glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,结果 使 用 相 对 定 量 2-△△CT方 法 分析[24]表 2)。 ② Western-blotting 检测:对两组椎间盘组织培养各时段的软骨细胞标志性基因AGN和COLⅡ的蛋白表达量进行测定。蛋白提取定量变性,精确称取20 μg,按比例加入5×上样缓冲液,提取的总蛋白样品经分光光度计定量。取 20 μg 样品加入到 12%的 SDS-聚丙酰胺凝胶电泳,待溴芬兰进入凝胶底部后,将样品印迹到硝酸纤维素膜上,加入一抗4℃过夜,二抗1 h后应用Odyssey红外扫描仪成像。

表1 汤普森分级系统
1.4 统计学处理
采用 SPSS 18.0 软件进行统计学分析,计量资料以表示,组间比较采用独立样本t检验,组内比较采用方差检验,以P<0.05为有统计学差异。
2 结果
2.1 组织学改变(HE染色)
与培养0 d相比较,加力组与对照组椎间盘培养至第7 d的软骨终板、纤维环及髓核组织大体组织学结构未发现明显改变及破坏;培养至第14 d的纤维环出现裂伤、结构紊乱,与髓核组织界限不清,髓核组织出现纤维化、体积缩小,且以加力组椎间盘整体培养器官的改变和破坏更为明显。汤普森分级:两组培养 0 d 和第 7 d 均为Ⅰ级,第 14 d 为Ⅲ~Ⅳ级(图 1)。

表 2 Realtime RT-PCR 引物序列
2.2 椎间盘细胞成活率(NBT染色及DAPI复染)
对照组和加力组组内比较采用方差检验:与0 d相比较,对照组培养至第 7 d 的细胞成活率无明显下降(P=0.719,图 2),培养至第 14 d 的细胞成活率下降(P=0.019,图 2);与 0 d 相 比 较 ,加 力 组 培 养 至 第 7 d的细胞成活率下降(P=0.031,图 2);培养至第 14 d 的细 胞成活率下降更为明显(P=0.000,图 2)。对照组与加力组组间比较采用独立样本 t检验:培养 0 d 时,两组间细胞成活率无明显变化(P=0.996,表3,图2);培 养至 第 7 d 时 ,加力 组的 细 胞成 活率 低 于对 照组(P=0.043,表 3,图 2);培养至第 14 d 时,加力组的细胞成活率下降更为明显(P=0.000,表3,图 2)。
2.3 Realtime RT-PCR 检测
2.3.1 AGN 表达:与 0 d 相比较,对照组培养至第 7 d 的AGN 表达无明显下调,(P=0.932,表 4),培养至第 14 d的 AGN表达下调,有统计学差异(P=0.002,表 4);培养第 7 d两组间比较,加力组 AGN表达下调,有统计学差异(P=0.001,表 4);培 养 第 14 d 两 组 间 比 较 ,加 力 组AGN表达明显下调,有统计学差异(P=0.000,表4)。
2.3.2 COLⅡ表达:与 0 d 相比较,对照组培养至第 7 d的 COLⅡ 表 达 无 明 显 下 调 ,(P=0.694,表 5),培 养 至第 14 d 的 COLⅡ表 达明显下 调 ,有统 计 学差异(P= 0.003,表 5);培 养 第 7 d 两 组 间 比 较 ,加 力 组 COLⅡ表达下调,有统计学差异(P=0.002,表 5);培养第 14 d两组间比较,加力组COLⅡ表达明显下调,有统计学差异(P=0.001,表 5)。
2.4 Western-blotting 检测
AGN、COLⅡ基因在各时间点的表达:以β-actin为内参。对照组 7 d 与 0 d 比较,蛋白表达无明显下调;对照组 14 d 与 0 d 比较,蛋白表达明显下调;培养第 7 d两组间比较,加力组蛋白表达明显下调;培养第 14 d 两组间比较,加力组蛋白表达明显下调,且随着加力培养时间的延长,蛋白表达逐渐下调(图5)。
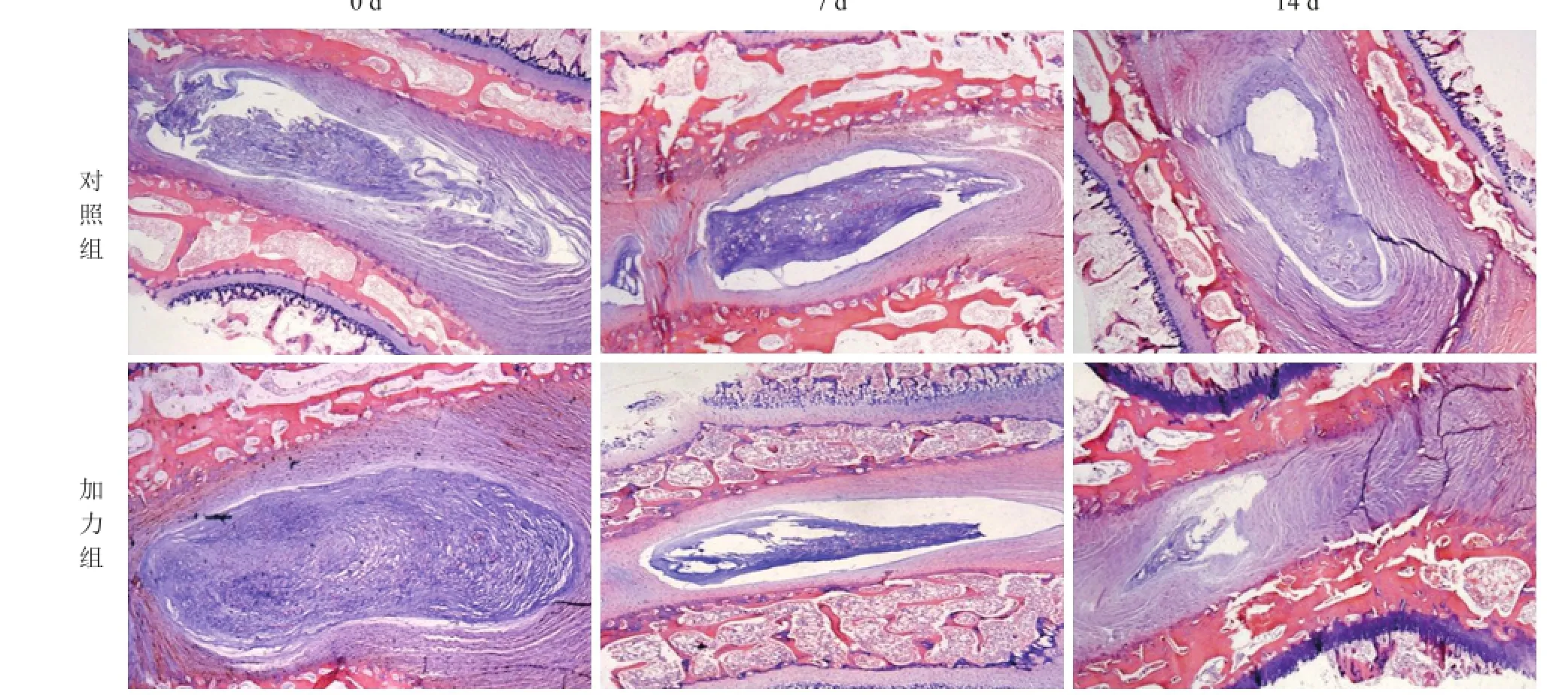
图1 加力组和对照组器官培养各时间点椎间盘矢状面石蜡切片HE染色观察椎间盘大体组织形态学的变化(倒置相差显微镜,×40)

图2 对照组与加力组兔椎间盘器官培养在各时间点相同视野活细胞数与总细胞数(荧光显微镜,×200)
3 讨论
3.1 器官培养对力学相关性IDD 研究的意义
引起 IDD 的病因非常复杂,但有充分证据证明在 IDD 的发病机制中异常应力扮演重要角色[25]。然而目前仍缺乏合适的研究模型,使研究受到局限。
椎间盘应力载荷传导的在体动物研究因不能充分控制椎间盘运动节段的载荷参数而使研究变得异常复杂,难以得到确切的试验数据,研究结果难以把握[26]。另一方面,应用细胞培养技术进行研究能很好地控制应力载荷,但因离开其原有的细胞外基质环境而容易导致细胞表型丢失,细胞难以维持其活力,从而限制该技术在此领域的研究。与以上方法相比较,建立器官培养系统的方法既能使椎间盘细胞不脱离其生存的基质环境,又能很好地进行应力载荷控制,较好地克服以上技术缺陷,不失为研究力学相关性IDD较为理想的模型。
3.2 器官来源的实验动物选择
椎间盘整体器官培养模型最初来源于小型动物,因为其椎间盘有较高的面积-容积比例,有利于营养向椎间盘各个部分弥散渗透以及代谢物的排出,故而小型动物的椎间盘作为器官培养的来源较为理想[27]。 Seol等[26]将 大鼠 椎 间 盘 和 兔 椎 间 盘 同 时 进 行整体器官培养,之后分别对其组织形态学、细胞活力、基质及标志性基因表达进行观察和分析发现,兔椎间盘器官培养后的上述各指标均较大鼠稳定。结论认为,小型动物中兔椎间盘作为器官培养来源较大鼠椎间盘更具稳定性。相比啮齿类的大鼠,兔的种属更接近于人类,且广泛应用于IDD的研究领域,获得椎间盘器官的手术方式与大鼠相比无需应用显微外科技术,技术操作上更加简单。因而,本研究中采用新西兰大白兔作为椎间盘整体器官培养的来源。
表3 对照组与加力组兔椎间盘器官培养在各时间点的细胞存活率(,%)
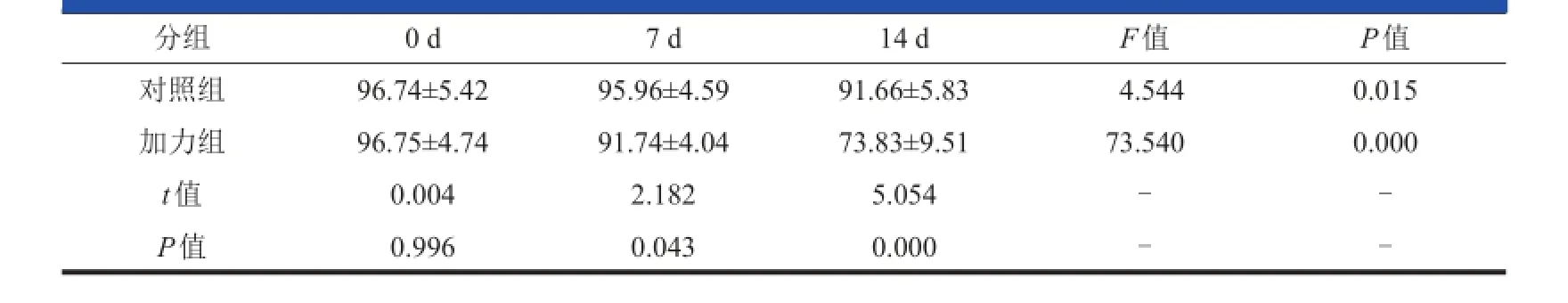
表3 对照组与加力组兔椎间盘器官培养在各时间点的细胞存活率(,%)
?
表 4 Real-time RT-PCR 检测器官培养各时间点对照组和加力组兔椎间盘 AGN mRNA 表达量()

表 4 Real-time RT-PCR 检测器官培养各时间点对照组和加力组兔椎间盘 AGN mRNA 表达量()
?
表 5 Real-time RT-PCR 检测器官培养各时间点对照组和加力组兔椎间盘 COLⅡmRNA 表达量()

表 5 Real-time RT-PCR 检测器官培养各时间点对照组和加力组兔椎间盘 COLⅡmRNA 表达量()
?
3.3 实验动物术前应用抗凝剂的意义
Lee 等[28]报 道,他们 在进 行绵 羊椎 间盘 体外 器 官培养实验研究时,在处死实验动物前给予抗凝剂肝素,以预防椎间盘器官离体后内部小血管内凝血块形成,使小血块阻止培养液营养物质向椎间盘器官内部扩散。Zhang 等[17]进行兔椎间盘体外器官培养时,在处死实验动物前,每只兔静脉给予 1.3 ml肝素(5000 U/ml),显示离体后的椎间盘器官小血管绝大部分通畅。这被认为是保证椎间盘营养通道的重要措施。本实验中亦采用了上述方法。
3.4 器官模型的营养供给及离体器官肿胀预防措施
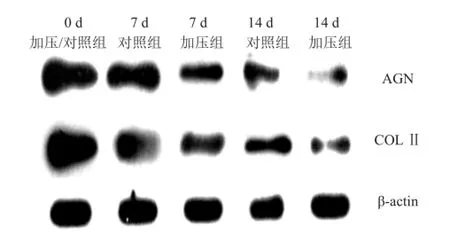
图 5 Western blotting检测器官培养各时间点对照组和加力组兔椎间盘AGN、COLⅡ蛋白表达量
众所周知,椎间盘的营养途径主要是终板软骨途径和纤维环外周通路,营养物质主要以弥散的方式通过椎间盘向其深处渗透[29]。为进一步保证离体后的椎间盘器官有充足的营养供给,除上述采用小型动物椎间盘及动物处死前给予肝素抗凝等措施外,众多学者研究发现,为建立有效的营养物质弥散梯度,培养液内胎牛血清的浓度应该调高[26,30-32]。针对调整的浓度值,各家报道不一,有的调整至14%,有的调整至20%,但多数学者认为浓度调整至20%效果更佳,他们认为20%的胎牛血清浓度既保证了营养物质的弥散梯度,又提高了培养液的渗透压,且有利于减轻器官肿胀。另外,Gawri等[33]通过实验发现保留软骨终板的完整椎间盘整体器官很少出现肿胀,故而认为保留软骨终板对预防离体椎间盘肿胀是行之有效的方法。因而,本研究所使用的培养液将胎牛血清浓度提高至20%,并采用包含有软骨终板的整体椎间盘器官进行培养。
3.5 器官模型的评估指标
HE染色法被广泛用于科研,它可以显示椎间盘各层组织的结构形态,被认为是研究椎间盘组织形态 学的 重要 技术 。Thompson 等[34]和 Sobajima 等[35]通过HE染色观察到退变晚期的椎间盘组织发现纤维环的层状结构紊乱,髓核和纤维环界限不清,髓核由胶冻样组织变成纤维软骨组织,且体积变小,软骨内形 成骨赘,椎间盘出现裂隙 。故而可以认为 IDD 的组织形态学标志是软骨终板钙化,纤维环破裂,软骨下骨赘形成等。本研究亦将HE染色法作为器官模型组织形态学改变的观察方法。本研究结果显示,培养至第7 d,两组均未出现组织形态学改变;培养至第 14 d,两组均出现退变改变。
NBT染色剂可以着色于活细胞的线粒体,且NBT染色可直接加入培养液内与活细胞结合而反映细胞的存活状态;DAPI染色剂能穿过包括活细胞和死亡细胞的所有细胞的细胞膜与DNA 双螺旋结合。Lim等[36]选用 NBT 和 DAPI复染细胞,只被 DAPI单染的细胞视为死亡细胞,而被复染的细胞视为活细胞,通过计算两者比例以观察细胞的存活率。徐宏光等[37]在前期培养大鼠椎间盘体外器官模型研究中亦应用此法计算椎间盘软骨细胞的成活率。本研究应用NBT染色法和DAPI复染法对器官模型进行细胞活性检测。本研究结果显示,对照组培养第 14 d 与 0 d 比较,培养第 7 d 加力组与对照组比较,培养第 14 d 加力组与对照组比较,细胞成活率均有不同程度下降。
椎间盘的功能与其基质的变化密切相关,但对椎间盘基质的研究也是当今的难点所在。器官培养保留了基质内部、细胞间以及细胞与基质间结构的完整性,且是椎间盘细胞生存和代谢的原始环境,利用此模型对 IDD 进行研究具有很大优势[17]。目前较普遍应用于各种基质成分检测的是 Realtime RT-PCR检 测 和 Western-blotting 检测,但各报道的 检 测结果不完全相同。徐宏光等[38]应用此法研究发现颈椎病组原代终板软骨细胞AGN及COLⅡ的表达均低于未发生退变组。Risbud 等[30]运用此法对培养 1 周的Wistar大鼠椎间盘 器 官 AGN、COLⅡ等基质 成 分进行检测发现其表达均有下调,但1周后下调趋势停止,其表达基本保持稳定。Gantenbein 等[28]运用此法对培养的羊椎间盘整体器官基质成分进行检测,AGN、COLⅡ表达均下调。本研究运用此法对两组器官模型在培养各时间点上AGN、COLⅡ表达进行检测,显示对照组第 7 d 的 AGN、COLⅡ表达未出现明显下调,而第 14 d 的表达明显下调。加力组第 7 d及第 14 d 的 AGN、COLⅡ表达均出现明显下调。
3.6 压力刺激对IDD 的影响
Horner和 Urban[27]研究发现,椎间盘可因异常载荷作用而导致细胞死亡及基质代谢紊乱,从而加速IDD的进程。作用于椎间盘的异常载荷有很多种,如牵张力、剪切力和压力等[37],Freement[39]研究发现,压力可致椎间盘细胞能量代谢障碍、细胞增值缓慢、细胞老化、基质合成明显减少以及大量炎性因子分泌等。这些因素均直接诱发椎间盘细胞的生物学行为改变,故而认为压力是导致IDD的重要诱因。目前,压 力刺激引起 IDD 的具体机制尚不明确。Nie 等[40]认为可能是压力刺激致 AGN和COLⅡ的合成以及TGF-β1的分泌受到抑制,加上炎症因子的过度表达,导致细胞能量代谢障碍,诱发椎间盘细胞老化及凋亡;Cassinelli等[41]认为,异常压力刺激使水分从椎间盘组织内部溢出,基质环境受到破坏,椎间盘细胞的存活率明显下降,并出现细胞凋亡。本研究针对器官模型施加预先设定的一定值及周期的CMP载荷,于培养各时间点观察加力组器官模型组织形态学、细胞成活率及AGN、COLⅡ表达变化,以评价CMP载荷对IDD的影响。结果显示,与对照组相比,各时间点加力组器官模型的组织形态学发生退变,细胞成活率下降,AGN、COLⅡ的mRNA和蛋白表达均下调,且加力组器官模型随培养时间的延长退变加重。再次表明异常压力刺激是导致的重要因素。
综上所述,本研究成功建立了短周期的兔椎间盘体外器官模型,所培养的器官模型在1周时间内在大体组织形态学,细胞成活率及基质结构等方面与正常椎间盘保持相似,并在此模型基础上阐明CMP载荷可直接导致椎间盘出现退变样改变,为IDD的研究提供了一个相对理想的模型基础,也为在此基础上进行力学相关性IDD的研究提供一种新的思路。
[1]Xu HG,Zhang XH,Wang H,et al.Intermittent Cyclic Mechanical Tension-Induced Calcification and downregulation of ankh gene expression of end plate chondrocytes.Spine, 2012,37(14):1192-1197.
[2]Antoniou J,Steffen T,Nelson F,et al.The human lumbar intervertebral disc:evidence for changes in the biosynthesis and denaturation of the extracellular matrix with growth, maturation,ageing,and degeneration.J Clin Invest,1996, 98(4):996-1003.
[3]Roughley PJ.Biology of intervertebral disc aging and degeneration involvement of the extracellular matrix.Spine, 2004,29(23):2691-2699.
[4]Lindblom K.Intervertebral-disc degeneration considered as a pressureatrophy.JBoneJointSurgAm,1957,39A:933-945.
[5]Higuchi M,Abe K,Kaneda K.Changes in the nucleus pulposus of the intervertebral disc in bipedal mice.A light and electron microscopic study.Clin Orthop Relat Res,1983, (175):251-257.
[6]Natarajan RN,Ke JH,Andersson GB.A model to study the disc degeneration process.Spine,1994,19(3):259-265.
[7]Wang YJ,Shi Q,Lu WW,et al.Cervical intervertebral disc degeneration induce by unbalanced dynamic and static forc-es:anovelinvivoratmodel.Spine,2006,31(14):1532-1538.
[8]Peng B,Hou S,Shi Q,et al.The relationship between cartilage end~plate calcification and disc degeneration:an experimental study.Chin Med J(Engl),2001,114(3):308-312.
[9]Bian Q,Liang QQ,Wan C,et al.Prolonged upright posture induces calcified hypertrophy in the cartilage end plate in rat lumbar spine.Spine,2011,36(24):2011-2020.
[10]Kroeber MW,Unglaub F,Wang H,et al.New in vivo animal model to create intervertebral disc degeneration and to investigate the effects of therapeutic strategies to stimulate disc regeneration.Spine,2002,27(23):2684-2690.
[11]Unglaub F,Guehring T,Lorenz H,et al.Effects of unisegmental disc compression on adjacent segments:an in vivo animal model.Eur Spine J,2005,14(10):949-955.
[12]Anderson DG,Izzo MW,Hall DJ,et al.Comparative gene expression profiling of normal and degenerative discs:analysis of a rabbit annular laceration model.Spine,2002,27 (12):1291-1296.
[13]Norcross JP,Lester GE,Weinhold P,et al.An in vivo model of degenerative disc disease.J Orthop Res,2003,21(1):183-188.
[14]Scott NA,Harris PF,Bagnall KM.A morphological and histological study of the postnatal development of intervertebral discs in the lumbar spine of the rabbit.J Anat,1980, 130(pt 1):75-81.
[15]Chen WH,Liu HY,Lo WC,et al.Intervertebral discregeneration in an ex vivo culture system using mesenchymal stem cells and platelet-rich plasm.Biomaterials,2009,30(29): 5523-5533.
[16]Haschtmann D,Stovanov JV,Ettinger L,et al.Establishment of a novel intervertebral disc/endplate culture model: nalysis of an ex vivo in vitro whole-organ rabbit culture system.Spine,2006,31(25):2918-2925.
[17]Zhang Y,Phillips FM,Thonar EJ,et al.Cell therapy using articular chondrocytes overexpressing BMP-7 or BMP-10 in a rabbit disc organ culture model.Spine,2008,33(8): 831-838.
[18]Korecki CL,MacLean JJ,Iatridis JC.Characterization of an in vitro intervertebral disc organ culture system.Eur Spine J,2007,16(7):1029-1037.
[19]Roberts S,Menage J,Sivan S,et al.Bovine explant model of degeneration of the intervertebral disc.BMC Musculoskelet Disord,2008,9:24.
[20]Paul CP,Zuiderbaan HA,Zandieh Doulabi B,et al.Simulated-physiological loading conditions preserve biological and mechanical properties of caprine lumbar intervertebral discs in ex vivo culture.PLoS One,2012,7(3):e33147.
[21]Haglund L,Moir J,Beckman L,et al.Development of a bioreactor for axially loaded intervertebral disc organ culture. Tissue Eng Part C Methods,2011,17(10):1011-1019.
[22]吕明,张颖,彭宝淦.椎间盘退变模型研究现状与进展.中国矫形外科杂志,2009,17(23):1804-1806.
[23]Lorin M,Benneker Paul F,Heini Suzanne E,et al.Correlation of radiographic and MRI parameters to morphological and biochemical assessment of intervertebral disc degeneration.Eur Spine J,2005,14(1):27-35.
[24]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-delta delta C(T)).Method,2001,25:402-408.
[25]Adams MA,Freeman BJ,Morrison HP,et al.Mechanical initiation of intervertebral disc degeneration.Spine,2000, 25(13):1625-1636.
[26]Seol D,Choe H,Ramakrishnan PS,et al.Organ culture stability of the intervertebral disc:rat versus rabbit.J Orthop Res,2013,31(6):838-846.
[27]Horner HA,Urban JP.2001 Volvo Award Winner in Basic Science Studies:effect of nutrient supply on the viability of cells from the nucleus pulposus of the intervertebral disc. Spine(Phila Pa 1976),2001,26(23):2543-2549.
[28]Gantenbein B,Grunhagen T,Lee CR,et al.An in vitro organ culturing system for intervertebral disc explants with vertebral endplates:a feasibility study with ovine caudal discs.Spine(Phila Pa 1976),2006,31(23):2665-2673.
[29]Urban J,Smith S,Fairbank J.Nutrition of the intervertebral disc.Spine(Phila Pa 1976),2004,29(23):2700-2709.
[30]Risbud MV,Izzo MW,Adams CS,et al.An organ culture system for the study of the nucleus pulposus:description of the system and evaluation of the cells.Spine(Phila Pa 1976),2003,28(24):2652-2659.
[31]Bayliss MT,Urban JP,Johnstone B,et al.In vitro method for measuring synthesis rates in the intervertebral disc.J Orthop Res,1986,4(1):10-17.
[32]Chiba K,Andersson GB,Masuda K,et al.A new culture system to study the metabolism of the intervertebral disc in vitro.Spine(Phila Pa 1976),1998,23(17):1821-1827.
[33]Gawri R,Mwale F,Ouellet J,et al.Development of an organ culture system for long-term survival of the intact human intervertebral disc.Spine(Phila Pa 1976),2011,36 (22):1835-1842.
[34]Thompson JP,Pearce RH,Schechter MT,et al.Preliminary evaluation of scheme for grading the gross morphology of the human intervertebral disc.Spine(Phila Pa 1976),1990, 15(5):411-415.
[35]Sobajima S,Kompel JF,Wallach CJ,et al.A slowly progress-sive and reproducible animal model of intervertebral disc degeneration characterized by MRI,X-ray,and Histology.Spine(Phila Pa 1976),2005,30(1):15-24.
[36]Lim TH,Ramakrishnan PS,Kurriger GL,et al.Rat spinal motion segment in organ culture:a cell viability study. Spine(Phila Pa 1976),2006,31(12):1291-1297.
[37]徐宏光,章平治,宋俊兴,等.退变大鼠椎间盘器官培养模型的建立及其意义.中国骨与关节外科,2012,5(3):233-237.
[38]徐宏光,彭红心,程加峰,等.人颈椎椎体终板软骨细胞退变模型的建立及意义.中华医学杂志,2011,91(41):2912-2916.
[39]Freement AJ.The cellular pathobiology of the degenerate intervertebral disc and discogenic back pain.Rheumatology,2009,48(1):5-10.
[40]Nie K,Yang SH,Xiong LM,et al.Regulatory effect of nicotinamide on apoptosis and proliferation of rabbit nucleus pulposus cell in vitre.J Clin Rehabil Tissue Eng Res,2008, 12(37):7382-7385.
[41]Cassinelli EH,Hall RA,Kang JD.Biochemistry of intervertebral disc degeneration and the potential for gene therapy applications.Spine J,2001,1(3):205-214.
In vitro organ culture of rabbit degenerative intervertebral disc under cyclic mechanic pressure and its significance*
XU Hongguang1**,ZHANG Pingzhi1,SONG Junxing1,HU Bin1,ZHAO Quanlai1,LV Kun2,ZHONG Min2,ZHANG Mengying2,SUO Qifeng2
(1.Department of Orthopedics;2.Department of CentralLab,Yijishan Hospital,WannanMedicalCollege,Wuhu 241001,Anhui,China)
Organ culture;Cyclic mechanic pressure;Intervertebral disc degeneration
国家自然科学基金(30973025);国家自然科学基金(81272048);安徽省自然科学基金(1308085MH152)
**通信作者:徐宏光,E-mail:xuhg@medmail.com.cn

