头孢曲松钠抗慢性神经病理性痛的作用机制研究
卢丽莉 杨倩 仇艳玲
谷氨酸是中枢神经系统最主要的兴奋性神经递质,参与脊髓水平伤害性信息的传递及痛觉过敏的形成[1]。由于胞外没有谷氨酸的代谢酶,胞外谷氨酸的清除主要依靠谷氨酸转运体[2]。目前已克隆出五种高亲和力谷氨酸转运体 GLAST(EAAT1)、GLT-1(EAAT2)、EAAC1(EAAT3)、EAAT4 和 EAAT5。研究表明,GLT-1在病理性痛和痛过敏的发生和维持中发挥重要作用[2]。2005 年 Rothstein 等[3]报道,β-内酰胺类抗生素(包括青霉素和一些新的衍生物)具有新的功能,其中头孢曲松(Ceftriaxone,Cef)可增加GLT-1的表达和谷氨酸的摄取。但β-内酰胺类抗生素是否会对慢性神经病性疼痛过程产生影响尚未报道。本研究观察β-内酰胺类抗生素Cef对CCI大鼠慢性神经病理性痛过敏的影响,为临床上病理性痛的防治提供新线索与思路。
1 材料与方法
1.1 实验动物 健康雄性Sprague-Dawley大鼠60只,体重(280±20)g,将动物随机分组:Sham组(n=10):仅暴露坐骨神经不进行结扎;CCI组(n=10):行右侧CCI;Cef治疗(Cef therapy)组(n=10):于CCI手术后第7天开始腹腔注射Cef,1次/d,共注射7次。于术前1 天,术后第 1、3、5、7、9、11、14 天测定热缩足反射潜伏期、机械缩足反射阈值。Cef预防(Cef prevention)组(n=10):于CCI手术后当天开始腹腔注射Cef,1次/d,共注射7次。于CCI术前1 d,术后第1、3、5、7天观察热缩足反射潜伏期、机械缩足反射阈值的变化。Cef预防(Cef prevention)组、Cef治疗(Cef therapy)组以相同程序腹腔注射0.9%氯化钠溶液作为对照(NS control)组。
1.2 慢性神经痛模型(CCI)的建立 参照Bennett等[4]的方法制作 CCI模型。大鼠称重后腹腔注射(intraperitoneal injection)10%水合氯醛(300 mg/kg)麻醉,取侧卧位放置。无菌条件下切开右下肢股部皮肤,钝性分离肌肉组织,暴露并轻柔分离坐骨神经,于坐骨神经分成三支前的主干部位处用4-0铬制羊肠线松扎四道,间距为1~2 mm,结扎线的松紧以保证神经的一周均受压,但不影响神经外膜的血运为度。结扎时应引起小腿肌肉轻度颤动。逐层缝合切口,对侧下肢肌内注射庆大霉素(0.2 ml,10 mg/ml)预防感染。Sham组大鼠仅暴右侧坐骨神经但不结扎。
1.3 热缩足反射潜伏期的测定 应用BME-410A型热痛刺激仪(光源为12 V/35 W卤素灯)进行。测痛实验台高36 cm,顶部为2 mm厚的石英玻璃板,将有机玻璃板制成的动物笼(220 mm×220 mm×280 mm,无底,用有机玻璃隔板隔成3个23 cm×11 cm×28 cm的独立空间)置于测痛实验台顶部的石英玻璃板上,将待测动物置于笼内,调节光源与石英玻璃板之间的距离,使落在足底的照射光圈直径5 mm,记录从开始照射至出现缩足逃避反射的时间(s),作为热刺激缩足潜伏期。重复测量5次,同一部位间隔10 min,不同部位间隔5 min,取平均值作为统计数值。如>30 s无反应则停止照射,以免导致大鼠足底组织过热损伤。
1.4 机械缩足反射阈值测定 应用von-Frey纤维机械刺激器进行,该刺激器包括12个不同的刺激强度,分别为 0.09、0.18、0.28、0.52、1.12、3.8、5.5、7.7、10.4、18.2、44 和 61 g。将透明有机玻璃动物笼(规格同上)置于顶部为铁丝网36 cm高的测痛实验台上,将待测大鼠置于笼中。实验者手持von-Frey纤维穿过铁丝网格分别刺激大鼠两侧足底中心部位,刺激强度由小到大,每个强度反复刺激10次(次与次的间隔3~5 s),将出现缩足反应5次以上的强度定为大鼠对机械刺激的反应阈值。如以61 g von-Frey纤维刺激大鼠足底不出现缩足反射,则认为大鼠痛反应迟钝,均以61 g计;机械刺激阈值<0.09 g者均以0.09 g计。
1.5 统计学分析 应用SPSS 11.5统计软件,计量资料以表示,组间应用单因素方差分析(One-Way ANOVA),组内应用配对t检验(paried t-test),P<0.05为差异有统计学意义。
2 结果
2.1 热缩足反射潜伏期 Sham组大鼠手术侧后肢热缩足反射潜伏期在所观测的14 d内均无明显的变化。CCI组大鼠CCI前热缩足反射潜伏期在14 s左右,于CCI后第3天大鼠CCI侧后肢热缩足反射潜伏期开始下降,与Sham组比较明显缩短(P<0.05)。术后第5~7天下降到基础值的55%左右,达最低值,一直持续到所测试的第14天。对照组CCI侧后肢热缩足反射潜伏期与CCI组比较未见明显变化,而Cef预防组大鼠CCI侧后肢热缩足反射潜伏期于CCI后第5天、第7天同对照组比较明显延长(P<0.05)。Cef治疗组CCI侧后肢热缩足反射潜伏期在术后第11天、第14天与对照组比较明显延长(P<0.05)。见表1、图1。
表1 6组大鼠热缩足潜伏期n=10,s,±s
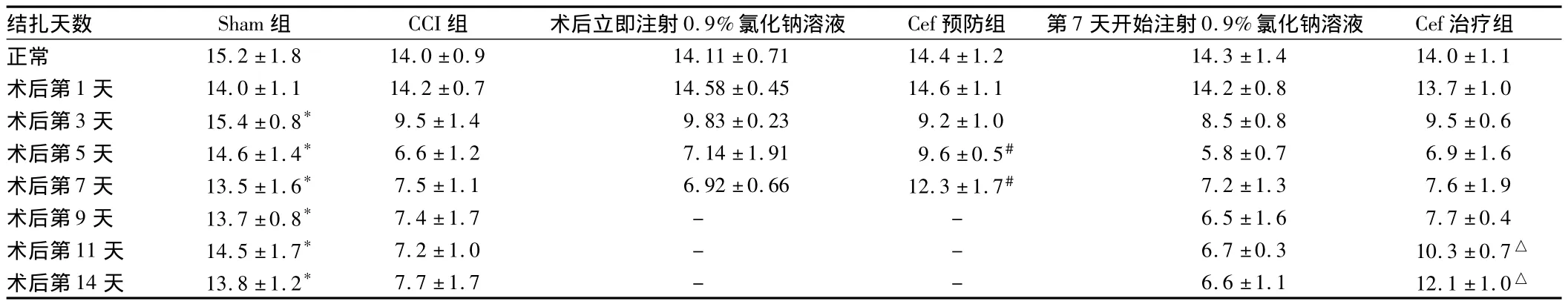
表1 6组大鼠热缩足潜伏期n=10,s,±s
注:与CCI组比较,*P <0.05;与术后立即注射0.9%氯化溶液比较,#P <0.05;与第7天开始注射0.9%氯化钠溶液比较,△P <0.05
结扎天数 Sham组 CCI组 术后立即注射0.9%氯化钠溶液 Cef预防组 第7天开始注射0.9%氯化钠溶液 Cef 治疗组正常 15.2 ±1.8 14.0 ±0.9 14.11 ±0.71 14.4 ±1.2 14.3 ±1.4 14.0 ±1.1术后第1 天 14.0 ±1.1 14.2 ±0.7 14.58 ±0.45 14.6 ±1.1 14.2 ±0.8 13.7 ±1.0术后第3 天 15.4 ±0.8* 9.5 ±1.4 9.83 ±0.23 9.2 ±1.0 8.5 ±0.8 9.5 ±0.6术后第5 天 14.6 ±1.4* 6.6 ±1.2 7.14 ±1.91 9.6 ±0.5# 5.8 ±0.7 6.9 ±1.6术后第7 天 13.5 ±1.6* 7.5 ±1.1 6.92 ±0.66 12.3 ±1.7# 7.2 ±1.3 7.6 ±1.9术后第9天 13.7±0.8* 7.4±1.7 - - 6.5±1.6 7.7±0.4术后第11天 14.5±1.7* 7.2±1.0 - - 6.7±0.3 10.3±0.7△术后第14天 13.8±1.2* 7.7±1.7 - - 6.6±1.1 12.1±1.0△

图1 CCI后热缩足反射潜伏期的变化和腹腔注射Cef及0.9%氯化钠溶液后对CCI后热缩足反射潜伏期的影响
2.2 机械缩足反射阈值 Sham组大鼠手术侧后肢机械缩足反射阈值在所观测的14 d内无明显的变化。CCI 14天组大鼠术前机械缩足反射阈值维持在34.0 g左右,于CCI后第3天CCI侧后肢机械缩足反射阈值开始下降,与Sham组相比有明显降低(P<0.05)。术后第5~7天机械缩足反射阈值下降到基础值的20%左右,持续到所测试的第14天。对照组CCI侧后肢机械缩足反射阈值与CCI组相比未见明显变化,Cef预防组,CCI侧后肢机械缩足反射阈值在术后第7天同对照组相比明显升高(P<0.05)。Cef治疗组CCI侧后肢机械缩足反射阈值在术后第14天同对照组相比明显升高(P<0.05)。见表2、图2。
表2 大鼠机械缩足反射阈值n=10,g,±s
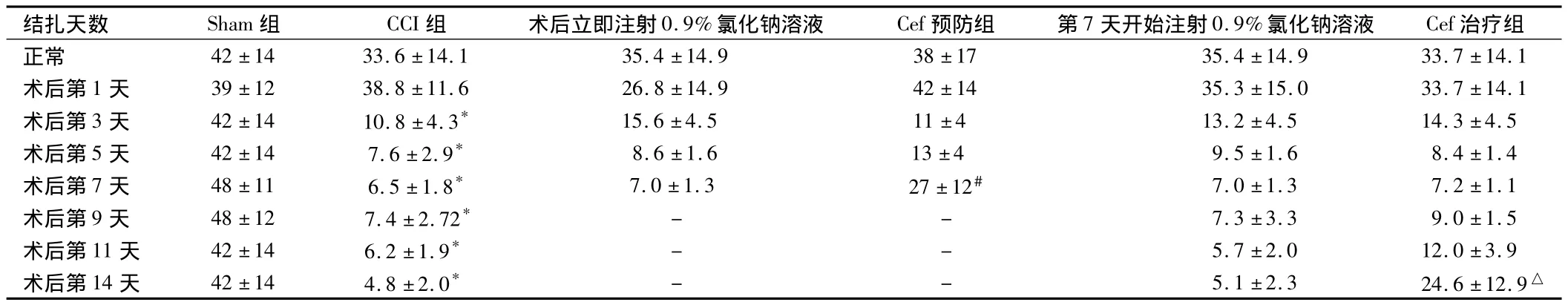
表2 大鼠机械缩足反射阈值n=10,g,±s
注:CCI组比较,*P <0.05;与术后立即注射0.9%氯化钠溶液比较,#P <0.05;与第7天开始注射0.9%氯化钠溶液比较,△P <0.05
结扎天数 Sham组 CCI组 术后立即注射0.9%氯化钠溶液 Cef预防组 第7天开始注射0.9%氯化钠溶液 Cef 治疗组正常 42 ±14 33.6 ±14.1 35.4 ±14.9 38 ±17 35.4 ±14.9 33.7 ±14.1术后第1 天 39 ±12 38.8 ±11.6 26.8 ±14.9 42 ±14 35.3 ±15.0 33.7 ±14.1术后第3 天 42 ±14 10.8 ±4.3* 15.6 ±4.5 11 ±4 13.2 ±4.5 14.3 ±4.5术后第5 天 42 ±14 7.6 ±2.9* 8.6 ±1.6 13 ±4 9.5 ±1.6 8.4 ±1.4术后第7 天 48 ±11 6.5 ±1.8* 7.0 ±1.3 27 ±12# 7.0 ±1.3 7.2 ±1.1术后第9天 48±12 7.4±2.72* - - 7.3±3.3 9.0±1.5术后第11天 42±14 6.2±1.9* - - 5.7±2.0 12.0±3.9术后第14天 42±14 4.8±2.0* - - 5.1±2.3 24.6±12.9△

图2 CCI后机械缩足反射阈值的变化和腹腔注射Cef及0.9%氯化钠溶液后对CCI后机械缩足反射阈值的影响
3 讨论
CCI模型是目前神经病理性疼痛研究中应用最广泛的模型,制作简便、稳定,能较好的模拟临床神经损伤后的痛觉过敏现象[4]。本实验观察到,CCI大鼠术后第1天在坐骨神经结扎侧即可见足趾部卷曲、足外翻、跋行,行走时着地时间明显缩短,足部边缘着地,有明显的后肢保护现象出现。在术后第3天,坐骨神经结扎侧出现痛觉过敏现象,热缩足反射潜伏期和机械缩足反射阈值开始降低,到术后第5~7天达最低值,持续到所测试的第14天。这些变化同文献报道[5]的一致。表明动物出现了病理性痛和痛觉过敏。
谷氨酸是中枢神经系统最主要的兴奋性氨基酸,参与脊髓伤害性信息的传递。由于没有谷氨酸代谢酶,所以胞外谷氨酸的摄取主要靠高效的谷氨酸转运体系统来实现[6,7]。
研究发现,通过连续腹腔注射Cef 7 d后,Cef可通过血脑屏障进入脑和脊髓,可以选择性地诱发编码GLT-1谷氨酸转运体的基因转录,增加GLT-1的脑内表达,并增强其功能活性[3]。本实验观察到腹腔连续注射NS对CCI诱导的热痛敏和机械性痛敏无影响,在CCI大鼠手术后大鼠出现痛觉过敏前,立即腹腔注射Cef 7 d后,发现CCI大鼠CCI侧后肢在术后第5天和第7天热缩足反射潜伏期同NS对照组相比明显延长,但机械缩足反射阈值在术后第7天同对照组相比才明显升高;在CCI大鼠手术后第7天出现痛觉过敏后再连续腹腔注射Cef,注射7天后,发现CCI大鼠CCI侧后肢在术后第11天和第14天热缩足反射潜伏期同NS对照组相比同样明显延长,机械缩足反射阈值在术后第14天同对照组相比才明显升高。因此推测腹腔注射Cef通过使脊髓GLT-1表达增加减轻了CCI诱导的热痛敏和机械性痛敏。谷氨酸转运体在病理性疼痛中起到重要的作用,在不同的病理性疼痛情况下,应用谷氨酸转运体的抑制剂或激动剂后对疼痛可能通过不同的机制产生抑制或增强作用,因此,需要更进一步的研究来探索谷氨酸转运体在病理性疼痛中的作用为病理性疼痛的防治提供新的方法和依据。
1 Faden AI,Demediuk P,Panter SS,et al.The role of excitatory amino acids and NMDA receptors in traumatic brain injury.Science,1989,244:798.
2 Seal RP,Amara SG.Excitatory amino acid transporters:a family in flux.Annu Rev Pharmacol Toxicol,1999,39:431-456.
3 Rothstein JD,Patel S,Regan MR,et al.β-lactam antibiotics offer neuroprotection by increasing glutamate transporter expression.Nature,2005,6:73-77.
4 Bennett GJ,Xie YK.A peripheral mononeuropathy in rat that produces disorder of pain sensation like those seen in man.Pain,1988,33:87-107.
5 Mao J,Sung B,Ji RR,et al.Neuronal apoptosis associated with morphine tolerance:evidence for an opioid-induced neurotoxic mechanism.J Neurosci,2002,22:7650-7661.
6 Robinson MB,Dowd LA.Heterogeneity and functional properties of subtypes of sodium-dependent glutamate transporters in the mammalian central nervous system.Adv Pharmacol,1997,37:69-115.
7 Danbolt NC.Glutamate uptake.Prog Neurol,2001,65:1-105.

