陕北白绒山羊KAP9.2基因腺病毒载体的构建及包装*
徐华荣,郭 杨,赵志东,李 托,张智英,王 昕
(西北农林科技大学动物科技学院陕西省农业分子生物学重点实验室,陕西杨凌712100)
羊绒是由绒山羊次级毛囊产生的底层毛,其生长是一个周期性变化的过程,包括生长期、退行期和休止期[1]。羊绒品质与角蛋白的组成相关,并受角蛋白基因表达的影响。角蛋白基因的表达差异导致不同品种绒山羊的羊绒品质存在明显差异[2]。在绒山羊中存在大量激活和抑制参与皮肤毛囊周期性生长的调控因子[3],其中KAP基因家族角蛋白相关蛋白9.2(KAP9.2)基因在绒山羊皮肤组织中特异性表达,在奶山羊皮肤组织中不表达[4-5]。为进一步研究羊绒周期性生长过程中KAP9.2基因的功能,需构建KAP9.2过表达载体。但是在真核细胞中通常直接转染质粒的效率很低,达不到研究基因功能的目的。本研究以陕北白绒山羊为研究对象,旨在构建KAP9.2基因的重组腺病毒载体,并包装扩增KAP9.2重组腺病毒,为在细胞水平上研究KAP9.2基因功能提供材料和奠定基础。
1 材料与方法
1.1 材 料
1.1.1 质粒与菌体 HEK293人胚肾细胞、NIH3T3细胞、大肠杆菌DH5α、大肠杆菌BJ5183、试验用质粒pAdTrack-CMV和pAdEasy-1均由西北农林科技大学动物基因组学实验室保存。
1.1.2 试剂 限制性内切酶和T4DNA ligase购自DNA ligaseDNA ligaseNEB公司;Taq DNA聚合酶和核酸共沉剂购自TaKaRa公司;质粒DNA提取试剂盒购自OMEGA BIO-TEK公司;DNA凝胶回收试剂盒购自威格拉斯生物技术有限公司;DMEM培养基购自Sigma公司;血清FBS购自Gibco公司;化学试剂为分析纯,购自Sigma公司。
1.2 方 法
1.2.1 pAdTrack-KAP9.2腺病毒穿梭载体的构建及鉴定 外科手术法采集陕北白绒山羊肩胛后缘1×2cm2皮肤组织,干冰保存带回实验室,-80℃冰箱保存。采用酚/氯仿法提取陕北白绒山羊皮肤组织DNA。根据GenBank中山羊KAP9.2基因(GenBank登录号:AY510124)mRNA序列,利用Clone ManagerV7软件,设计KAP9.2基因的特异性扩增引物,由上海博尚生物技术有限公司合成,上游引物Primer F:5'-GGAAGATCTTGAGAAAC TCAGCTCTGAGC-3'下游引物Primer R5'-ACGCGTCGACGTTCTATGACAGGAGGATCA-3'。PCR扩增KAP9.2基因。琼脂糖凝胶电泳检测PCR产物,通过DNA凝胶回收试剂盒进行纯化回收。使用Sal I-HF、Bgl II双酶切回收产物和pAdTrack-CMV载体。连接KAP9.2目的基因和pAdTrack-CMV骨架载体,T4DNA ligase 0.5μL,10×T4DNA ligase Buffer 1.0μL,ddH2O 3.5μL同时设一组空白对照,16℃连接过夜。取5μL连接产物加入至100μL感受态DH5α中,在含有卡那霉素的LB琼脂平板上培养过夜。采用质粒小提试剂盒提取质粒,Sal I-HF和Bgl II双酶切鉴定。选择两个酶切鉴定结果正确的质粒送南京金斯瑞生物科技有限公司测序,测序结果与NCBI公布的KAP9.2序列进行比对。
1.2.2 pAdEasy-KAP9.2重组腺病毒载体的构建及鉴定 使用Pme I线性化测序结果正确的pAdTrack-KAP9.2。试验组取5μL回收产物及1 μL pAdEasy-1共转至100μL感受态BJ5183中,对照组只加5μL回收产物,在含有卡那霉素的LB琼脂平板上培养过夜。挑取试验组平板上5个克隆,提取质粒。使用Pac I酶切鉴定pAdEasy-KAP9.2重组质粒。稀释酶切鉴定结果正确的质粒为模板,PCR扩增KAP9.2基因,扩增鉴定正确的质粒。
1.2.3 重组KAP9.2腺病毒载体线性化病毒包装及扩增 Pac I线性化重组腺病毒载体pAdEasy-KAP9.2。设置5个反应体系,37℃充分反应5h。核酸共沉剂浓缩回收。将回收的线性化产物转染状态良好、融合度70%的HEK293细胞。转染操作按梭华-SofastTM基因转染试剂手册进行。参考AdEsayTM系统[20]所示的方法扩增腺病毒,以达到后续试验所需病毒量。
1.2.4 重组KAP9.2腺病毒滴度测定 采用LaSRT法[6-7]测定KAP9.2腺病毒滴度。
2 结果与分析
2.1 pAdTrack-KAP9.2穿梭载体的鉴定
以陕北绒山羊基因组为模板,PCR扩增获得KAP9.2基因全长CDS,琼脂糖凝胶电泳检测,目的条带为670bp左右(图1),与预期结果一致;将该片段用Sal I-HF和Bgl II酶切后与同样内切酶切割的骨架载体pAdTrack进行连接,获得穿梭载体pAdTrack-KAP9.2;Sal I-HF和Bgl II双酶切检测载体时,获得了长度约为9100bp骨架载体和658bp的KAP9.2片段(图2),与预期结果一致,说明pAdTrack-KAP9.2穿梭载体构建成功。将pAdTrack-KAP9.2载体测序,发现与NCBI中的序列完全匹配,表明pAdTrack-KAP9.2穿梭载体可用于后续的试验研究。
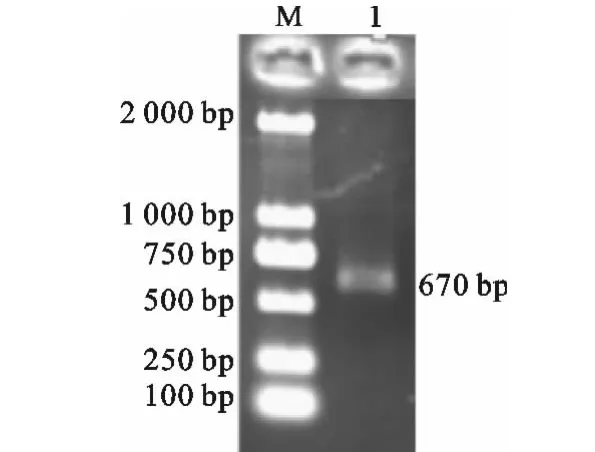
图1 PCR扩增KAP9.2基因M.DL2000DNA Marker;1.回收KAP9.2PCR产物Fig.1 KAP9.2amplified by PCRM.DL2000DNA Marker;1.Gel purification of KAP9.2
2.2 pAdEasy-KAP9.2腺病毒载体的鉴定
使用Pac I酶切鉴定由线性化pAdTrack-KAP9.2与pAdEasy-1重组得到的pAdEasy-KAP9.2质粒,可以得到36 701bp和2 897bp的两个片段(图3)。以pAdEasy-KAP9.2质粒为模板,用扩增KAP9.2基因引物进行PCR检测,获得目的片段约为670bp(图4),说明pAdEasy-KAP 9.2质粒构建成功。

图2 pAdTrack-KAP9.2 Sal I-HF、Bgl II酶切鉴定M.DL2000DNA Marker;1-3.pAdTrack-KAP9.2酶切产物Fig.2 Identification of pAdTrack-KAP9.2vectorM.DL2000DNA Marker;1-3.pAdTrack-KAP9.2 double digested by Sal I-HF and Bgl II
2.3 重组KAP9.2腺病毒载体的线性化、病毒包装、扩增及滴度测定
pAdEasy-KAP9.2腺病毒载体经Pac I线性化后,转染HEK 293细胞,转染后第3d在荧光显微镜下可以观察到有绿色荧光蛋白表达,培养到7d时,接近90%的细胞发出荧光,此时收集的病毒即为第1代病毒液,再反复感染3代后得到病毒滴度为1.34×108GFU/mL的病毒(图5)。
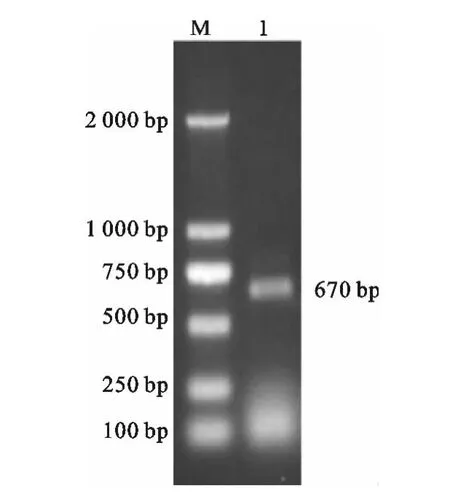
图3 pAdEasy-KAP9.2的酶切鉴定M.λ-HindⅢDNA Marker;1.pAdEasy-KAP9.2使用Pac I酶切线性化后产物Fig.3 Identification of pAdEasy-KAP9.2M.λ-HindⅢDNA Marker;1.pAdEasy-KAP9.2 digested with PacI
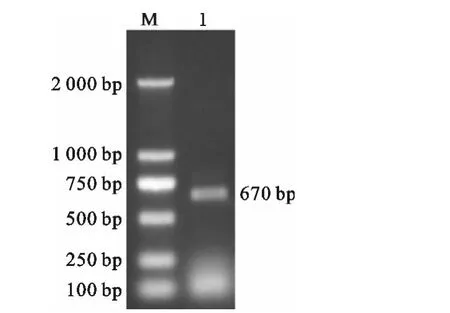
图4 pAdEasy-KAP9.2的PCR鉴定M.DL2000DNA Marker;1.pAdEasy-KAP9.2为模板,PCR扩增KAP9.2基因产物Fig.4 Identification of pAdEasy-KAP9.2by PCRM.DL2000DNA Marker;1.Amplification KAP9.2 from pAdEasy-KAP9.2

图5 腺病毒原液分别稀释103(A)、104(B)、105(C)、106(D)倍后转染NIH3T3细胞48h后绿色荧光的表达Fig.5 Fluorescence microscopic image of NIH3T3transfected by virus diluted by 103(A),104(B),105(C),106(D)times respectively after 48hours
3 讨 论
KAP9.2基因是超高硫(USH)KAPs基因家族中一员,USH角蛋白相关蛋白在毛囊角质层和皮质层均表达[8]。KAP基因家族通过KAP-KAP、KP-KAP、KP-KP相互作用或受其他基因的调控进而对绒毛品质具有重要的影响[9-11]。对陕北白绒山羊和内蒙古白绒山羊KAP6.2基因的研究中发现,该基因在陕北白绒山羊上存在24bp的缺失突变,但是在内蒙古白绒山羊上却没有出现,提示该基因的缺失突变可能是导致陕北白绒山羊羊绒多型性的直接原因[11]。研究发现陕北白绒山羊中KAP9.2基因同样出现了30bp的缺失[13]。有报道发现KAP7.1基因与KAP8.2基因在绒山羊心、肝、肺、脾、肾组织中不表达,仅在皮肤组织中表达[14]。我们发现KAP9.2基因同样仅在绒山羊皮肤组织中表达,在奶山羊中则没有检测到其表达 说明KAP9.2基因的表达具有品种特异性。本课题组研究发现KAP9.2基因对羊绒的生长可能具有抑制作用[15],同时报道了关于KAP9.2的多态性研究,发现在KAP9.2基因586位点存在C/T单核苷酸多态性,而CC基因型的KAP9.2基因相对表达量低于TT基因型,说明该位点C碱基可能成为潜在筛选培育高产绒的绒山羊的参考标准[5]。但是,目前关于KAP9.2基因如何调控毛囊细胞生长发育的机制尚未见报道。因此,为了进一步研究羊绒周期性生长过程中KAP9.2基因的功能,需要构建KAP9.2过表达载体。
本试验选择腺病毒系统来构建KAP9.2过表达载体,是考虑到相对于其它转染媒介腺病毒具有高感染效率,既可以感染非分裂期细胞,也可以感染分裂期细胞,同时属于瞬时感染,不存在基因整合风险,低细胞毒性,减少病毒蛋白表达引起的细胞自身免疫反应,相对于慢病毒其安全性更好,是一种理想的媒介[16]。Mizuguchi等[17]在1998年为优化传统腺病毒重组系统而构建了AdEasyTM系统,采用该系统仅需两步就可以获得重组腺病毒[18-21]。本研究采用该系统顺利完成了整个KAP9.2重组腺病毒包装试验。病毒滴度测定采用了由江千里等建立的“批量快速病毒滴度测定法(LaSRT)”[6-7],该方法简单实用,能够实现快速准确计算出病毒滴度。总之,为研究KAP9.2基因在羊绒周期性生长中的功能,我们以陕北白绒山羊为研究对象,提取皮肤基因组,设计引物扩增KAP9.2基因,构建重组腺病毒载体并包装扩增KAP9.2重组腺病毒,获得了1.34× 108GFU/mL高滴度的病毒颗粒,为在细胞水平研究KAP9.2基因功能提供了支持材料。
[1] Jin M,Xing M X,Li S A.Keratin 26,a novel member of the goat type I keratin gene family[J].Small Ruminant Research,2010,93(1):24-30.
[2] Plowman J E,Bryson W G,Jordan T W.Application of proteomics for determining protein markers for wool quality traits[J].Electrophoresis,2000,21(9):1 899-1 906.
[3] Fuchs E,Merrill B J,Jamora C,et al.At the roots of a neverending cycle[J].Dev Cell,2001,1(1):13-25.
[4] Rogers M A,Langbein L,Praetzel-Wunder,et al.Human hair keratin-associated proteins(KAPs)[J].Int Rev Cytol,2006,251:209-263.
[5] Wang X,Zhao Z D,Xu H R,et al.Variation and expression g g g -ol Rep,2012,39(12):10 525-10 529.
[6] 江千里,王健民,温丽敏,等.批量快速测定法测定标志基因为GFP的重组病毒滴度[J].第二军医大学学报,2002,23(9):1 304-1 305.
[7] 江千里,王健民,江灿,等.经典方法与LaSRT法测定绿色荧光蛋白标记重组病毒滴度的研究[J].第一军医大学学报,2003,23(10):1 101-1 103.
[8] Rogers M A,Langbein L,Winter H,et al.Characterization of a cluster of human high/ultrahigh sulfur keratin-associated protein in genes embedded in the type I keratingene domainon on chromosome 17q12-21[J].J Biol Chem,2001,276:19 440-19 451.
[9] Rogers M A,Langbein L,Praetzel-Wunder S,et al.Characterization and expression analysis of the hair keratin associated protein KAP26.1[J].Br J Dermatol,2008,159(3):725-729.
[10] Kariya N,Shimomua Y,Ito M.Size polymorphisms in the human ultrahigh sulfur hair keratin-associated protein 4,KAP4,gene family[J].J Invest Dermatol,2005,124(6):1 111-1 118.
[11] Rogers M A,Winter H,Langbein L,et al.Characterization of human KAP24.1,a cuticular hair keratin-associated protein with unusual amino-acid composition and repeat structure[J].J Invest Dermatol,2007,127(5):1 197-1 204.
[12] Zhao M,Wang X,Chen H,et al.The PCR-SSCP and DNA sequencing methods detecting a large deletion mutation at KAP6.2locus in the cashmere goat[J].Small Ruminant Research,2008,75(2-3):243-246.
[13] Yu H,Wang X,Chen H,et al.The polymorphism of a novel 30bp-deletion mutation at KAP9.2locus in the cashmere goat[J].Small Ruminant Research,2008,80(1-3):111-115.
[14] Jin M,Wang L,Li S,et al.Characterization and expression analysis of KAP7.1,KAP8.2gene in Liaoning new-breeding cashmere goat hair follicle[J].Mol Biol Rep,2011,38(5):3 023-3 028.
[15] 赵志东,徐华荣,屈 雷,等.羊绒生长期、休止期陕北白绒山羊皮肤组织中KAP9.2和Hoxc13基因的表达[J].西北农林科技大学学报:自然科学版,2012,40(9):24-28.
[16] Negrete A,Ling T C,Lyddiatt A,et al.Production of adenoviral vectors and its recovery[J].Process Biochemistry,2007,42(7):1 107-1 113.
[17] Mizuguchi H,Kay M A.Efficient construction of a recombinant adenovirus vector by an improved in vitro ligation method[J].Human Gene Therapy,1998,9(17):2 577-2 583.
[18] Parks R J,Cummings D T,Evelegh C M.An enhanced system for construction of adenoviral vectors by the two-plasmid rescue method[J].Human Gene Therapy,2000,11(5):693-699.
[19] He T C,Zhou S,Costa L T D.A simplified system for generating recombinant adenoviruses[J].PNAS,1998,95(5):2 509-2 514.
[20] Anderson R D,Haskell R E,Xia H,et al.A simple method for the rapid generation of recombinant adenovirus vectors[J].Gene Therapy,2000,7:1 034-1 038.
[21] Luo J,Deng Z L,Luo X.A protocol for rapid generation of recombinant adenoviruses using the AdEasy system[J].Nat protocols,2007,2:1236-1247.

