温度及光照驯化对南方鲇线粒体代谢补偿调节的影响
闫玉莲 谢小军
(西南大学生命科学学院, 水生生物及水环境研究所, 重庆 400715)
温度及光照驯化对南方鲇线粒体代谢补偿调节的影响
闫玉莲 谢小军
(西南大学生命科学学院, 水生生物及水环境研究所, 重庆 400715)
为了检验在季节驯化中温度和光周期分别对南方鲇(Silurus meridionalis Chen)组织线粒体代谢补偿效应的调节作用, 研究对实验鱼进行了 4个系列的驯化处理: (1)低温等光周期[12.5℃, 12L∶12D, 体重: (186.36 ± 2.77) g]; (2)高温等光周期[27.5℃, 12L∶12D, 体重: (202.80 ± 7.99) g]; (3)短光照中等温[8L∶16D, 20℃, 体重: (284.80 ± 13.47) g]; (4)长光照中等温度[16L∶8D, 20℃, 体重: (283.70 ± 15.60) g], 每组均为24尾鱼。驯化8周后取样, 测定了各驯化组鱼体心脏、肝脏和肾脏的器官质量(器官指数), 以及这3种器官组织线粒体在测定温度为12.5℃、20℃和27.5℃时的呼吸率和细胞色素C氧化酶(CCO)活性。结果显示, 在等光周期条件下, 低温驯化组(12.5℃, 12L∶12D)实验鱼的心脏、肝脏和肾脏的器官指数均显著高于高温驯化组(27.5℃, 12L∶12D); 在中等温度条件下不同光照处理的实验鱼之间器官指数无显著差异。在中等温度条件下短光照驯化组(8L∶16D, 20℃)鱼体的心脏、肾脏和肝脏组织线粒体呼吸率和CCO活性均显著高于长光照组(16L∶8D, 20 ℃); 而在等光周期条件下的不同温度驯化并没引起这3种组织线粒体的呼吸率和CCO活性的明显差异。综合认为: 在季节驯化过程中, 光周期改变是引起线粒体代谢能力的主要因素, 温度变化则是调整器官组织重量的主要因素, 光周期与温度对南方鲇线粒体代谢机制的调整具有协同作用。
温度驯化; 光周期; 线粒体; 南方鲇
将食物转化为细胞可利用的能量是动物生存的首要条件, 线粒体为细胞内利用氧并产生能量(ATP)的主要场所, 机体生命活动所需能量的 80%以上来自线粒体[1,2]。为了维持细胞功能, ATP的生产必须要与能量消耗过程中ATP的利用相匹配, 才能维持机体的生存[3]。已有研究表明, 线粒体中的电子传递链及氧化磷酸化过程的代谢模式是高度保守的, 对于环境变化的任何适应性反应都应当是对其量值的调节, 而不是对代谢途径或模式的更新[4,5]。当环境温度条件发生改变时, 鱼体线粒体生产ATP的速率将随之调控以保持动物生理功能的相对稳定[5], 因此, 线粒体代谢途径随环境因子变化的调节能力就决定了该物种在环境变化中的适应性。代谢水平这种适应性的调整称为代谢补偿效应, 由环境因子的季节变动而诱导代谢补偿效应产生的过程称为季节驯化。
在自然条件下的季节转换过程中, 温度和光周期的改变紧密伴随, 是调控动物代谢能力的两个重要因素[6—8]。有关这两个生态因子变化分别对动物代谢补偿的驯化作用及其协同效应的报道多见小型哺乳动物[9,10], 而有关外温动物的研究资料十分匮乏。鱼类是外温动物, 由于缺乏稳定体温的调节机制, 鱼体对影响ATP生产的任何一个环境因素都会尤其敏感, 鱼类是研究脊椎动物线粒体代谢对环境因子的适应性特性以及形成这一特征的进化过程的模式种类[11]。
在以往有关温度驯化对鱼类线粒体代谢影响的研究中, 多采用两条实验技术路线: 一种是在实验室条件下, 设定不同温度对实验动物进行一定时期(几周或者几个月)的驯化处理, 然后对处理后的动物组织取样。在此期间, 温度是唯一的控制变量, 光周期在温度驯化组之间并无差异[12,13]。另一种则是将鱼体置于自然环境温度和光周期条件下, 在不同季节分别取样。检测并比较不同样本的代谢能力及其相关的生理生化指标, 从而探讨各类实验条件所产生的驯化效应[14,15]。比较已有实验研究的结果可以看出, 单一的温度因子驯化所产生的代谢补偿效应要小于季节驯化所产生补偿效应的强度[16—18]。因此有必要探讨光周期环境因子在季节驯化中的作用及其与温度的协同效应, 为阐明鱼体代谢补偿调节机理提供基础资料。
南方鲇(Silurus meridionalis Chen)是中国的特有鱼类, 广泛分布于长江流域及其以南地区, 该区域水体温度季节波动的变幅达20℃以上。我们前期研究发现, 南方鲇在不同季节条件下, 其心脏、肾脏和肝脏线粒体在代谢能力或器官质量上均存在差异,表现出了代谢补偿效应[19]。本实验采用该种鱼这3种器官的组织为实验材料, 在人工控制光照和环境温度条件下, 分别测定温度和光周期因子驯化对南方鲇心脏、肾脏和肝脏线粒体的代谢补偿效应的影响, 以检验温度与光周期在该种鱼线粒体代谢机制的调整中各自的驯化效应及其协同作用。
1 材料与方法
1.1 实验鱼来源与驯化处理
实验在西南大学水生生物及水环境研究所试验渔场进行, 采用人工繁殖获得南方鲇幼鱼作为实验对象。驯化处理前饲养于的实验养殖系统内, 以鲜活的泥鳅(Misgurnus anguillicaudatus)切成碎块作为饵料, 每两天投喂一次, 达饱足; 养殖期间水温变幅为(12—20), ℃ 光周期变幅为10L∶14D—14L∶10D。实验开始后将实验鱼分成4组分别移入室内水族箱, 进行了4个系列的实验处理: (1)低温等光周期(12.5℃, 12L∶12D)驯化组[体重: (186.36 ± 2.77) g,体长: (26.29 ± 0.18) cm, 24尾鱼], 即光周期为L∶D = 12h∶12h, 瞬时开断; 水温控制在(12.5±0.5)℃。(2)高温等光周期(27.5℃, 12L∶12D)驯化组[体重: (202.80 ± 7.99) g, 体长: (28.16 ± 0.38) cm, 24尾鱼]。(3)短光照中等温度(8L∶16D, 20℃)驯化组[体重: (284.80 ± 13.47) g, 体长: (32.45± 0.46) cm, 24尾鱼]。(4)长光照中等温度(16L∶8D, 20 )℃ 驯化组[体重: (283.70 ± 15.60) g, 体长: (32.09 ± 0.62) cm, 24尾鱼]。以上4组分别简称为: 低温组 (Cold group)、高温组 (Warm group)、短照组 (Short day-length group)、长照组 (Long day-length group)。
各组驯化处理持续时间均为8周。实验驯化期间,以鲜活的泥鳅切成碎块作为饵料, 每两天投喂一次,达饱足。实验鱼处死前禁食, 低温驯化组实验鱼禁食7d, 中温驯化组实验鱼禁食5d, 高温驯化组实验鱼禁食3d, 使取样时的试验鱼体刚进入空腹状态[20]。
1.2 组织线粒体制备
1.3 组织线粒体呼吸率的测定
采用液相氧电极(Clarke-type, Oxygraph Electrode System; Hansatech公司)分别在12.5、20和27.5℃下测定肝脏组织线粒体呼吸率, 每个温度梯度的样本量为8。反应液总体积为2 mL。先往反应室中加入1.9 mL呼吸缓冲液D (225 mmol/L 蔗糖, 50 mmol/L Tris, 5 mmol/L MgCl2⋅6H2O, 1 mmol/L EDTA, 5 mmol/L 琥珀酸, 15 mmol/L KH2PO4, pH 7.4), 待基线平稳后, 加入100 μL的线粒体悬浮液, 此时测得的耗氧率为线粒体状态2呼吸率。然后用微量注射器将5 μL的100 mmol/L ADP(终浓度0.25 mmol/L)加入反应室, 此后的耗氧率会明显上升, 此时为线粒体状态3呼吸率, 即线粒体的最大耗氧率。此状态持续一段时间后, 耗氧率随着ADP的消耗而逐渐下降, ADP耗尽后的耗氧率则为状态4呼吸率[10]。状态3与状态4呼吸率的比值称作线粒体呼吸控制率(RCR), 用于表征线粒体呼吸的偶联程度。
1.4 组织线粒体细胞色素C氧化酶(CCO)活性测定
采用液相氧电极分别在12.5、20和27.5℃下测定CCO活性, 每个温度梯度的样本量为8。反应液总体积为2 mL。先往反应室中加入1.98 mL缓冲液(7.5 mmol/L KH2PO4, 3.75 mmol/L抗坏血酸, 0.3 mmol/L2HCl-四甲基对苯二胺, pH 7.4, 其中抗坏血酸为氧化底物), 待基线斜率稳定后, 用微量进样器将 10 μL线粒体悬浮液和10 μL的30 μmol/L细胞色素C加入反应室, 此后的耗氧率会明显上升, 测出稳定的最大耗氧率[10]。
1.5 线粒体蛋白含量测定
线粒体蛋白含量用福林酚法[21]测定, 以牛血清蛋白作标准, 以酶标仪(SPECTRA MAX190, Molecular devices)在500 nm波长下的吸光度(OD)值绘制标准曲线, 再根据标准曲线估算出样本的线粒体蛋白的含量。
1.6 数据处理方法
2008年5月中旬,乌梁素海明水区域大量暴发黄藻,最盛时发生面积达 8万余亩(0.533万 hm2),超过明水面积的1/3。2009年5月下旬乌梁素海再次发生黄藻并迅速蔓延,最大面积达 1.6 万亩(0.107 万 hm2),对生态环境造成极大危害,引起国家有关部门高度重视。经调研监测分析,这是乌梁素海特殊气候条件、湖区水体水质、人类生产生活活动等多方面原因共同导致的结果。其根本原因是特殊气候条件下水体富营养化程度不断增高所致。监测结果见表1。
每份线粒体提取液的呼吸率、CCO活性及蛋白含量的测定均重复 2次, 两次所得数据偏差若超过2%, 则增加重复测定次数, 选择偏差在 2%以内的两个测量值取其平均数作为测定结果。采用单位线粒体蛋白重量的耗氧率[nmol O2/(min·mg)]表示线粒体呼吸率及CCO活性。利用公式: 器官指数=(器官重量/体重), 分别计算了南方鲇的心脏、肾脏和肝脏器官指数。采用 Excel(2003)、SPSS(11.5)软件进行数据的整理及统计分析, 数据用(平均值 ± 标准误差)表示。采用独立样本 t 检验比较相同测定温度下两温度驯化组之间及两光周期驯化组之间的数据差异, 以 P < 0.05作为数据均值差异达到显著性的标准。
2 结果
2.1 各器官组织的相对重量
在等光周期条件下, 低温驯化组实验鱼的心脏、肾脏和肝脏的器官指数(即: 器官重量占体重的百分比)分别为0.07、0.56和2.49, 高温驯化组以上3种组织的器官指数则分别为0.06、0.37和0.86, 统计结果表明, 低温驯化组的各种器官指数均显著高于高温驯化组(P < 0.05); 在中等温度条件下, 不同光周期处理的实验鱼之间其器官指数无显著差异(P>0.05)(表1)。
2.2 组织线粒体蛋白含量
实验鱼的心脏、肾脏和肝脏组织的线粒体蛋白含量在4个驯化组之间均无显著性差异(表1)。
2.3 线粒体呼吸率
当测定温度在12.5、20和27.5℃时, 低温等照驯化组实验鱼的心脏、肾脏和肝脏组织线粒体状态3呼吸率[nmol O2/ (min·mg)]均高于高温等照驯化组在相同温度条件下的测得值, 但只有心脏在12.5和27.5℃条件下, 该指标在两个温度驯化组之间的差异达到显著(P<0.05)(表2); 在相同测定温度条件下,这 3种的组织线粒体状态 4呼吸率[nmol O2/ (min·mg)]在两个不同温度驯化组之间也无显著性差异(表3)。在各测定温度条件下, 短光照驯化组实验鱼的各组织线粒体状态3呼吸率和状态4呼吸率均分别高于长光照驯化组, 统计检验表明, 各个测定温度的状态3呼吸率在两个不同光照驯化处理组之间的差异均达到显著(P < 0.05)(表2和表3)。在各测定温度条件下, 所有实验鱼以上 3种组织线粒体呼吸的RCR值均在4以上(表4)。
2.4 CCO活性
在12.5、20和27.5℃温度条件下, 心脏、肾脏和肝脏脏组织线粒体CCO活性[nmol O2/ (min·mg)]在等光周期不同驯化温度组之间的差异均不显著;但短光照中温驯化组实验鱼这种3种组织的CCO活性在各个测定温度下则显著高于长光照中温组(P<0.05)(表5)。
3 讨论
一些鱼类经过季节或温度驯化后会改变其组织线粒体的数量, 如低温(5℃)下驯化的条纹狼鲈(Morone saxatili)氧化肌中线粒体数量增加了 50%[22], 经过冷驯化的欧洲鲫鱼(Carassius carassius)肌肉线粒体的量也明显提高[23]。一些研究者采用组织线粒体蛋白含量作为表征组织线粒体含量的指标[24,25], 本实验也采用了这样方法的进行比较, 结果发现南方鲇心脏、肾脏和肝脏组织中线粒体蛋白含量在不同温度驯化组、不同光周期组之间均无显著性差异(表1),表明温度与光周期因子的分别驯化均不对该种鱼组织线粒体数量的增殖产生诱导作用。结合已有文献报道[22—25], 我们认为在季节驯化过程中, 诱导鱼体组织线粒体数量补偿效应的环境因子在不同鱼类中可能存在种间差异。
在实验室控制条件下, 单一温度因子的低温驯化可不同程度地增强鱼体组织线粒体的氧化能力[12,18],有研究提出, 温度在季节驯化过程中对鱼类代谢能力的调节起着决定性的作用, 光周期对其影响甚微[26]。但也有研究发现, 高温(夏季气候特征)条件下的短光周期(冬季气候特征)驯化依然会引起鱼体肌肉线粒体氧化能力的增强[9,15], 因此Martin, et al.[15]提出光周期对鱼体组织线粒体代谢能力的补偿调控起到了主导作用。本实验结果显示, 在恒定光周期条件下, 低温驯化引起南方鲇鱼体的肾脏和肝脏组织线粒体代谢能力(状态3呼吸率及CCO活性)的增强效应却并不显著(表 2和表 5); 但不同光照时间的驯化对该种鱼组织线粒体的氧化能力的调整作用反而十分明显。经短光照驯化后鱼体的心脏、肾脏和肝脏组织线粒体代谢能力均显著增强。我们有关南方鲇的观察结果支持Martin, et al.[15]的观点。
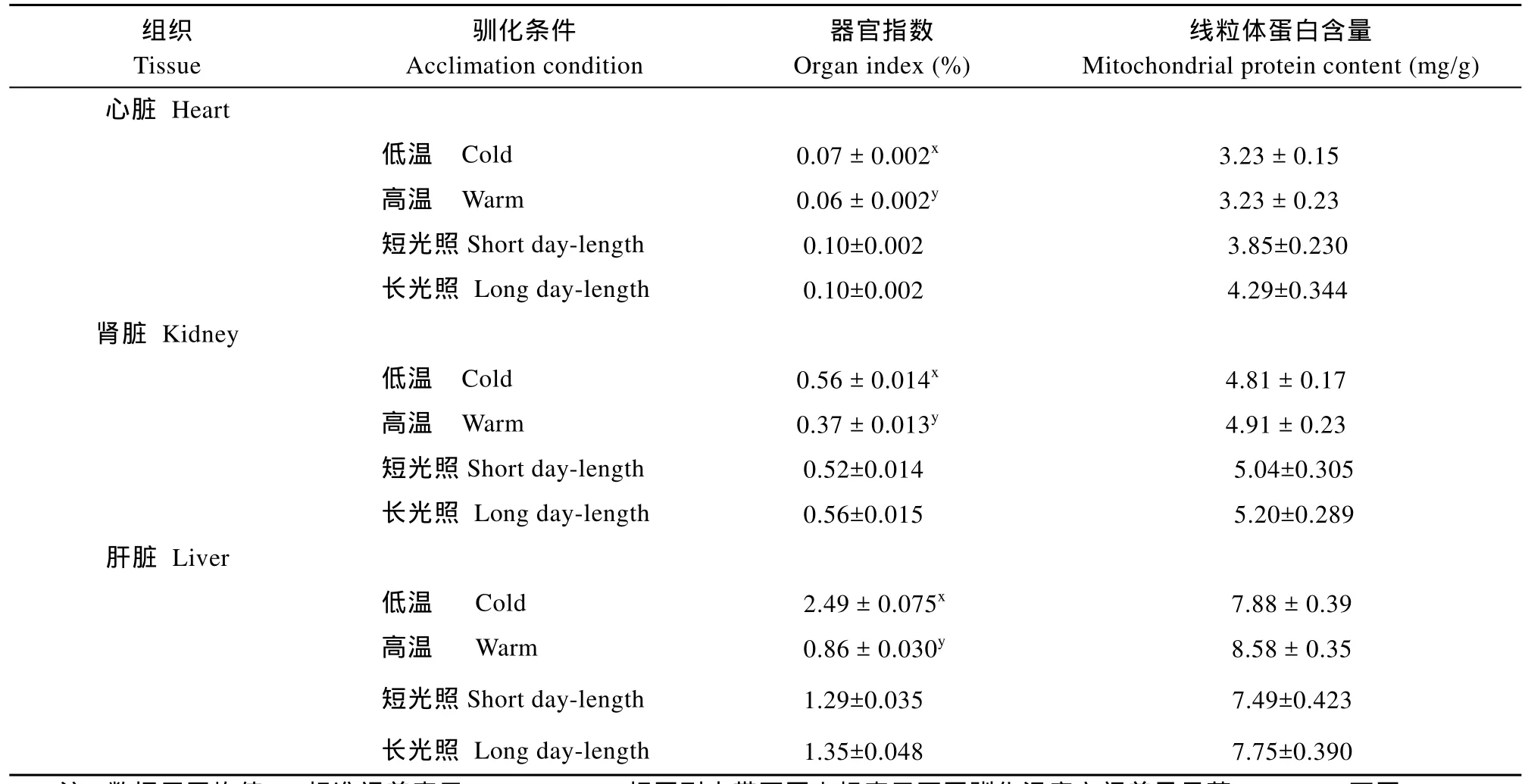
表1 不同驯化条件对南方鲇不同组织的器官指数和线粒体蛋白含量的影响Tab.1 Effects of acclimation condition on organ index and mitochondrial protein contents in various tissues of Silurus meridionalis
也有研究发现, 一些鱼体在经过长时间的温度驯化或季节驯化过程后, 会调整某些器官组织的相对重量, 即在低温驯化或冬季条件下鱼体器官指数增加, 使其器官组织中总体的线粒体数量增多, 从而提高整个器官的线粒体总耗氧率[24,28]。我们的实验结果表明, 在季节驯化过程中, 温度驯化是南方鲇器官重量变化的主要诱导因素, 而不同光周期处理并没有引起该种鱼各器官指数的变化。这一现象与内温动物的研究结果并不一致, 已有报道发现光周期是诱导其器官重量季节性变化的主要因素, 短光照成为启动器官重量增加的调节信号。如: 短光照可提高棉鼠(Sigmodon hispidus)[28]、高原鼠兔(Ochotona curzoniae)和根田鼠(Microtus oeconomus)[29]等物种的褐色脂肪组织和肝脏的重量; 短光照驯化组白头鹎(Pycnontus sinensis)的肝脏重量显著高于长光照组个体[30]。这表明, 季节驯化过程中启动外温动物和 內温动物器官重量调节的诱导因子可能存在差异, 而引起这种差异的机理则有待于进一步的研究予以验证。
对相同鱼种在不同驯化处理条件下的结果进行比较发现, 经季节驯化的鱼体代谢补偿效应比单一因子(温度或者光周期)驯化所产生的补偿效应更明显[16,18]。器官水平的代谢补偿调节主要有3条途径: (1)改变单位组织所含线粒体的数量; (2)改变单个线粒体的氧化能力; (3)改变器官组织的总质量, 从而改变器官组织所含线粒体的总量[24,31]。本研究的结果表明, 温度因子驯化主要对器官的质量进行调整,光周期因子的驯化主要改变线粒体代谢能力。在夏季向冬季渐进变化的自然环境中, 温度因子和光周期因子是由夏季的高温长光照向冬季的低温短光照改变, 即向着增加器官总质量并提高线粒体氧化能力的趋势协同调整, 从而提高器官的线粒体总耗氧率, 因此器官水平上所产生的代谢补偿效应就更为显著。
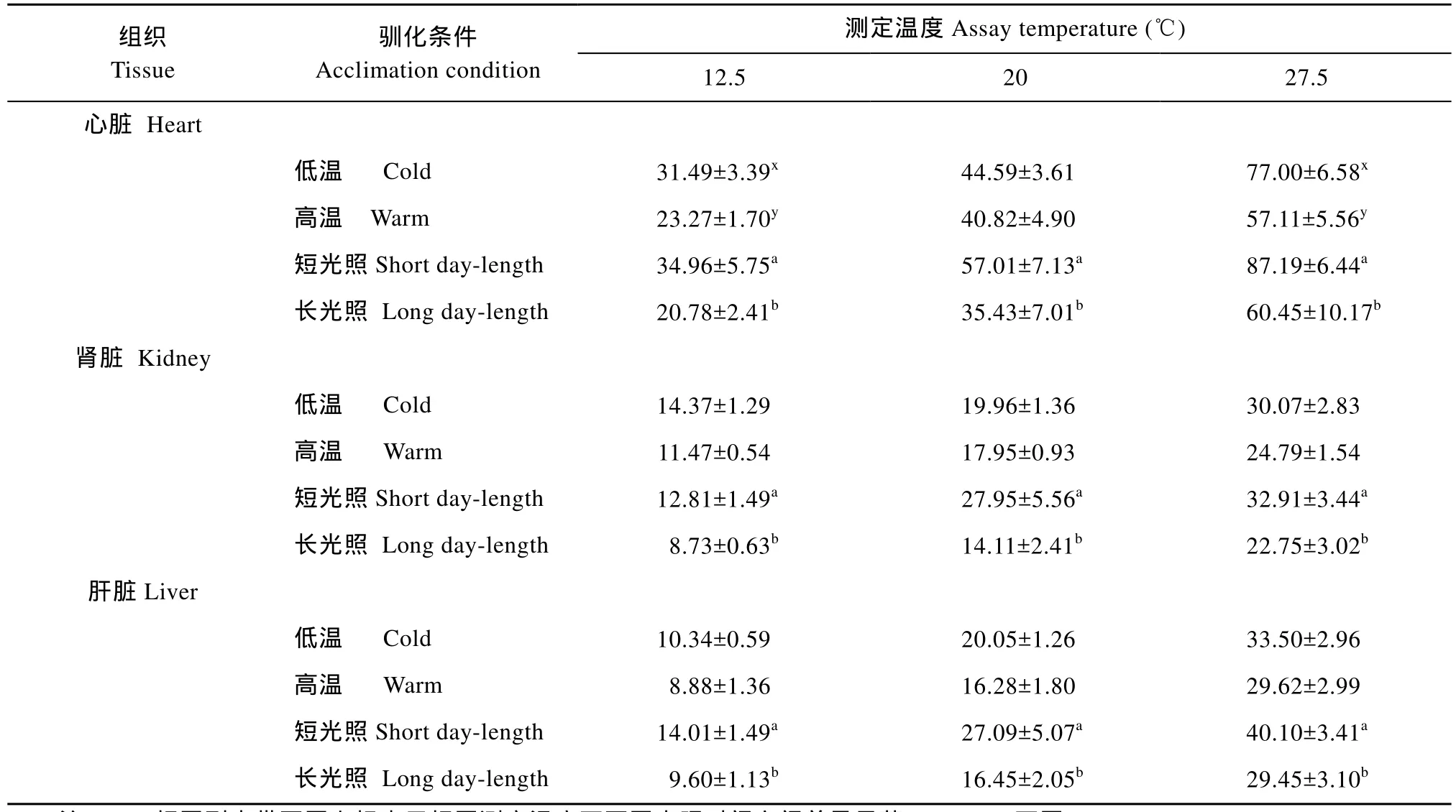
表2 不同驯化条件对南方鲇不同组织线粒体状态3[nmol O2/(min·mg)]呼吸率的影响Tab.2 Effects of acclimation condition on state 3 respiration rates [nmol O2/(min·mg)] of mitochondria isolated from various tissues of Silurus meridionalis
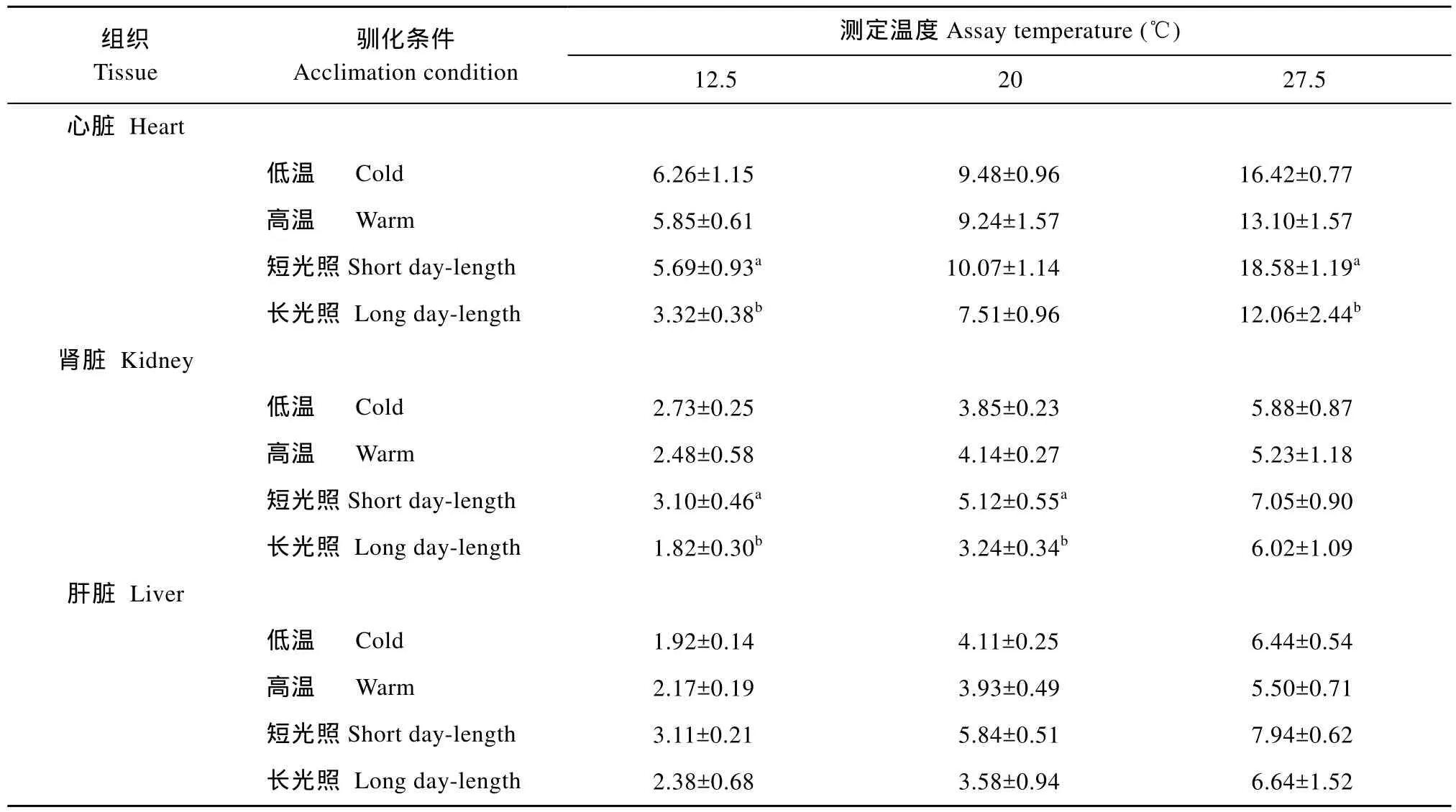
表3 不同驯化条件对南方鲇不同组织线粒体状态4[nmol O2/ (min⋅mg)]呼吸率的影响Tab.3 Effects of acclimation condition on state 4 respiration rates [nmol O2/ (min⋅mg)] of mitochondria isolated from various tissues of Silurus meridionalis
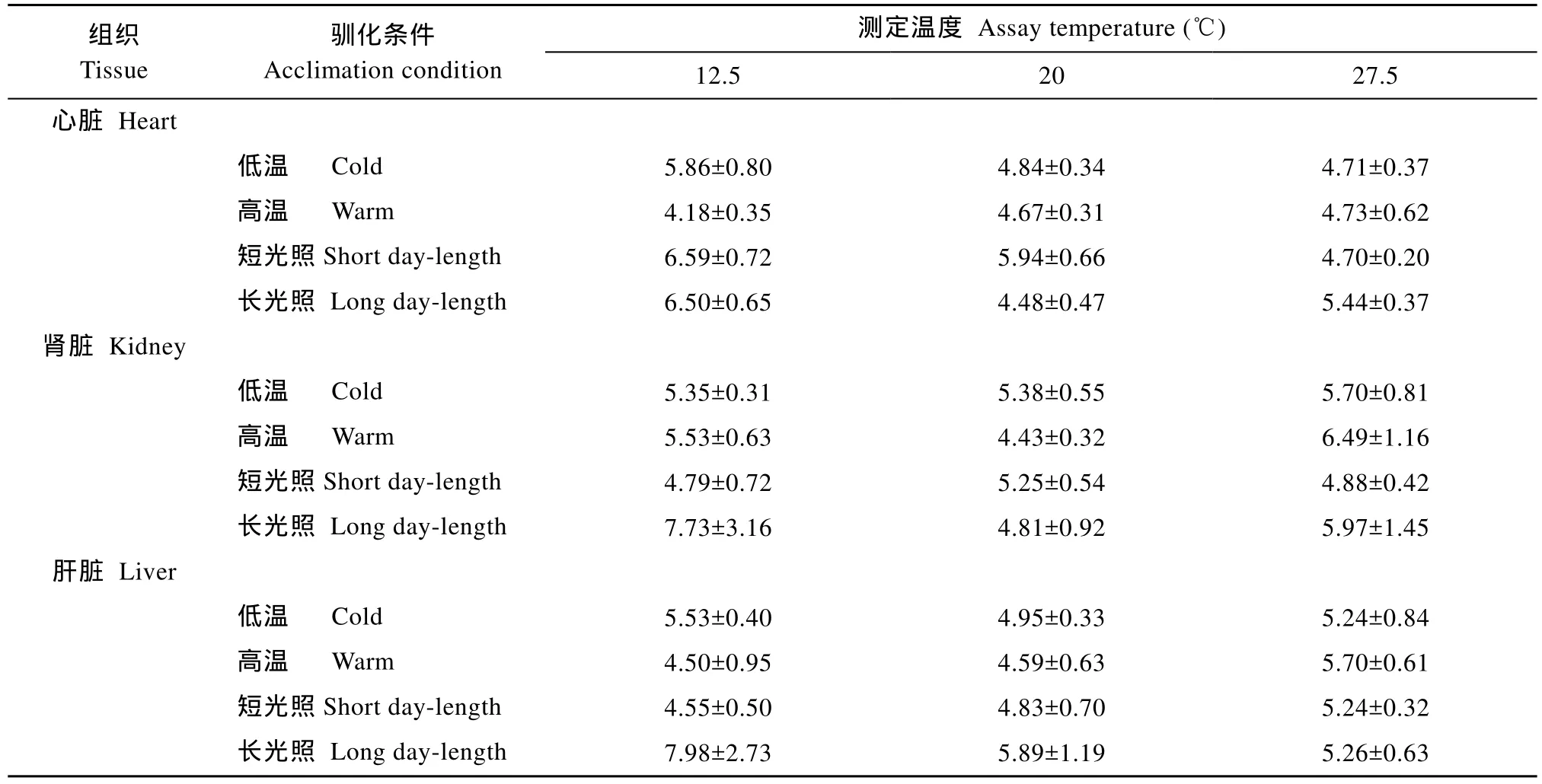
表4 不同驯化条件对南方鲇各组织线粒体呼吸RCR值的影响Tab.4 Effects of acclimation condition on the value of RCR for mitochondrial respiration in various tissues of Silurus meridionalis
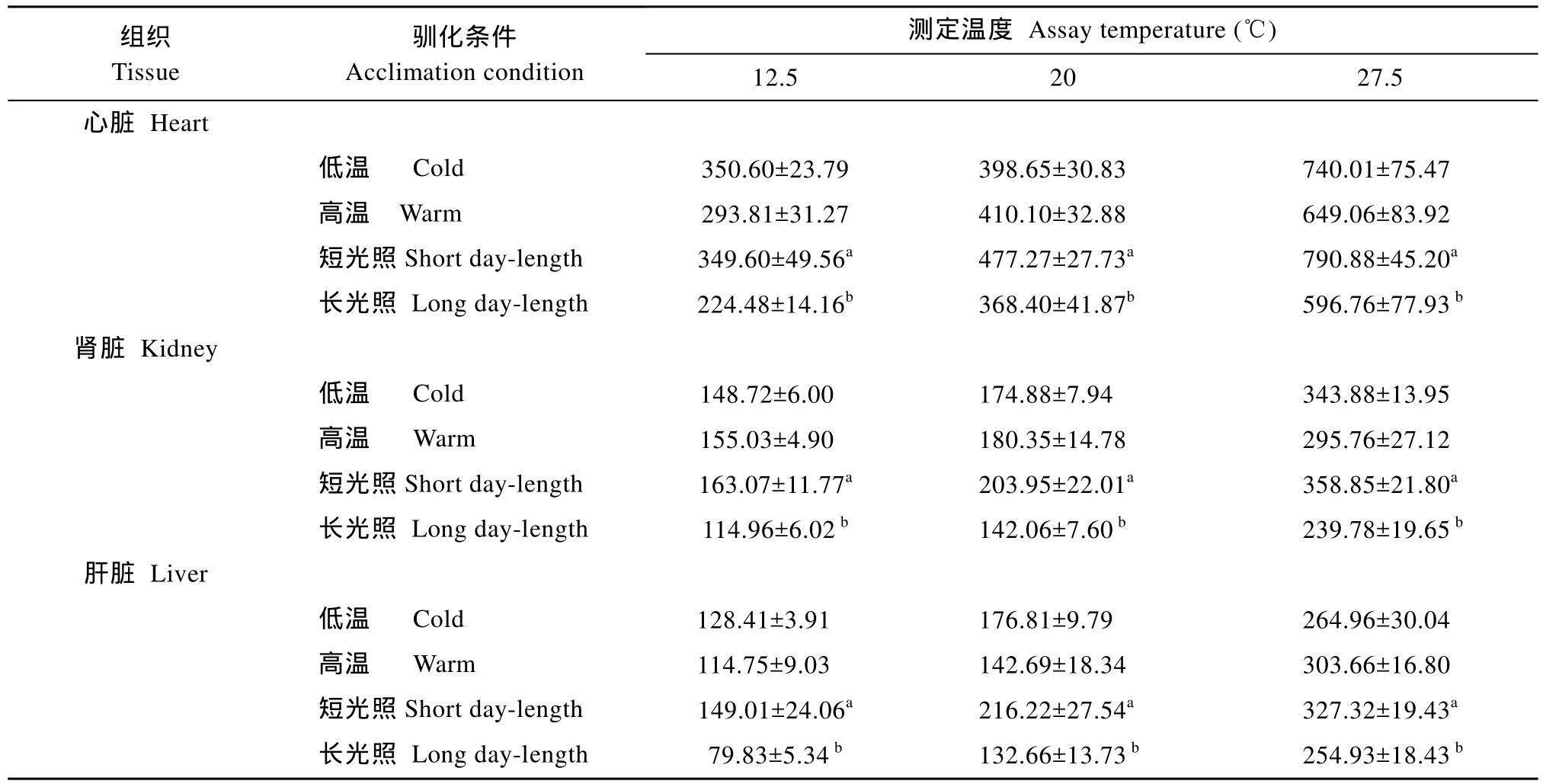
表5 不同驯化条件对南方鲇不同组织线粒细胞色素C氧化酶(CCO)活性[nmol O2/ (min·mg)]的影响Tab.5 Effects of acclimation condition on enzymatic activity of cytochrome c oxidase [nmol O2/ (min·mg)] for various tissues from Silurus meridionalis
综上所述, 在季节驯化过程中, 光周期改变是启动南方鲇组织线粒体代谢能力调整的主要因素,温度变化则是影响该种鱼器官组织重量(器官指数)的主要因素。在鱼体经由夏季的高温且长光照的自然条件向冬季的低温且短光照条件的驯化过程中,靶器官的组织总量及其线粒体代谢能力会同步提升, 从而增强器官总体代谢补偿的效应。因此, 光周期与温度对南方鲇线粒体代谢机制的调整具有协同作用。
[1] Guderley H, St-Pierre J. Going with the flow or life in the fast lane: contrasting mitochondrial responses to thermal change [J]. Journal of Experimental Biology, 2002, 205: 2237—2249
[2] Moyes C D, Hood D A. Origins and consequences of mitochondrial variation [J]. Annual Review of Physiology, 2003, 65: 177—201
[3] Hulbert A J, Else P L, Membranes as possible pacemakers of metabolism[J]. Journal of Theoretical Biology, 2000, 199: 257—274
[4] Koch L G, Britton S L. Aerobic metabolism underlies complexity and capacity [J]. Journal of Physiology, 2008, 586: 83—95
[5] Seebacher F, Murrau S A, Eles P L. Thermal acclimation and regulation of metabolism in a retile (Crocodylus porosus): the importance of transcriptional mechanisms and membrane composition [J]. Physiological and Biochemical Zoology, 2010, 82: 766—775
[6] Day N, Butler P J. The effects of acclimation to reversed seasonal temperature on the swimming performance of adult brown trout Salmo trutta [J]. Journal of Experimental Biology, 2005, 208: 2683—2692
[7] Bradshaw W E, Holzapfel C M. Evolution of animal photoperiodism [J]. Annual Reviews of Ecology, Evolution and Systematics, 2008, 38: 1—35
[8] Auld J R, Agrawal A A, Relyea R A. Re-evaluating the costs and limits of adaptive phenotypic plasticity [J]. Proceedings of the Royal Society of London Series B -Biological Sciences, 2009, 277: 503—511
[9] Peacock W L, Kr l E, Moar K M, et al. Photoperiodic effects on body mass, energy balance and hypothalamic gene expression in the bank vole [J]. Journal of Experimental Biology, 2004, 207: 165—177
[10] Zhao Z J, Wang D H. Short photoperiod enhances thermogenic capacity in Brandt’s voles [J]. Physiology & Behavior, 2005, 85: l43—l49
[11] Guderley H. Metabolic responses to low temperature in fish muscle [J]. Biological Reviews, 2004, 79: 409—427
[12] Kraffe E, Marty Y, Guderley H. Changes in mitochondrial oxidative capacities during thermal acclimation of rainbow trout, Oncorhynchus mykiss: roles of membrane proteins, phospholipids and their fatty acid compositions [J]. Journal of Experimental Biology, 2007, 210: 149—165
[13] Fangue N A, Richards J G, Schulte P M. Do mitochondrial properties explain intraspecific variation in thermal tolerance?[J] Journal of Experimental Biology, 2009, 212: 514—522
[14] Guderley H, St-Pierre J, Couture P, et al. Plasticity of the properties of mitochondria from rainbow trout red muscle with seasonal acclimatization [J]. Fish Physiology and Biochemistry, 1997, 16: 531—541
[15] Martin N, Kraffe E, Guderley H. Effect of day length on oxidative capacities of mitochondria from red muscle of rainbow trout (Oncorhynchus mykiss) [J]. Comparative Biochemistry and Physiology-Part A, 2009, 152: 599—603
[16] St-Pierre J, Charest P M, Guderley H Relative contribution of quantitative and qualitative changes in mitochondria to metabolic compensation during seasonal acclimatisation of rainbow trout, Oncorhynchus mykiss [J]. Journal of Experimental Biology, 1998, 201: 2961—2970
[17] Guderley H, St-Pierre J. Seasonal cycles of mitochondrial ADP sensitivity and oxidative capacities [J]. Journal of Comparative Physiology B, 1999, 169: 474—480
[18] Bouchard P, Guderley H. Time course of the response of mitochondria from oxidativemuscle during thermal acclimation of rainbowtrout, Oncorhynchus mykiss [J]. Journal of Experimental Biology, 2003, 206: 3455—3465
[19] Yan Y L. The metabolic compensation in the southern catfish (Silurus meridionalis Chen) during seasonal acclimatization [D]. Thesis for Doctor of Science. Southwest University, Chongqing. 2011 [闫玉莲. 南方鲇适应季节温度变化的代谢补偿的研究. 博士学位论文,西南大学, 重庆. 2011]
[20] Xie X J, Sun R Y. The bioenergetics of southern catfish (Silurus meridionalis Chen): I Resting metabolic rate as a function of body weight and temperature [J]. Physiological Zoology, 1990, 63: 1181—1195
[21] Lowry H, Rosbrough J, Farr A L, et al. Protein measurement with the Folin phenol reagents [J]. Journal of Biological Chemistry, 1951, 193: 265—275
[22] Egginton S, Sidell B D. Thermal acclimation induces adaptive changes in subcellular structure of fish skeletal muscle [J]. American Journal of Physiology, 1989, 256: R1 – R9
[23] Londraville R L, Sidell B D. Cold acclimation increases fatty acid binding protein concentration in aerobic muscle of striped bass, Morone saxatilis [J]. Journal of Experimental Zoology, 1996, 275: 36—44
[24] Lannig G, Storch D, Pörtner H O. Aerobic mitochondrial capacities in Antarctic and temperate eelpout (Zoarcidae) subjected to warm versus cold acclimation [J]. Polar Biology, 2005, 28: 575—584
[25] Guderley H, Seebacher F. Thermal acclimation, mitochondrial capacities and organ metabolic profiles in a reptile (Alligator mississippiensis) [J]. Journal of Comparative Physiology B, 2011, 181: 53—64
[26] Condon C H, Chenoweth S F, Wilson R S. Zebrafish take their cue from temperature but not photoperiod for the seasonal plasticity of thermal performance [J]. Journal of Experimental Biology, 2010, 213: 3705—3709
[27] Dean J M. The metabolism of tissues of thermally acclimated trout (Salmo gairdneri) [J]. Comparative Biochemistry and Physiology, 1969, 29: 185—196
[28] Tomasi T E, Mitchell D A. Temperature and photoperiod effects on thyroid function and metabolism in cotton rats (Sigmodon hispidus) [J]. Comparative Biochemistry and Physiology Part A, 1996, 113(3): 267
[29] Wang D, Sun R, Wang Z, et al. Effects of temperature and photoperiod on thermogenesis in plateau pikas Ochotonacurzoniae and root voles Microtus oeconomus [J]. Journal of Comparative Physiology B, 1999, 1691: 77—83
[30] Ni X Y, Lin L, Zhou F F, et al. Effects of photoperiod on body mass, organ masses and energy metabolism in Chinese bulbul (Pycnonotus sinensis) [J]. Acta Ecologica Sinica, 2011, 31(6): 1703—1713 [倪小英, 林琳, 周菲菲, 等. 光周期对白头鹎(Pycnonotus sinensis)体重、器官重量和能量代谢的影响. 生态学报, 2011, 31(6): 1703—1713]
[31] Yan Y L, Xie X J. Metabolic compensation based on regulating mechanism in mitochondrion of fish in response to environmental temperature. Acta Hydrobiologica Sinica, 2012, 36(3): 532—540 [闫玉莲, 谢小军. 鱼类适应环境温度的代谢补偿及其线粒体水平的调节机制. 水生生物学报, 2012, 36(3): 532—540]
MITOCHONDRIAL METABOLIC COMPENSATION OF THE SOUTHERN CATFISH, SILURUS MERIDIONALIS CHEN, IN RESPONSE TO ACCLIMATION OF TEMPERATURE AND PHOTOPERIOD
YAN Yu-Lian and XIE Xiao-Jun
(Institute of Hydrobiology and Water Environment, School of Life Sciences, Southwest University, Chongqing 400715, China)
To evaluate the effects of ambient temperature and day-length respectively in setting metabolic compensation of mitochondria in juvenile of the southern catfish (Silurus meridionalis Chen), the organ index of the heart, kidney and liver and their state 3 rates of mitochondria and cytochrome C oxidase activity (CCO) were measured in the tested fishes at different acclimations. Two experimental groups were acclimated to high temperature (27.5℃) and low temperature (12.5℃) at equivalent photoperiod (12L∶12D), and other two groups were kept at long day-length (16L∶8D) and short day-length (8L∶16D) condition at same moderate temperature (20℃). There were 24 individuals in each group. Fish were maintained at these acclimation conditions for 8 weeks before sampling. In condition of the equivalent photoperiod, the organ index of the heart, kidney, and liver in the cold-acclimatized group (12.5℃, 12L∶12D) were all significantly higher than that in the warm group (12L∶12D, 27.5℃) (P < 0.05). The acclimation of day-length did not cause any change in organ mass at same moderate temperature. At assay temperature of 12.5, 20, and 27.5℃, both state 3 rates of mitochondria and activity of CCO in the heart, kidney, and liver in the short day-length group (8L∶16D, 20℃) were significantly higher than those in long day-length group (16L∶8D, 20℃). State 3 rates of mitochondria and activity of CCO in the three tissues were not influenced by thermal acclimation. The results showed that day-length initiates changes in the mitochondrial oxidative capacity and the temperature was the major ambient factor to alter the organ mass. It is suggested that during seasonal acclimatization photoperiod signal and thermal condition might have a cooperative effect on the adjustment for metabolic compensation in the southern catfish.
Thermal acclimation; Photoperiod; Mitochondrion; Silurus meridionalis
S965.1
A
1000-3207(2014)03-0422-08
10.7541/2014.60
2014-01-27;
2014-03-10
国家自然科学基金(31300338); 重庆市科委自然科学基金计划(cstc2012jjA20017); 中央高校基本业务专项资金项目(XDJK2013CO56)资助
闫玉莲(1983—), 女, 安徽省砀山县人; 博士, 讲师; 主要从事鱼类生理生态学研究。E-mail: yanyul@swu.edu.cn
谢小军, E-mail: xjxie@swu.edu.cn

