桂花总黄酮的提取及其抗氧化活性研究
陈培珍,林志銮,胡燕萍
(1.武夷学院 福建省高校绿色化工技术重点实验室;福建 武夷山 354300;2.武夷学院 生态与资源工程学院;福建 武夷山 354300)
桂花(OsmanthusfragransLour.)又名木樨、金栗、九里香,为木犀科属植物,是我国珍贵的花卉.具有很高的食用和药用价值,能治多痰咳嗽、肠风血痢、牙痛口臭、食欲不振、闭经腹痛[1].研究表明:桂花富含蛋白质、脂肪、碳水化合物及多种氨基酸,维生素和微量元素等成分,是不可多得的“全营养食品”[2].此外桂花中还蕴藏着丰富的黄酮类化合物.对优化桂花总黄酮提取工艺的研究已有很多报道[3-7],但是提取工艺条件对总黄酮活性保持的影响尚未见报道.
本文采用正交试验法探讨不同的提取工艺对桂花总黄酮得率及抗氧化作用的影响,旨在选取既能很好保持桂花总黄酮的生物活性又能提高桂花总黄酮得率的提取工艺,从而为桂花总黄酮产品及其他总黄酮产品的开发提供参考依据.
1 材料与方法
1.1 试验材料
丹桂由福建浦城木犀园营养食品有限公司提供,经武夷学院生物工程专业李国平授教鉴定后,自然晒干后,烘至恒重备用.
芦丁、亚硝酸铝、亚硝酸钠、氢氧化钠、无水乙醚、无水乙醇、1,1-二苯基-2-三硝基苯肼(DPPH)、抗坏血酸(Vc)、BTH均是分析纯.
1.2 主要仪器
UV-2550型紫外可见分光光度计(日本岛津).SYC-15型超级恒温水浴锅(南京桑力电子设备);WG900CSL123-K6型微波炉(格兰仕);BSA224S电子天平(赛多利斯科学仪器有限公司).
1.3 实验方法
1.3.1 桂花黄酮的提取工艺流程
取桂花若干,粉碎过0.301 nm孔径筛,在索氏脂肪提取器中用无水乙醚回流2 h脱去脂肪、色素等,至无色为止.取出,60 ℃鼓风干燥12 h,将乙醚烘干至恒重.准确称取0.5 g预处理后的桂花粉末于微波反应器中,按一定料液比,加入一定体积分数的乙醇,连接好回流装置.按一定微波功率、微波时间反应,停止后取出反应物,减压抽滤,取上清液定容于50 mL容量瓶便得到桂花总黄酮提取物.
1.3.2 单因素试验以桂花黄酮得率为评价指标
试验的主要目的是探讨能较好保持桂花黄酮的生物活性又能提高桂花黄酮得率的提取工艺,依据前人的试验结果,对有可能影响黄酮生物活性的因素再进行讨论[8-11].因此选取乙醇体积分数,料液比,浸提时间,微波功率等因素,依据各因素水平和提取条件提取桂花黄酮,考察这些因素对黄酮得率及抗氧化作用的影响,以确定正交试验的因素水平.每处理重复3次,记录实验结果.
各因素水平分布如下:微波功率分别采用180、360、540、720、900 W 5个水平,浸提时间分别采用1、2、3、4、5 min 5个水平,乙醇体积分数分别采用50%、55%、60%、65%、70% 5个水平进行单因素试验.料液比分别采用1∶30、1∶35、1∶40、1∶45、1∶50并对提取次数分析.研究温度、时间、乙醇体积分数4个因素对桂花黄酮提取率的影响.
1.3.3 黄酮的得率计算
测得桂花总黄酮提取物吸光度,以芦丁标准曲线回归方程按(1)式计算桂花总黄酮得率[12].
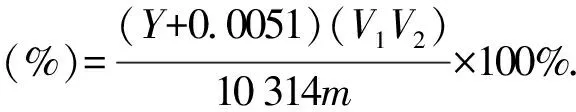
(1)
式中Y为芦丁的吸光值;V1为桂花总黄酮粗提物溶液的体积;V2为显色溶液的体积;m为桂花粉末的质量.
1.3.4 自由基清除和抗氧化能力的测定
管中依次加入6.5×10-5mol/L DPPH溶液2.5 mL和体积分数为50%的乙醇1.5 mL,总体积为4.0 mL,混匀20 min后,于1 cm比色皿中测定吸光度A(517 nm),记为A0;加入6.5×10-5mol/L的DPPH溶液2.5 mL和1.5 mL待测试样溶液,测定值记为As;加入2.5 mL体积分数为50%的乙醇和1.5 mL待测试样溶液,测定值记为Ar.按(2)式计算DPPH自由基清除率.
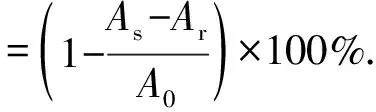
(2)
式中As为DPPH溶液加待测试样溶液的吸光度;A0为DPPH溶液加乙醇的吸光度;Ar为待测试样溶液加乙醇的吸光度.
1.3.5 正交实验设计
在单因素的基础上,设计正交试验的因素和水平,采用微波辅助提取桂花黄酮和DPPH法对桂花总黄酮提取液进行评价,每个实验做3个平行,对实验结果进行极差分析,确定桂花黄酮的最佳提取工艺.
2 结果与分析
2.1 单因素试验
2.1.1 微波时间对桂花黄酮的提取率影响
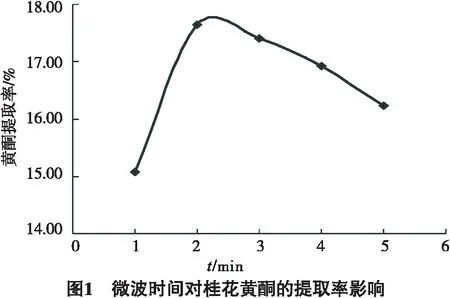
由图1可知,微波时间从1 min到2 min总黄酮的得率从15.08%增加到17.65%;微波时间2 min到5 min总黄酮得率从17.65%降到16.24%.因此,微波反应时间以2 min为宜.
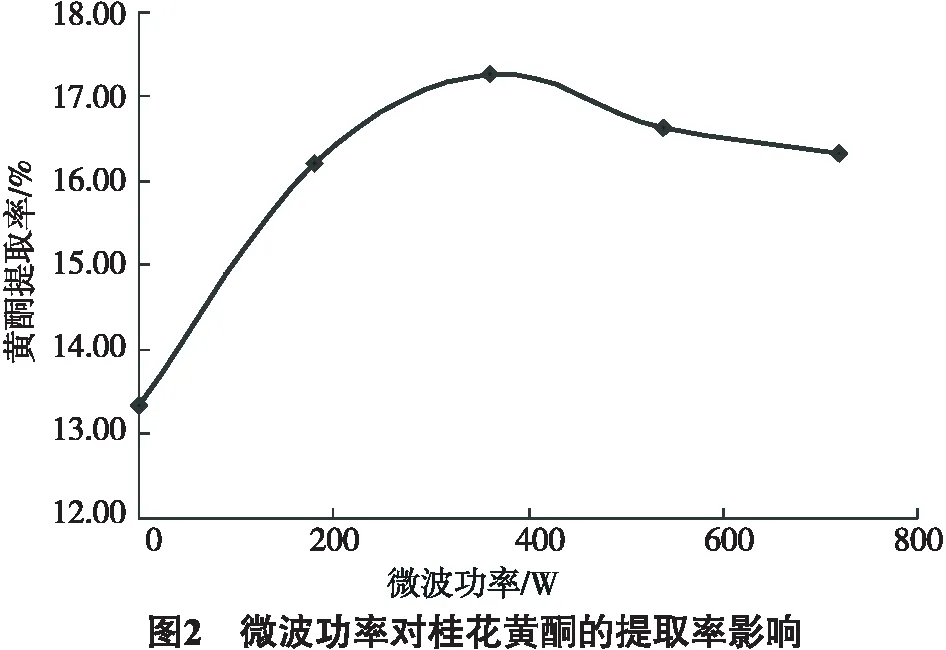
2.1.2 微波功率对桂花黄酮的提取率影响
由图2可知,微波功率从180 W增加到360 W总黄酮的得率从16.20%增加到16.78%,超过360 W时总黄酮得率反而降低.为此,微波功率为360 W为佳.
2.1.3 乙醇体积分数对桂花黄酮的提取率影响
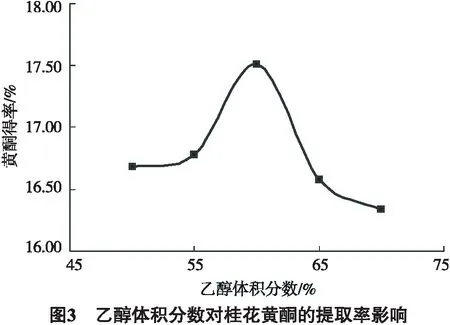
由图3可知,乙醇体积分数从40%增加到60%,得率从15.66%增至17.94%.乙醇体积分数进一步增大,得率不再增加,反而逐渐减少,乙醇体积分数为80%时,得率为16.34%,体积分数再增加得率下降趋于平缓.其可能原因是较高体积分数的乙醇溶液极性差,影响到对桂花细胞的击穿等作用.综合考虑桂花总黄酮得率和生产成本,选取60%体积分数的乙醇为提取溶剂.
2.1.4 料液比对桂花黄酮的提取率影响
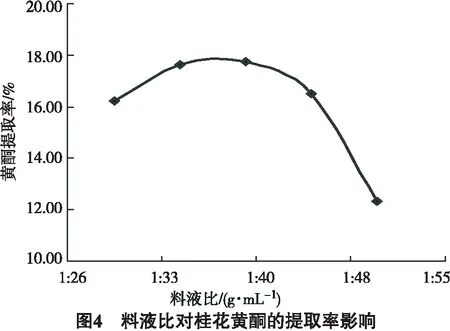
由图4可知,料液比从30 mL/g增加到40 mL/g的阶段,提取率从16.24%增加至17.75%.在40 mL/g的料液比时,得率达到最大,而后得率又下降.随着料液比的增大总黄酮的溶出率增大,但同时也增大了桂花中其他物质的溶出导致溶液变黏而不利于总黄酮的提取.因此,综合考虑提取效率、生产成本及总黄酮进一步处理,确定微波法提取总黄酮物质料液比选择35 mL/g.
2.2 正交试验
2.2.1 正交试验分析
在单因素的基础上,设计正交试验的因素和水平,A为料液比,B为乙醇浓度,C为微波时间,D为微功率.采用微波辅助提取桂花黄酮和DPPH法对桂花总黄酮提取液进行评价,每个实验做3个平行,对实验结果进行分析,确定桂花黄酮的最佳提取工艺.具体实验见表1~2.
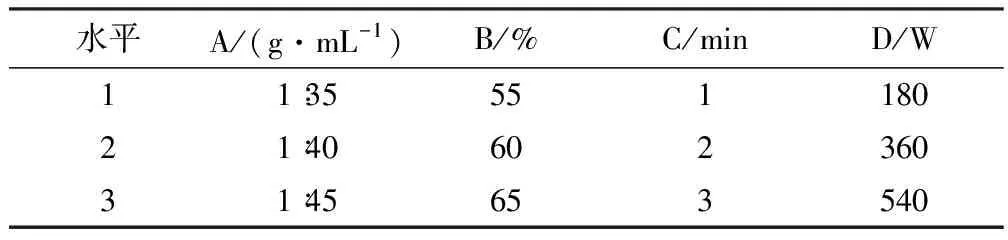
表1 正交试验的因素及水平
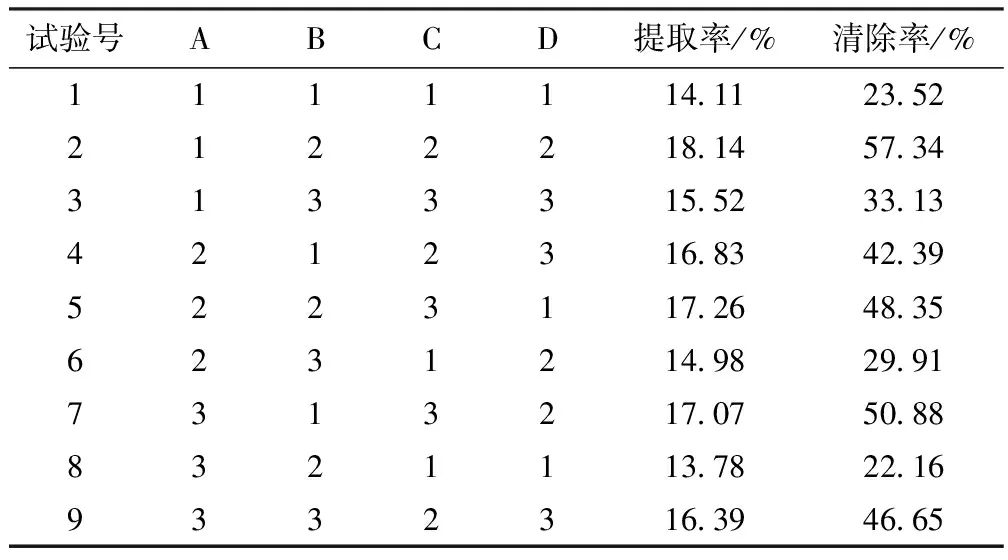
表2 L9(34)正交试验结果
2.2.2 极差分析
针对正交试验分别以桂花总黄酮得率和桂花总黄酮对DPPH清除率进行极差分析.由表3中极差R分析可知,各因素影响桂花总黄酮得率的大小顺序是C>D>A>B,其中微波时间是主要的影响因素.正交结果和单因素实验结果相吻合.正交实验结果显示第2组桂花总黄酮得率较高为18.18%,最佳工艺提取条件为A1B2C2D2,即提取料液比为1∶35,乙醇体积分数为60%,微波反应时间为2 min,微波功率为360 W.
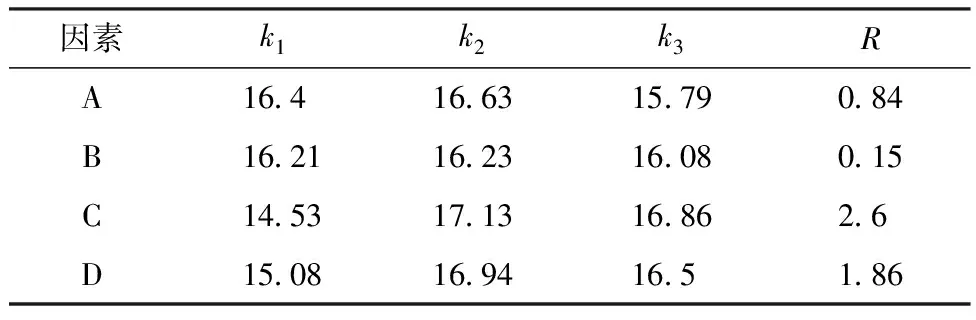
表3 总黄酮得率的极差分析 %
由表4中极差R分析可知,桂花总黄酮对DPPH自由基(DPPH·)清除率的影响因素为D>C>B>A,其中微波功率和微波时间为主要因素.在微波反应时间1~3 min、微波功率180~540 W、料液比1∶35~1∶45以及乙醇体积分数55% ~ 65%条件下,桂花总黄酮对DPPH自由基的清除和得率的影响基本一致.在此提取条件下桂花总黄酮清除DPPH自由基的活性没有受到影响.
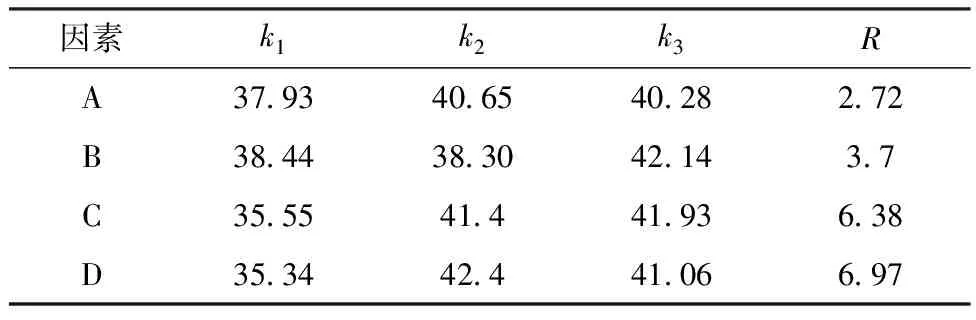
表4 总黄酮对DPPH·清除率的极差分析 %
2.3 桂花总黄酮、Vc、BHT清除DPPH自由基
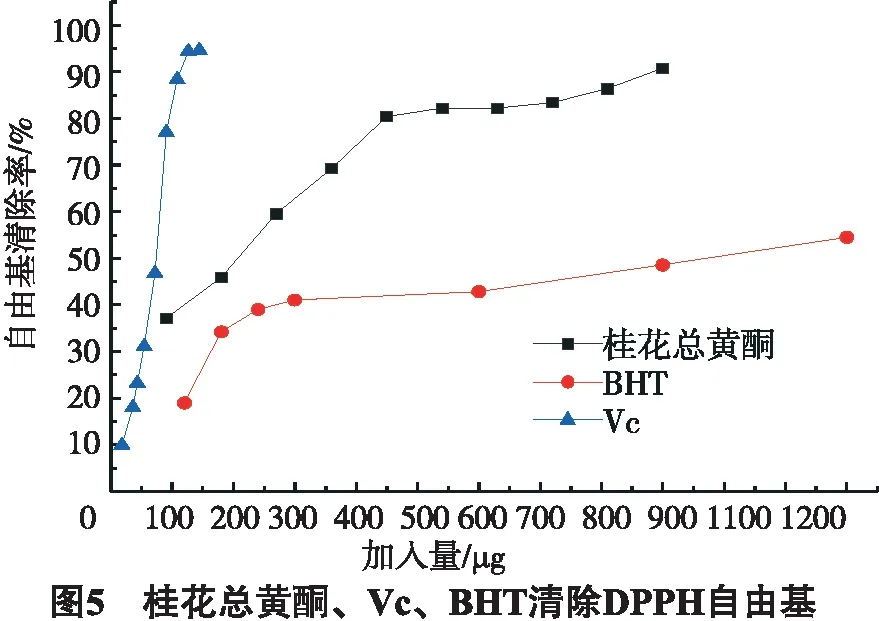
由图5可知,在相同的加入量情况下桂花总黄酮对DPPH自由基明显优于BHT,劣于Vc.从90 μg增加到450 μg对1.031 mg的DPPH清除率从37.11%增加到80.39%,540~900 μg清除率的增加相当缓慢,仅从82.22%增加到90.74%.
3 结语
1) 乙醇体积分数,微波时间和微波功率过高都不利于桂花总黄酮的提取率和生物活性的保持.
2) 正交实验结果显示第2组桂花总黄酮得率较高为18.18%,最佳工艺提取条件为A1B2C2D2,即提取料液比为1∶35,乙醇体积分数为60%,微波反应时间为2 min,微波功率为360 W.
3) 在此条件下桂花总黄酮清除DPPH自由基的活性没有受到影响,在相同的加入量情况下桂花总黄酮对DPPH自由基清除率明显优于BHT,低于Vc.
参考文献:
[1] 徐文斌.福建浦城县桂花品种资源调查及开发利用[D].南京:南京林业大学,2009.
[2] 杨康民.桂花[M].上海:上海科学技术出版社,2000:175-204.
[3] 陈昳琦.桂花[M].南京:江苏科学技术出版社,1989:1-16.
[4] 朱沛沛,梁晶,李宁宁.桂花黄酮的微波辅助提取工艺研究[J].中国调味品,2012,8(37):40-42,55.
[5] 蔡建,王薇. 陈国威,等.桂花黄酮类化合物最佳提取工艺研究[J].粮油食品科技,2005,13(1):16-18.
[6] 郭娇娇,罗佳,宫智勇.桂花中总黄酮提取工艺及其抗氧化活性的研究[J]. 武汉工业学院学报,2011,30(1):5-8.
[7]. 陶阿丽, 戴一, 华芳.桂花中总黄酮提取工艺及采收期研究 [J].食品与发酵工业, 2013, 39(2):247-249.
[8] 李会霞,叶舟,陈伟,等. 不同提取工艺对茶树菇多糖得率及抗脂质过氧化作用的影响[J].热带作物学报,2009,30(9):1246-1251.
[9] 靳熙茜,汪海波.桂花总黄酮提取及其体外抗氧化性能研究[J].粮食与油脂,2009(11):42-45.
[10] 胡春弟,张锦红,徐亮,等.桂花总黄酮的提取及抗氧化能力研究[J].食品与机械,2009, 25(2):71-73.
[11] 雷明.桂花果类黄酮分离纯化工艺及其抗氧化研究[J].西南大学学报:自然科学版,2011, 33(4):77-82.
[12] 张雪,丁长河. 紫外分光光度法检测山楂总黄酮方法的建立[J].食品工业科技,2007(7):200-202.

