烟草侧流烟雾对大鼠主动脉炎性微环境和内皮功能的影响
郭 华,赵仙先,张晓娟,张 洁,吕 磊
循证医学研究已经证实,吸烟独立于高血压、糖尿病、年龄等,是一个非常重要的冠心病危险因素,与冠心病患者的预后存在负线性关系[1]。近年研究特别提出,吸烟对血管内皮炎性微环境的影响,同时越来越多的证据显示,动脉粥样硬化性疾病是一种以动脉慢性炎症性改变和内皮功能不全为特点的疾病[2]。而在内皮功能不全的动物模型实验研究中,较少涉及以血管内皮炎性微环境改变为特点的动物模型。本研究旨在探讨烟草侧流烟雾对大鼠主动脉炎性微环境和内皮功能的影响,以及是否可通过侧流烟雾暴露建立以炎性微环境变化为特点的大鼠内皮功能损伤模型,并用于以后的实验研究。
1 材料与方法
1.1动物与分组 30只健康SD大鼠,8 w左右大小,体重200~250 g(由南京军区南京总医院实验动物中心提供,SCXK军2012-0014),随机分成3组,对照组6只(C组),短期烟雾影响组12只,长期烟雾影响组12只;造模期间,将短期组随机平均分两个亚组,即:短期暴露组(S组)和短期暴露并恢复组(S+R组),长期组也分为两亚组,即:长期暴露组(L组)和长期暴露并恢复组(L+R组)。
1.2方法
1.2.1烟草侧流烟雾暴露 按林邦和等[3]的方法自制2个烟草侧流烟雾染毒箱(100 cm×60 cm×40 cm)。实验用烟为常见的商品烟(大丰收牌,焦油含量 13 mg/支,尼古丁含量 1 mg/支,安徽烟草公司)。将短期和长期暴露组各12只同时放入染毒箱内(3 h/次,10根/次,2次/d)。连续4 w后,将短期组处死6只,另外6只放入对照组箱内2 w后处死。而长期组12只大鼠继续暴露4 w,然后处死其中6只,剩余6只放入对照组箱内2 w后处死。对照组除箱内无点燃的香烟外,其他条件与实验组相同,10 w后处死。
1.2.2血液动力学指标的测量 在处死大鼠之前,测量各组的尾动脉血压、心率;在测量的前1 d,通过训练尽量使大鼠适应仪器及环境,采用无创鼠尾尾套加压阻断法对平静且清醒的大鼠进行测量。每只大鼠测量5次,每次间隔约5 min,取平均值。
1.2.3离体主动脉环内皮依赖的主动脉舒张试验 在每个实验的时间点,将需要实验的大鼠通过腹腔内注射水合氯醛(400 mg/kg)麻醉后,快速断头处死大鼠,迅速取出约4 cm长的胸主动脉,取2 cm于液氮中冻存用于测量炎性因子、NO及eNOs含量,剩余的主动脉用于内皮依赖性血管舒张功能的测定。将上述大鼠胸主动脉放入4 ℃并持续通以95%O2+5%CO2混合气体的Krebs缓冲液(NaCl 118 mmol/L,KCl 4.75 mmol/L,NaHCO325 mmol/L,MgSO41.2 mmol/L,CaCl22 mmol/L,KH2PO41.2 mmol/L,葡萄糖11 mmol/L,pH=7.4)中,切割成长3 mm左右的血管环,并放入含Krebs缓冲液器官浴槽中。在维持37 ℃的条件下,并持续通以95%O2+5%CO2混合气体,一端固定,一端通过张力换能器连接PowerLab数据记录系统。调节血管环的基础最佳张力至1.8 g,并平衡60 min,期间每15 min换液1次。预先通过去甲肾上腺素(PE 1 μmol/L)收缩主动脉,待其收缩张力达到最大限度后,依次加入不同浓度的乙酰胆碱(ACh,10-8~10-4mol/L)或硝普钠(10-8~10-4mol/L),记录每一浓度下主动脉环的舒张程度(以舒张百分比计量),并绘制剂量反应曲线[4-5]。
1.2.4主动脉NO含量测定 组织中的NO化学性质活泼,易于分解代谢,单纯测量NO结果差异较大。因此,以测量NO的最终代谢产物NOx(亚硝酸盐NO2-与硝酸盐NO3之和)来反映体内NO水平。将部分大鼠主动脉放入含有蛋白抑制剂的无菌磷酸盐中,在4 ℃的条件下以12 000g离心10 min。取上清液,严格遵循说明书操作步骤,利用NO试剂盒(南京碧云天生物公司),用分光光度仪在540 nm处测定,根据公式计算NOx含量。
1.2.5eNOs含量测定 采用Western blot法测定iNOS和eNOS表达水平。取胸主动脉组织用冷TBS洗涤2~3次,置于匀浆器中,加RIPA裂解液提取蛋白,用BCA法进行蛋白定量。在蛋白样品中其体积5倍的蛋白上样缓冲液,煮沸5 min、冷却,离心后取上清,进行SDS-PAGE电泳、转膜。室温下将转好的膜置于脱色摇床上,用5%的脱脂牛奶封闭1 h,加入一抗eNOS(稀释度1∶2000,美国Anbo Bio公司),4 ℃过夜;TBST漂洗3次,5 min/次;加二抗(稀释度1∶3000,美国Anbo Bio公司),室温30 min后,用TBST在室温下脱色摇床上洗3次,5 min/次。将A和B 两种试剂在离心管中等体积混合,将膜蛋白面朝上与此混合液充分接触1~2 min后,去尽残液,包好,放入X光片夹中曝光。将胶片进行扫描存档,Alpha软件处理系统分析目标带的光密度值。
1.2.6主动脉炎性因子的mRNA表达检测 采用荧光定量PCR法测定主动脉中炎性因子(ICAM-1、TNFα、IL-1β)的mRNA。用标准Trizol(美国Sigma-Aldrich)法提取目标因子的总RNA。随后用反转录方法(FastQuant cDNA第一链合成试剂盒,上海天根)反转4 μg的总RNA到40 μl cDNA体系中,再用β-actin作为内参进行调节,使cDNA的起始量达到一致。依据上海捷瑞生物工程有限公司提供的方法进行引物设计(表1),实时定量PCR(RT-PCR)根据THUNDERBIRD SYBR®qPCR Mix(TOYOBO日本)和Applied Biosystems Step OneTM(ABI 美国)实验手册,基于SYBR green扩增方法进行试验。
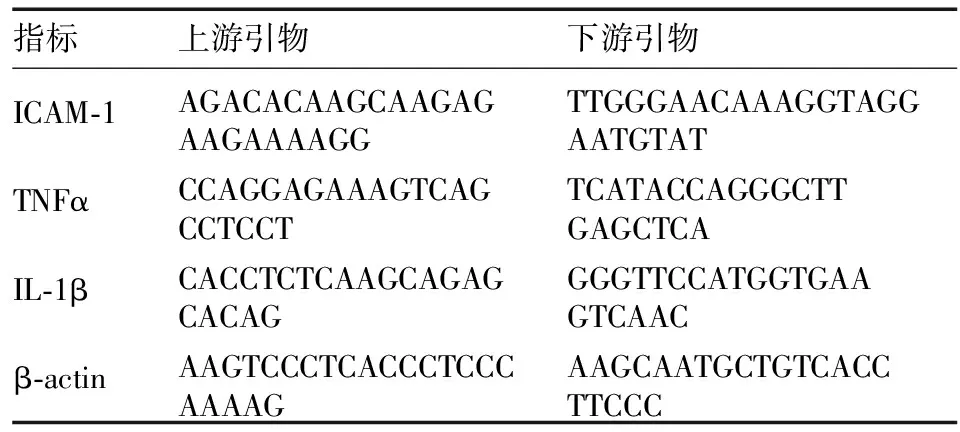
表1 引物设计


表2 烟草侧流烟雾对大鼠血压、心率的影响(n=6)
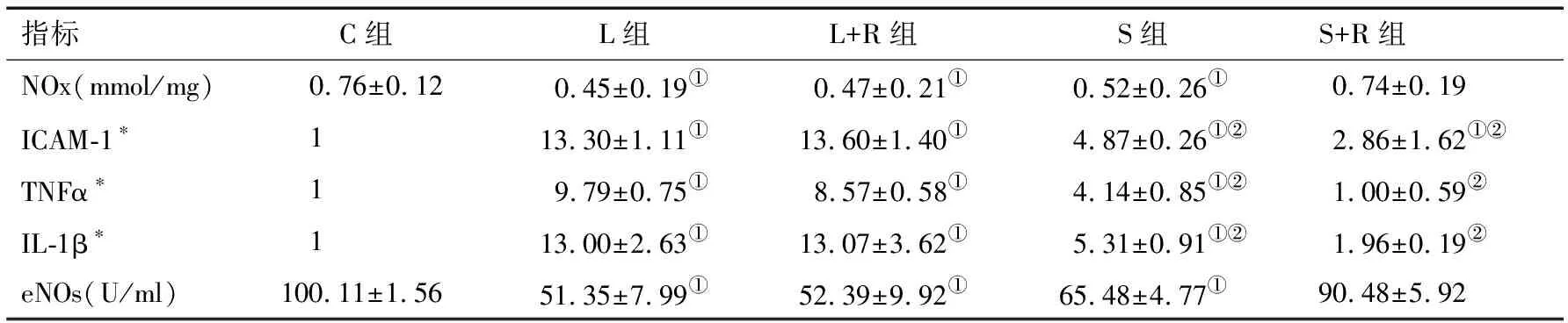
表3 各组主动脉中NOx、炎性因子mRNA和eNOs蛋白的比较(n=6)
2 结果
2.1血液动力学变化 吸入侧流烟雾组大鼠尾动脉血压较对照组有明显升高(P<0.05)。短期组在停止吸入烟雾2 w后,升高的血压明显下降,与对照组无明显差异(P>0.05);而长期吸烟组即使停止烟雾干预2 w,血压仍较高。见表2。
2.2各组(ACh)诱导的内皮依赖性血管舒张功能的变化 除了S+R组外,其他吸入烟雾组的胸主动脉环对ACh诱导的内皮依赖性舒张反应受损明显,ACh所致的最大舒张比正常对照组下降了28.74%(P<0.01);短期吸入烟雾组戒烟2 w,可明显改善胸主动脉的内皮依赖性舒张,且与对照组无明显差异(P>0.05)。但长期吸入烟雾后戒烟不能改善其舒张功能。L组与S组比较,L组舒张百分比下降幅度较S组高(P<0.05)。见图1。
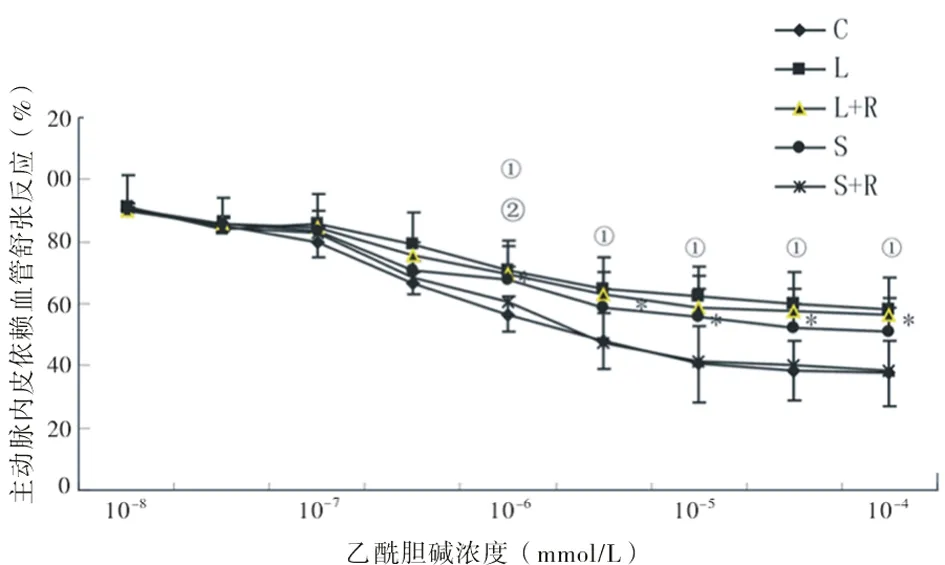
图1 不同浓度ACh对各组主动脉内皮依赖的血管舒张反应的影响
2.3各组NO含量比较 吸入烟雾组主动脉NOx的含量低于对照组,其中以L和L+R组降低最为明显,S组次之,提示这3组NO含量较对照组显著降低(P<0.05);虽然S+R组主动脉中NO含量也偏低,但与对照组无明显差异(P>0.05)。见表3。
2.4各组主动脉中eNOs蛋白表达的变化 吸入烟雾组主动脉eNOs蛋白表达最高,顺序依次为S+R、S、L+R、L,其中以L、L+R、S组与对照组比较有统计学差异(P<0.05),而S+R组与对照组无明显差异(P>0.05)。见表3、图2。
2.5各组中主动脉炎性因子mRNA的变化 L、L+R、S组其ICAM-1、TNFα、IL-1β的mRNA水平较C和C+R组明显升高(P<0.05);随着暴露时间的延长,其炎性因子逐渐升高(P<0.05)。L组和L+R组之间炎性因子水平无统计学差异;而S+R组与C组相比,TNFα和IL-1β无统计学差异。见表3。
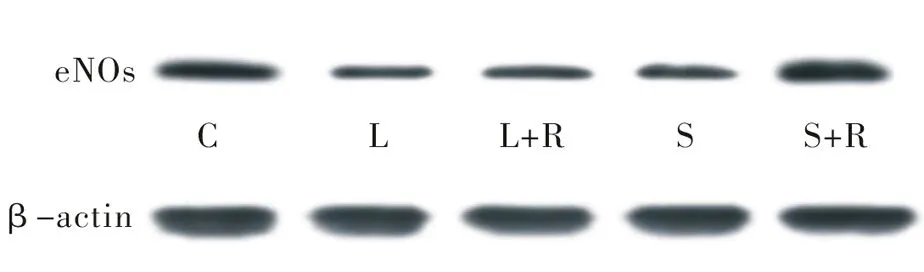
图2 各组Western blot eNOs蛋白表达
3 讨论
动脉粥样硬化性疾病的病理生理变化初始于血管内皮功能不全。烟草烟雾中含有大约4300种化学成分。其中大部分如可诱发血管的炎症环境、提升氧化应激、促进血小板聚集、抑制纤维蛋白原溶解、扰乱脂质代谢、激活RAS系统等,这些作用相互影响,并产生级联放大效应,引起血管内皮功能不全,最终导致血管粥样硬化性疾病[6]。近年研究特别提出,吸烟对血管内皮炎性环境有影响,而且认为动脉粥样硬化本质上是一种以慢性炎症性改变和内皮功能不全为特点的疾病[7-8]。烟草的复杂而综合的多因子作用机制,以及可诱发炎性微环境改变的特点很难被其他动物模型所模拟。因此,本研究的另一个目的就是将暴露于烟草侧流烟雾中作为干预因素,制造以炎性微环境改变为特点的内皮功能不全动物模型,用于以后的研究工作。
血管活化的炎性环境主要表现在炎性标志物的升高[9]。ICAM-1、TNFα、IL-1β是近年研究中已证实的炎性标志物[10]。在炎性环境的刺激下,这些因子明显升高,它们可增加循环血液中白细胞和血管内皮细胞的黏附力,促使白细胞从血管中向内皮组织中趋化聚集;吸引单核细胞渗透入动脉内膜,造成局部的微炎性改变[11];增加炎性细胞与平滑肌细胞之间的黏附力;影响急性蛋白的合成,同时可以促进放大炎性级联反应,从而损伤内皮细胞,破坏内皮的完整性,影响内皮功能[12]。在本研究中,随着烟草烟雾暴露的时间延长,其ICAM-1、TNFα、IL-1β的mRNA明显升高,而短期组经戒烟恢复后,其炎性因子有明显下降,TNFα甚至可基本恢复至正常对照组水平。但是长期暴露组停止烟草烟雾暴露后,其炎性因子无明显改变。提示烟草烟雾确实可引起血管的炎性微环境改变,诱发炎性因子表达增加,且具有时间依赖性的损害特点。且在一定的时间范围内,烟草造成的损害可经戒烟而改善。
内皮功能主要由NO的产量和生物活性,以及血管内皮的完整性来体现[13]。NO由血管内皮经eNOs酶催化L-精氨酸而产生,越来越多的数据证实,eNOs/NO通路异常是导致NO生物活性减少最主要的原因。而在动物实验中,以内皮依赖的血管舒张功能来反映血管的内皮功能已被广泛接受[14]。在本研究中,无论短期还是长期暴露于烟草侧流烟雾中的大鼠,其主动脉的NO产量、eNOs表达均较正常对照组明显降低。相对于对照组,烟雾暴露组其内皮依赖的血管舒张功能明显受损,同时血压也明显升高。这些结果提示,暴露于烟草侧流烟雾中,无论是在微观水平还是宏观水平,都有大鼠主动脉内皮功能异常的表现。而且随着暴露时间的延长,长期吸烟比短期吸烟对内皮功能损害进一步加重,似乎表现出一种时间依赖性的特点。但是在短期吸烟组中,经过停止吸烟一段时间后,其主动脉内皮功能受损的指标基本可恢复至未吸烟的状态下,而长期吸烟组无论是否停止吸烟,其主动脉内皮功能的损害很难恢复。提示在一定的时间范围内,烟草烟雾造成的血管损害,可通过停止接触烟雾而逆转。同时也提示,在以后的研究中,如果吸入烟草侧流烟雾引起内皮功能不全的模型制造成功后,若要观察某些干预因素对其的作用,最好使用暴露8 w以上的模型,避免出现假阴性结果的可能。
综上所述,将大鼠暴露于烟草侧流烟雾中,无论短期还是长期,都可诱发大鼠主动脉炎性微环境改变和内皮功能不全,导致其血管动力学的改变;如果要将此类动物模型用于以后的实验研究,应尽量采用长期(8 w以上)暴露的大鼠模型,避免由于大鼠机体自身调节恢复而影响实验结果的真实有效性。
【参考文献】
[1] Al-Arifi MN,Maayah ZH,Alshamrani AA,et al.Impact of cigarette smoke exposure on the expression of cardiac hypertrophic genes,cytochrome P450 enzymes,and oxidative stress markers in rats[J].Toxicol Sci,2012,37(5):1083-1090.
[2] Hartman J,Frishman WH.Inflammation and atherosclerosis:a review of the role of interleukin-6 in the development of atherosclerosis and the potential for targeted drug therapy[J].Cardiol Rev,2014,22(10):147-151.
[3] 林邦和,李立娟,肖世葵,等.被动吸烟对不同孕期大鼠宫内胚胎发育影响的研究[J].环境与健康杂志,1997,14(1):153.
[4] Feng Wu,Jin-Zhong Feng,Yi-Hua Qiu,et al.Activation of receptor for advanced glycation end products contributes to aortic remodeling and endothelial dysfunction in sinoaortic denervated rats[J].Atherosclerosis,2013(6):287-294.
[5] 黄佩,李锡明,张荣林.缬沙坦和氨氯地平对老年原发性高血压病患者左心室和血管内皮舒张功能及胰岛素水平的影响[J].医学研究生学报,2005,18(12):1102-1107.
[6] Chehne F,Oguogho A,Lupattelli G,et al.Effect of giving up cigarette smoking and restarting in patients with clinically manifested atherosclerosis[J].Prostaglandins Leukot Essent Fatty Acids,2002,67(11):333-339.
[7] Stefan M Nidorf,John W Eikelboom,Charley A Budgeon,et al.Low-dose colchicines for secondary prevention of cardiovascular disease[J].Journal of American College of Cardiology,2013,61(4):404-410.
[8] Stefan M Nidorf,John W Eikelboom,Peter L Thompson,et al.Targeting cholesterol crystal-induced inflammation for the secondary prevention of cardiovascular disease[J].Journal of Cardiovascular Pharmacology and Therapeutics,2014,19(1):45-52.
[9] Kiyoko Uno,Stephen J Nicholls.Biomarkers of inflammation and oxidative stress in atherosclerosis[J].Biomarkers Med,2010,4(3):361-373.
[10] Zuhier Awan,Jacques Genest.Inflammtion modulation and cardio-vascular disease prevention[J].European Jouranl of Preventive Cradiology,2014,3(1):1-16.
[11] Corina Serban,Simona Dragan.The relationship between inflamma-tory and oxidative stress biomarkers,atherosclerosis and rheumatic diseases[J].Current Pharmaceutical Design,2014,20(10):585-600.
[12] Sun Young Kim,Seok Woo Hong,Mi-Ok Kim,et al.Sadenosyl methionine prevents endothelial dysfunction by inducing hemeoxygenase-1 in vascular endothelial cells[J].Mol Cells,2013,36(3):376-384.
[13] Korokin MV,Pokrovskiy MV,Novikov OO,et al.A model of hyperhomocysteine-induced endothelial dysfunction in rats[J].Bulletin of Experimental Biology and Medicine,2011,152(2):213-215.
[14] Pilz H,Oguogho A,Chehne F,et al.Quitting cigarette smoking results in a fast improvement of in vivo oxidation injury(determined via plasma,serum and urinary isoprostane)[J].Thromb Res,2000,99(6):209-221.

