吉非替尼新辅助治疗ⅢA-N2期表皮生长因子敏感突变肺癌的临床观察
肺癌是我国乃至全世界占据癌症死因首位的高发恶性肿瘤。目前,可手术的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者中近1/3为伴有纵隔淋巴结转移的ⅢA-N2期患者[1],整体预后较差。大量多中心研究提示对ⅢA-N2肺癌患者施行新辅助化疗能提高手术切除率、延长生存[2-5]。然而,目前ⅢA-N2期患者新辅助化疗总有效率仍徘徊于60%左右[6-7],5年生存率仍<30%[1]。如何进一步提高ⅢA-N2期患者远期生存率是当前研究的热点。
以表皮生长因子受体(epidermal growth factor receptor,EGFR)基因酪氨酸激酶抑制剂(EGFR-TKI)为代表的分子靶向药物为许多晚期肺癌患者带来了曙光[8],吉非替尼(IressaTM,AstraZeneca)在肺癌患者中得到了广泛的应用[9-10]。著名的IPASS及INTERST研究表明:对于EGFR突变阳性的亚洲非吸烟晚期肺腺癌患者而言,吉非替尼一线治疗可获得与化疗等同的总体生存(overall survival,OS),且无进展生存(progression free survival,PFS)及生活质量获益显著优于化疗[11-12]。目前EGFR-TKI的应用范围仅限于晚期NSCLC人群,尚无研究表明其在ⅢA-N2期患者中是否具有应用价值。本研究拟筛选具有EGFR敏感突变的可手术ⅢA-N2期肺癌患者,探索对该特定人群进行吉非替尼新辅助治疗的安全性及可行性。
1 资料和方法
1.1 筛选标准 选择我院2010年1月至2012年1月收治的疑似ⅢA-N2期NSCLC患者进行进一步筛选,标准如下:(1)18~75岁患者;(2)根据最新美国抗癌联盟(AJCC)第7版非小细胞肺癌TNM分期,经肺穿刺或支气管镜活检,病理组织学确诊为肺癌,PET-CT纵隔淋巴结摄取升高或超声支气管镜(EBUS)活检证实为N2期的患者;(3)EGFR基因19或21外显子敏感突变;(4)经江苏省肿瘤防治研究所肺癌中心专家委员会会诊认为可接受手术治疗;(5)ECOG评分0~1分;(6)从未接受任何放疗、化疗或分子靶向治疗的初诊患者;(7)能理解临床试验目的,自愿参加并签署知情同意书。
1.2 排除标准 (1)合并患有其他恶性肿瘤者;(2)患有未消除的急慢性感染者;(3)有严重的器质性病变或主要器官功能衰竭,如失代偿的心、肺功能衰竭导致无法随访者。
1.3 剔除标准 (1)因不良反应不能耐受而出组的病例不评价疗效,但不良反应列入统计;(2)未按研究方案所规定的剂量及疗程给药者;(3)研究资料不全或无任何记录者。
1.4 治疗方法 新辅助化疗阶段:术前给予吉非替尼250 mg口服,1次/d,持续1月后手术治疗。手术阶段:行全麻下肺癌根治术,常规围手术期处理。术后阶段:继续口服吉非替尼250 mg,每日1次直至耐药或进展。
1.5 安全性及效果评价 每位入组的患者新辅助治疗期约1月,手术及术后恢复期约1月,术后随访2年,之后生存随访1年。分别在试验前、新辅助治疗、术后辅助化疗、随访及复查等阶段完善以下相关检查:(1)体格检查:阳性体征、体质量、ECOG评分;(2)实验室检查:血常规、血生化(肝肾功能、电解质、血糖),肿瘤标志物(CEA、CA199、CA125、CA153、NSE),每个治疗周期开始前及结束时各1次,有异常时可每周检查1次至正常;(3)影像学检查:胸腹部CT、头颅MRI,骨ECT扫描,每个治疗周期结束时检查1次;(4)药物毒性分析:采用通用不良反应术语标准4.0版(CTCAEv4.0)。
1.6 统计分析及作图 采用SPSS 18. 0及Excel 2007统计软件处理数据,GraphPad Prism 5.0软件作图。
2 结果
2.1 患者基线资料 2010年1月至2012年1月共筛选ⅢA-N2期非小细胞肺癌患者72例,确定EGFR敏感突变的患者15例,经过入选标准、排除标准、剔除标准后同意入组口服吉非替尼并坚持用药随访的共6例(基线资料见表1)。其中男1例,女5例,均不吸烟,年龄49~71岁(中位年龄60岁)。5例通过PET-CT确定N2分期,1例经过EBUS确定。病理类型基本为中~低分化腺癌。
2.2 EGFR突变状态 通过Dxs试剂盒和测序检测突变,6例EGFR的敏感突变中,3例为19外显子缺失突变,3例为21外显子L858R突变。
2.3 新辅助治疗的安全性及效果 在口服吉非替尼期间,6位患者均出现了不同程度的毒性反应。参照CTCAEv4.0标准,4例出现了1度的皮肤干燥和乏力。5例出现皮疹,其中1例为2度反应,剩余的为1度。期间腹泻2例,自觉眼干2例,均为1度反应。
患者新辅助治疗1月后复查胸部CT。前后对比影像学的表现,并参考实体瘤疗效评价标准(RECIST),4位女性患者的肺癌原发灶出现了部分缓解(PR),她们的N2淋巴结阳性也为PR或完全缓解(CR)为N2淋巴结阴性。其他2位患者肺癌原发灶大小稳定(SD),其中1例男性的N2淋巴结仍为SD,而1位女性的N2淋巴结阳性为PR,部分缩小但仍临床诊断为淋巴结N2阳性。
2.4 整体的临床效果评价 经过本院肺癌中心专家委员会组讨论,6例患者均无手术禁忌证,由专业胸外科医生行全麻下肺癌根治术,均为完全切除(R0切除)。
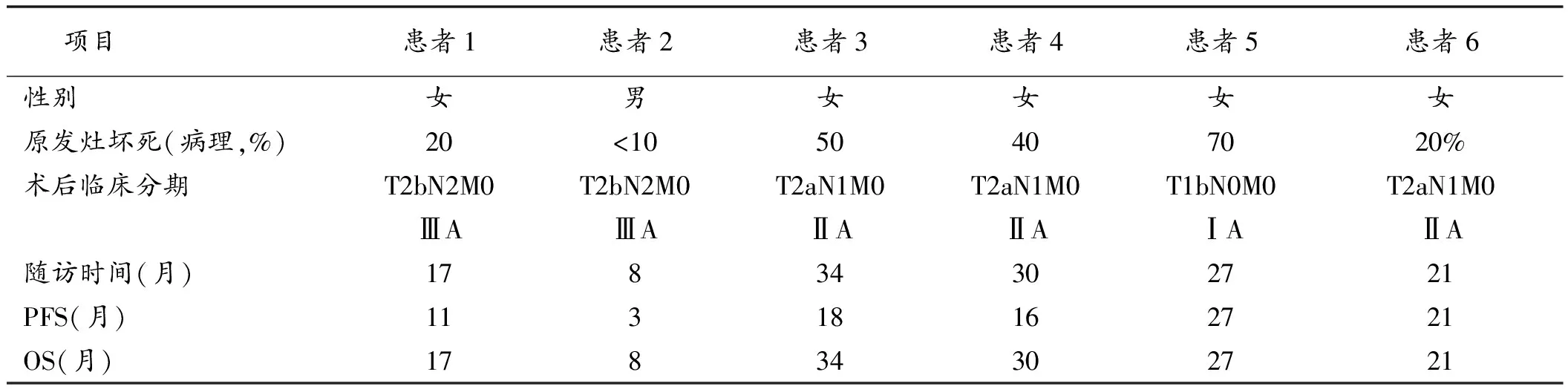
表1 患者临床信息及随访情况
手术过程顺利,未出现较困难的止血、分离等操作。术后予常规抗感染、化痰、胸管引流、适当补液、对症处理等治疗,患者术后恢复良好。
患者手术切除肺叶及清扫淋巴结标本由本院病理科进一步精确评价术后分期。4例患者新辅助治疗后明显降期,淋巴结分期为N1或N0。其余2例仍为N2淋巴结阳性。病理学淋巴结和病理学降期率均为66.7%。原发灶的坏死范围基本与原发病灶缓解程度相符。
术后2例患者(患者5和6)继续口服吉非替尼250 mg/d,定期随访(表1)。随访时间为8~34月(中位24月)。6例患者生存情况详见表1。总体1年PFS率为66.7%,1年OS率为83%,2年OS率为66.7%(图1)。截至2013年10月,4例患者依然坚持随访。
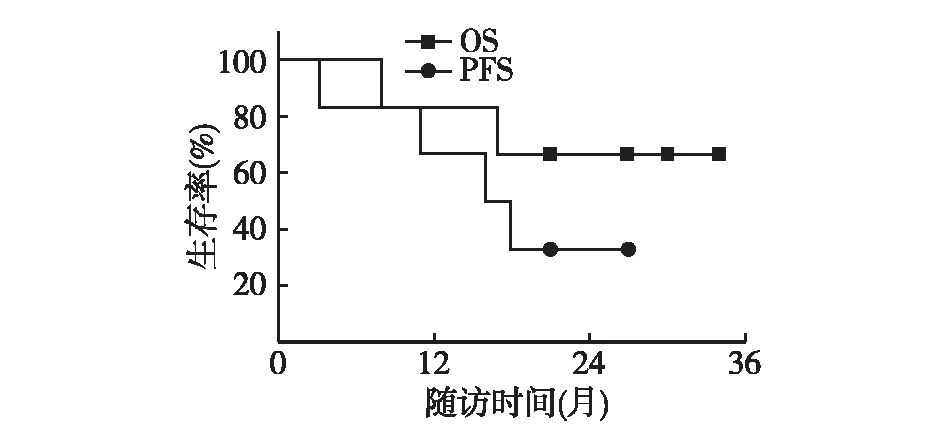
图1 患者PFS曲线及OS曲线
3 讨论
新辅助化疗是NCCN指南推荐的ⅢA-N2期NSCLC患者术后维持治疗的标准治疗方案,主要是为了尽可能地获得局部缓解和控制,增加手术根治机会,从而提高患者远期生存。因此,本研究首次针对ⅢA-N2期具有EGFR敏感突变的特定NSCLC人群给予了吉非替尼新辅助治疗,尽管入组病例较少,但初步结果显示了良好的耐受性和较低的毒性反应,总体有效率达到83.3%,说明EGFR-TKI在ⅢA-N2期NSCLC患者中安全性良好且具有积极意义。
Marchetti等[13]统计发现NSCLC患者中大约90%的EGFR突变集中于19或21外显子中,而且服用EGFR-TKIs的有效率均≥70%。此外,Lee等[14]的荟萃分析表明在EGFR突变阳性的患者中应用EGFR-TKIs作为一线化疗或二线化疗,疾病进展的风险分别减少57%和66%,但EGFR阴性病人没有获益。为了提高新辅助治疗有效率,我们选择了具有EGFR敏感突变的NSCLC患者这一特定人群。由于条件较为苛刻,最终仅入组6例。
在安全性和毒性方面,部分患者出现了1~2度的皮疹、皮肤干燥、瘙痒、乏力、腹泻、眼干等反应,均比较轻微,对症处理后能够缓解。我们并没有观察到肾功能受损、消化道出血、眩晕、深静脉栓塞等不良反应,因此我们初步认为EGFR-TKIs的新辅助化疗是安全的。一些其他吉非替尼治疗NSCLC临床研究中[15-16],有报道患者发生严重的间质性肺病、胃肠道穿孔等严重的不良反应,故在吉非替尼的应用中仍需严密观察患者的病情,定期监测。此外,新辅助治疗对于外科手术没有带来特殊不良的影响,患者的手术完整切除率为100%。按照常规的术后处理,患者围手术期病情、术后恢复也比较顺利。
在治疗效果方面,6例NSCLC患者新辅助治疗后原发灶客观缓解率为66.7%,N2淋巴结客观缓解率为83.3%,术后病理学分期下降率为66.7%,术前吉非替尼新辅助化疗对于EGFR敏感突变患者的疗效是显而易见的,能够减少原发灶的大小或淋巴结的分期,对促进肿瘤的坏死也起着一定的作用。结合RECIST标准,本次研究中EGFR-TKI应用的有效率达到了83.3%。OPTIMAL研究比较了EGFR突变的晚期NSCLC患者一线用厄洛替尼对比卡铂/吉西他滨的疗效。就PFS而言,厄洛替尼组明显长于化疗组(13.1月比4.6月,P<0.01),客观缓解率和疾病缓解率也明显高于化疗组(83%比36%,P<0.01;96%比82%,P=0.002)[17]。本研究初步认为,至少在PFS方面,EGFR敏感突变的NSCLC患者术前EGFR-TKI新辅助治疗是有明显优势的。
本研究是一项观察性临床研究,存在一些缺陷:(1)入组病例数较少,由于入组条件的严苛性,导致筛选较为困难,可联合多中心大样本筛选增加入组数;(2)本研究为单臂研究,缺乏常规新辅助化疗作为对照,可通过更大样本的随机对照多中心临床研究扩大入组例数来解决;(3)敏感性方面,缺乏EGFR-TKI耐药相关突变位点检测,如EGFR20外显子及K-ras、BRAF等;(4)随访时间偏短,未来研究应随访≥40月。
总之,本研究结果表明:对于具有EGFR敏感突变的ⅢA-N2期NSCLC患者,接受吉非替尼新辅助治疗具有良好的耐受性和较低的毒性反应,局部病灶客观缓解率较高,患者围手术期未出现严重风险,术后恢复良好。值得进一步设计更大样本的前瞻性多中心随机对照临床研究,对比EGFR-TKI新辅助治疗与常规化疗在PFS及OS等研究终点上的优劣性。
[参考文献]
[1] Heist RS, Engelman JA. SnapShot: non-small cell lung cancer[J]. Cancer Cell, 2012, 21(3):448.e2.
[2] Takamochi K, Suzuki K, Sugimura H, et al. Surgical resection after gefitinib treatment in patients with lung adenocarcinoma harboring epidermal growth factor receptor gene mutation[J]. Lung Cancer, 2007, 58(1):149-155.
[3] Shepherd FA, Rodrigues PJ, Ciuleanu T, et al. Erlotinib in previously treated non-small-cell lung cancer[J]. N Engl J Med, 2005, 353(2):123-132.
[4] Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC):a multicentre, open-label, randomised phase 3 trial[J]. Lancet Oncol, 2012, 13(3):239-246.
[5] Albain KS, Swann RS, Rusch VW, et al. Radiotherapy plus chemotherapy with or without surgical resection for stage Ⅲ non-small-cell lung cancer: a phase Ⅲ randomised controlled trial[J]. Lancet, 2009, 374(9687):379-386.
[6] Girard N, Mornex F, Douillard JY, et al. Is neoadjuvant chemoradiotherapy a feasible strategy for stage ⅢA-N2 non-small cell lung cancer? Mature results of the randomized IFCT-0101 phase II trial[J]. Lung Cancer, 2010, 69(1):86-93.
[7] De Marinis F, Gebbia V, De Petris L. Neoadjuvant chemotherapy for stage ⅢA-N2 non-small cell lung cancer[J]. Ann Oncol, 2005, 16(suppl 4):iv116-iv122.
[8] 刘福银, 王峻, 樊卫飞, 等. 吉非替尼治疗老年晚期非小细胞肺癌的临床研究[J]. 实用老年医学, 2009, 23(5):370-372.
[9] 汪海岩,张德芳. 吉非替尼与厄洛替尼二线治疗晚期非小细胞肺癌的对比研究[J].实用医学杂志,2012,28(20):3444-3446.
[10] 王璐,钟军. 吉非替尼治疗非小细胞肺癌研究现状[J].实用医学杂志,2012,28(23):4020-4022.
[11] van Meerbeeck JP, Surmont VFM. Stage ⅢA-N2 NSCLC: a review of its treatment approaches and future developments[J]. Lung Cancer, 2009, 65(3):257-267.
[12] Robinson LA, Ruckdeschel JC, Wagner H, et al. Treatment of non-small cell lung cancer-Stage IIIA:ACCP evidence-based clinical practice guidelines[J]. Chest, 2007, 132(3 suppl):243S-265S.
[13] Marchetti A, Martella C, Felicioni L, et al. EGFR mutations in non-small-cell lung cancer: analysis of a large series of cases and development of a rapid and sensitive method for diagnostic screening with potential implications on pharmacologic treatment[J]. J Clin Oncol, 2005, 23(4):857-865.
[14] Lee CK, Brown C, Gralla RJ, et al. Impact of EGFR inhibitor in non-small cell lung cancer on progression-free and overall survival: a meta-analysis[J]. J Natl Cancer Inst, 2013, 105(9):595-605.
[15] Wang KF, Chang CY, Chang SC, et al. Both gefitinib and erlotinib induced drug-related interstitial lung disease in a patient with pulmonary adenocarcinoma[J]. J Chin Med Assoc, 2013, 76(3):173-175.
[16] Jones SJ, Milenkova T. ILD during erlotinib and gefitinib treatment in Japanese patients with non-small cell lung cancer[J]. J Thorac Oncol, 2010, 5(11):1877-1878.
[17] Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemothe-rapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802):a multicentre, open-label, randomised, phase 3 study[J]. Lancet Oncol, 2011, 12(8):735-742.

