发光二极管荧光显微镜检测结核分枝杆菌在基层实验室的应用评价
宋媛媛 蒋明霞 郭占清 夏辉 赵雁林
在我国基层结核病实验室使用萋-尼(Ziehl-Neelsen,Z-N)抗酸染色方法对痰涂片进行染色,应用普通光学显微镜检测结核分枝杆菌仍然是诊断肺结核的常规方法。此检测方法成本低廉、操作简单、特异度较高,但其缺点是敏感度较低。而通过荧光染色,普通荧光显微镜检测结核分枝杆菌较普通光学显微镜敏感度能提高8%,且特异度与普通光学显微镜相当[1]。但普通荧光显微镜价格昂贵,且需要维修费用及暗室条件,限制了在我国的应用。发光二极管(light emitting diodes,LED)荧光显微镜可以很好地解决这些问题,并且很多研究也显示其具有很好的应用价值[1-5]。2011年7月至2011年9月笔者在青海省西宁市7个县(区)级结核病防治机构(简称“结防机构”)研究LED荧光显微镜在我国基层结核病实验室检测痰涂片中结核分枝杆菌的应用效果,现将结果报告如下。
材料和方法
一、试剂和材料
研究过程中,各县(区)级结防机构使用由省级结核病参比实验室统一配发的染色液。传统光学显微镜为奥林巴斯CX21FS1-2,使用100倍物镜观察痰涂片。LED荧光显微镜为蔡司公司Primo star iLED, 应用20倍物镜观察痰涂片。
二、研究对象
研究阶段(2011年7月至2011年9月)连续收集西宁市的城东区、城中区、城西区、城北区、大通县、湟源县、湟中县7个县(区)级结防机构就诊的初诊肺结核可疑症状者,共纳入592例(1738份痰标本)。有6.42%(38/592)的患者收集到2份痰标本,93.58%(554/592)的患者收集到3份痰标本。
三、试验方法
每份痰标本制作2张涂片,在不同实验室由1名实验人员根据国家规划要求采用萋-尼染色和荧光染色,并分别用传统光学显微镜和LED荧光显微镜检测,操作方法参见文献[6]。每份痰标本同时由省级结核病参比实验室进行简单法固体罗氏培养,试验方法参见文献[7]。
四、统计学分析
所有数据由国家结核病参比实验室审核后,双人双录入专门建立的EpiData数据库中,用SAS 9.2软件进行统计学分析。用配对χ2检验比较应用两种显微镜检测痰标本中结核分枝杆菌的阳性检出率;用ROC曲线下面积评价两种显微镜诊断肺结核的价值。完全无价值的诊断试验曲线下面积为0.5,理想的诊断试验曲线下面积为1,而一般认为对于一个诊断试验,ROC曲线下面积在0.5~0.7之间时诊断价值较低,在0.7~0.9之间时诊断价值中等,在0.9以上时诊断价值较高[8];用t检验对检出时间的差异进行统计学分析,P<0.05认为差异有统计学意义。
五、质量控制
在研究工作正式开始前对所有操作人员开展为期1周的培训,并经熟练度测试合格后试运行1个月,然后正式开始研究。各研究点统一使用由省级配制的染色液,染色液发放之前已经通过质量控制合格。对于同一张涂片的两种镜检方法采用盲法进行操作。培养基由省级结核病参比实验室自行配制,经过无菌测试合格后使用。
结 果
一、传统光学显微镜与LED荧光显微镜两种方法对痰涂片的阳性检出率比较
传统光学显微镜和LED荧光显微镜的涂片阳性检出率分别为13.75%(239/1738)和14.90%(259/1738),后者较前者提高1.15个百分点,两种镜检方法的阳性检出率差异有统计学意义(Z=5.88,P<0.05)。
二、传统光学显微镜与LED荧光显微镜两种方法对诊断肺结核患者的价值比较
培养是细菌学诊断结核病的金标准,因此研究中对每份痰标本都做了简单法固体罗氏培养试验,共计1738份,其中有2份培养污染,不计入分析。以培养结果为金标准,进一步分析传统光学显微镜和LED荧光显微镜镜检结果的准确性,传统光学显微镜敏感度为79.60%(199/250,95%CI=74.60%~84.60%),特异度为97.31%(1446/1486,95%CI=96.49%~98.13%)。LED荧光显微镜敏感度为84.80%(212/250, 95%CI=80.30%~89.25%),特异度为96.84%(1439/1486, 95%CI=95.95%~97.73%)(表1)。
每份痰标本两种显微镜的镜检结果分别与培养结果比较绘制诊断肺结核患者的ROC曲线(图1,2)。从表2可见,用传统光学显微镜诊断肺结核患者时ROC曲线下面积为0.8878(95%CI=0.8623~0.9133),与完全无价值的诊断试验曲线下面积0.5相比差异有统计学意义(Z=29.8308,P<0.01);LED荧光显微镜ROC曲线下面积为0.9118(95%CI=0.8890~0.9347),与0.5相比差异有统计学意义(Z=35.1966,P<0.01)。传统光学显微镜和LED荧光显微镜两种镜检方法均具有中高度的诊断价值,LED荧光显微镜具有更高的诊断价值。对两种方法的曲线下面积进行比较,差异有统计学意义(χ2=4.4236,P<0.05),即两种方法的诊断价值差异有统计学意义。
三、传统光学显微镜和LED荧光显微镜读片时间分析
比较两种镜检方法在阅读不同级别涂片所花费的时间(表3),成组分析两种方法的读片时间可见,LED荧光显微镜的平均读片时间明显短于传统光学显微镜,两者差异有统计学意义(t=15.32,P<0.01),除结果为实际细菌条数的涂片外,其他各阳性级别涂片两种方法的读片时间差异均有统计学意义(P<0.01)。

表2 传统光学显微镜和LED荧光显微镜诊断肺结核患者的ROC曲线下面积
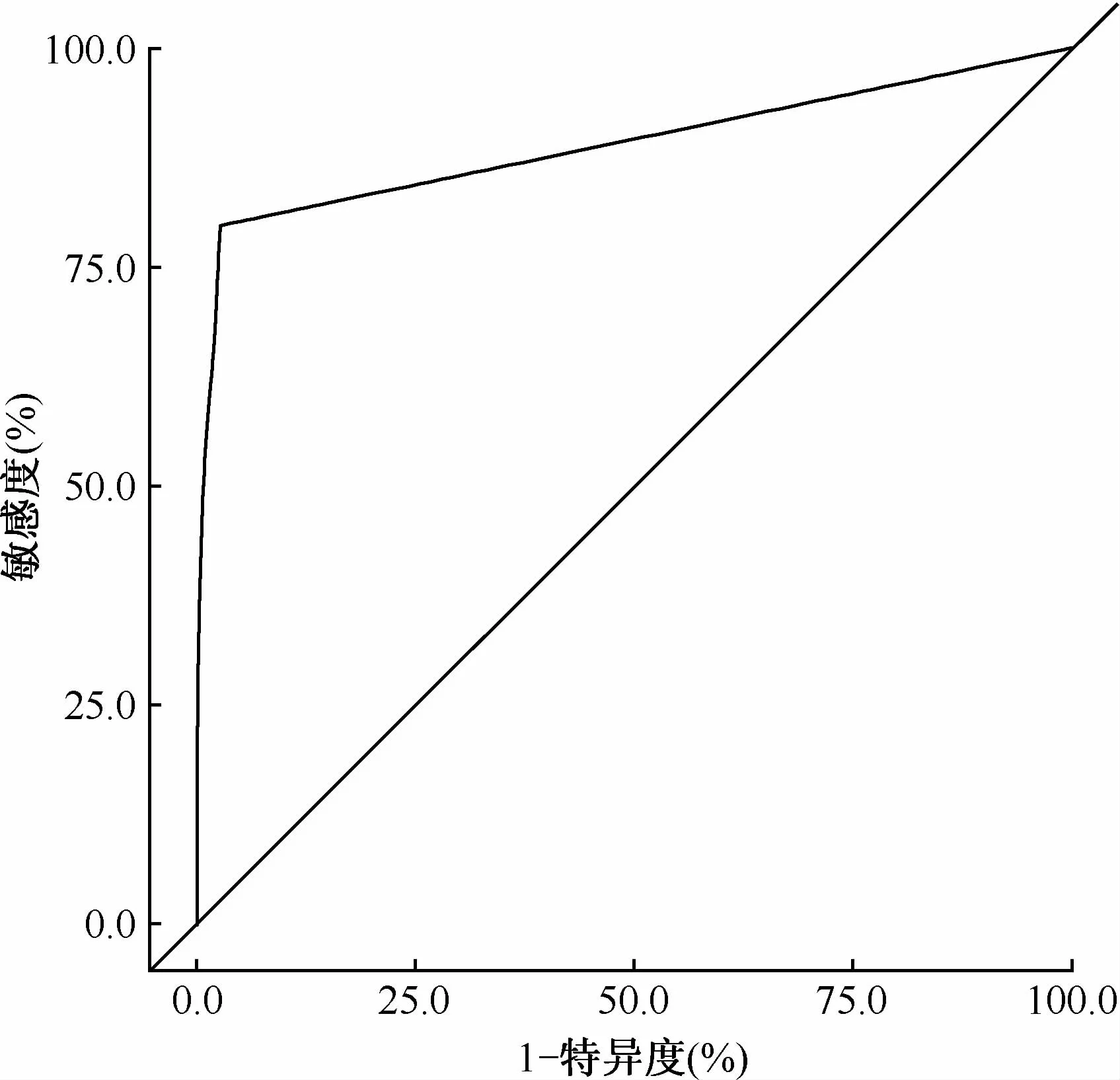
图1 传统光学显微镜诊断肺结核患者的ROC曲线

图2 LED荧光显微镜诊断肺结核患者的ROC曲线
表3不同镜检结果采用传统光学显微镜与LED荧光显微镜的读片时间比较
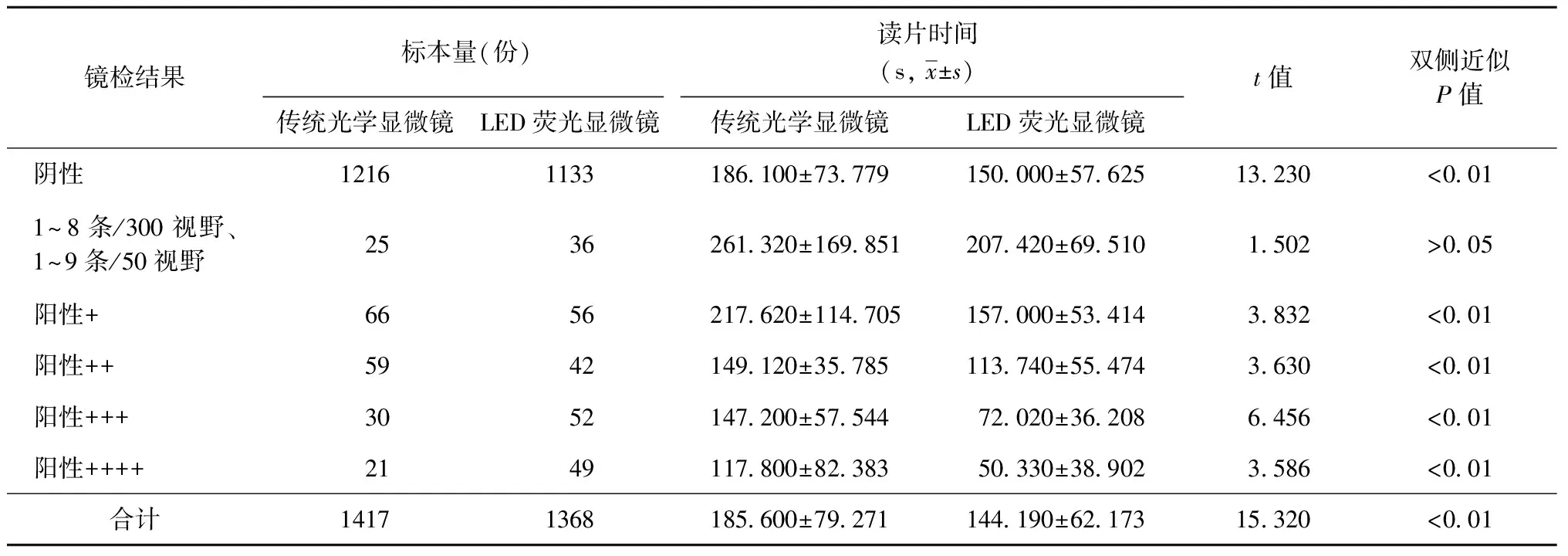
镜检结果标本量(份)读片时间(s,x±s)传统光学显微镜LED荧光显微镜传统光学显微镜LED荧光显微镜t值双侧近似P值阴性12161133186 100±73 779150 000±57 62513 230<0 011~8条/300视野、1~9条/50视野2536261 320±169 851207 420±69 5101 502>0 05阳性+6656217 620±114 705157 000±53 4143 832<0 01阳性++5942149 120±35 785113 740±55 4743 630<0 01阳性+++3052147 200±57 54472 020±36 2086 456<0 01阳性++++2149117 800±82 38350 330±38 9023 586<0 01合计14171368185 600±79 271144 190±62 17315 320<0 01
讨 论
本研究中评价了传统光学显微镜与LED荧光显微镜两种镜检方法对痰涂片的阳性检出率差异,据文献[1,3,9-12]报道LED荧光显微镜比传统光学显微镜阳性检出率增加值范围多数在0%~33%,其中一篇系统的回顾性研究中得出阳性检出率平均增加值为9%(95%CI=5%~13%),差异有统计学意义[1]。本研究结果显示LED荧光显微镜比传统光学显微镜涂片阳性检出率提高1.15个百分点。两种镜检方法的总体检出率差异有统计学意义(Z=5.88,P<0.05),与文献[1,3,9-12]研究结果相符。
以简单法固体罗氏培养结果为金标准,进一步分析传统光学显微镜、LED荧光显微镜检测结果的准确性。有学者研究表明LED荧光显微镜比传统光学显微镜敏感度最多提高到39.32%,最低降低到9%;特异度最多提高到1.00%,最多降低到8.4%[2-4,9,12-13];其中一篇系统的回顾性研究中得出敏感度平均增加8%,特异度平均无变化,为0%[1]。本研究得出的结果与文献[1-4,9,12-13]结果一致。因此,可得出“LED荧光显微镜诊断肺结核较传统光学显微镜有更高的敏感度,而特异度相当”。
每份痰标本两种显微镜的镜检结果分别与培养结果进行比较绘制诊断肺结核患者的ROC曲线,传统光学显微镜和LED荧光显微镜两种镜检方法均具有中高度的诊断价值,LED荧光显微镜具有更高的诊断价值,两种方法的诊断价值差异有统计学意义(χ2=4.4236,P<0.05)。因此,LED荧光显微镜替代传统光学显微镜可以提高诊断肺结核的价值。
LED荧光显微镜较传统光学显微镜读片时间明显缩短(节省22.31%时间)。但同时需要注意的是,国际上推荐用传统光学显微镜平均读片时间为5~10 min[14],但实际我国基层实验室工作量大,工作人员熟练程度高,他们的读片时间一般在2~5 min。有研究表明,如果用10 min的时间重新观察阴性涂片,会提高50%的阳性检出率[15]。但是如果每张涂片观察10 min,在我国基层实验室难以实现。本研究中使用传统光学显微镜的平均读片时间为185.6 s,读片时间较短也是导致各实验室阳性检出率低的一个因素。考虑到实验室人员使用LED荧光显微镜时间较短,熟练程度还不够高,这也对读片时间差异有一定影响。对于工作负荷重的实验室,使用LED荧光显微镜可以节约人力时间,减轻工作负荷。
从本研究结果可以看出,LED荧光显微镜与传统光学显微镜相比较,痰涂片阳性检出率明显提高,且具有更高的敏感度,但特异度相当,诊断肺结核患者的价值更高,读片时间明显缩短。使用LED荧光显微镜对人员教育背景、工作经验等无特殊要求,现有的从事实验室镜检的工作人员经过培训并熟练掌握后均可以开展工作。生物安全要求与现有涂片镜检方法相同,维护成本较低。但在推广使用时应对实验人员掌握的熟练程度情况予以重视,并需完善现有的荧光涂片质量控制体系,以便更好地开展盲法复检工作。LED荧光显微镜在我国基层实验室有一定的推广和应用价值,建议推广使用前进行扩大样本量研究,并做相应的经济学评价。
志谢感谢青海省疾病预防控制中心、西宁市疾病预防控制中心及西宁市七县(区)疾病预防控制中心结核病实验室工作人员在研究现场的辛勤工作!
[1] Steingart KR,Henry M,Ng V,et al. Fluorescence versus conventional sputum smear microscopy for tuberculosis:a syste-matic review. Lancet Infect Dis,2006,6(9):570-581.
[2] Cuevas LE, Al-Sonboli N, Lawson L,et al. LED fluorescence microscopy for the diagnosis of pulmonary tuberculosis: a multi-country cross-sectional evaluation.PLoS Med,2011,8(7):e1001057.
[3] Chaidir L, Parwati I, Annisa J, et al. Implementation of LED fluorescence microscopy for diagnosis of pulmonary and HIV-associated tuberculosis in a hospital setting in Indonesia.PLoS One,2013,8(4):e61727.
[4] World Health Organization. Fluorescent light-emitting diode (LED) microscopy for diagnosis of tuberculosis policy.WHO/HTM/TB/2011.8.http://whqlibdoc.who.int/publications/2011/9789241501613_eng.pdf?ua=1.
[5] Khatun Z,Kamal M,Roy CK, et al. Usefulness of light emitting diode (LED) fluorescent microscopy as a tool for rapid and effective method for the diagnosis of pulmonary tuberculosis. Bangladesh Med Res Counc Bull,2011,37(1):7-10.
[6] 赵雁林.痰涂片显微镜检查标准化操作及质量保证手册.北京:中国协和医科大学出版社,2009:7.
[7] 赵雁林. 分枝杆菌分离培养标准化操作程序及质量保证手册.北京:人民卫生出版社,2013:4.
[8] 余松林.医学统计学.北京:人民卫生出版社,2002.
[9] Trusov A, Bumgarner R, Valijev R,et al.Comparison of lu-min LED fluorescent attachment, fluorescent microscopy and Ziehl-Neelsen for AFB diagnosis. Int J Tuberc Lung Dis,2009,13(7):836-841.
[10] Habtamu M, van den Boogaard J, Ndaro A, et al. Light-emitting diode with various sputum smear preparation techniques to diagnose tuberculosis. Int J Tuberc Lung Dis,2012,16(3):402-407.
[11] Xia H, Song YY, Zhao B, et al. Multicentre evaluation of Ziehl-Neelsen and light-emitting diode fluorescence microscopy in China.Int J Tuberc Lung Dis,2013,17(1):107-112.
[12] Khatun Z, Kamal M, Roy CK,et al.Usefulness of light emitting diode (LED) fluorescent microscopy as a tool for rapid and effective method for the diagnosis of pulmonary tuberculosis.Bangladesh Med Res Counc Bull,2011,37(1):7-10.
[13] Bonnet M, Gagnidze L, Githui W,et al. Performance of LED-based fluorescence microscopy to diagnose tuberculosis in a peripheral health centre in Nairobi.PLoS One, 2011,6(2):e17214.
[14] International Union Against Tuberculosis and Lung Disease(IUATLD) technical guide.Sputum examination for tuberculosis by direct microscopy in low-income countries.5th ed. Paris: IUATLD,2000.
[15] Cambanis A, Ramsay A, Wirkom V,et al.Investing time in microscopy: an opportunity to optimise smear-based case detection of tuberculosis.Int J Tuberc Lung Dis,2007,11(1):40-45.

