苜蓿夜蛾促前胸腺激素基因的克隆与原核表达
周夏 郭博智 高艳玲 赵奎军 樊东
(东北农业大学农学院,哈尔滨 150030)
苜蓿夜蛾促前胸腺激素基因的克隆与原核表达
周夏 郭博智 高艳玲 赵奎军 樊东
(东北农业大学农学院,哈尔滨 150030)
促前胸腺激素(Prothoracicotropic hormone,PTTH)是一类重要的昆虫激素,它对昆虫生长、蜕皮、变态、滞育具有重要调控作用。以苜蓿夜蛾5龄幼虫为材料提取总RNA,利用RT-PCR和RACE技术,扩增得到苜蓿夜蛾促前胸腺激素基因的cDNA序列,该序列含有823个碱基,包括1个681个碱基的开放阅读框,编码1个含226个氨基酸的蛋白,分子量约为26.3 kD,等电点为8.51。序列分析表明,苜蓿夜蛾PTTH的氨基酸序列与其他昆虫,尤其是鳞翅目夜蛾科昆虫的PTTH高度同源。获得的基因已登录GenBank,登录号为JF731347。利用原核表达载体pET21b在大肠杆菌中成功表达了苜蓿夜蛾PTTH基因,并用Ni-NTA亲和层析柱将带His-tag的目的蛋白进行纯化。
苜蓿夜蛾 促前胸腺激素 基因序列克隆 原核表达
促前胸腺激素(Prothoracicotropic hormone,简称PTTH)是由大脑神经分泌细胞产生,刺激前胸腺分泌蜕皮酮的神经肽类激素,对昆虫的生长发育、蜕皮、变态、滞育[1-3]等起到重要的调控作用。作为第一个在无脊椎动物中发现的激素,PTTH的研究始于1922年,由波兰学者Kopec通过对舞毒蛾Lymantria dispar幼虫蜕皮前进行结扎、摘除脑的试验发现昆虫形态变化受脑控制,他将其命名为脑激素[4]。1940年Wigglesworth在长红猎椿Rhodnius prolixus中发现脑激素是由脑神经分泌细胞产生的[5]。随后Williams于1947年以惜古比天蚕的滞育蛹为材料,证明这种脑激素具有促进前胸腺分泌蜕皮激素诱导变态的作用,所以把脑激素改称为PTTH[6]。近年来对PTTH的研究不断深入,对家蚕神经肽促
前胸腺激素研究发现,家蚕PTTH基因mRNA的发育表达变化可能与其调控蜕皮激素合成的功能有关[7]。为了明确PTTH受体及其作用机制,Rewitz等[8]发现果蝇前胸腺特异性表达的Torso基因编码PTTH受体[9],而非之前人们猜测的G-蛋白偶联受体。2012年王秋实等[10]从柞蚕中克隆得到血清素受体B(5HTRB),利用RNA干扰技术把5HTRB基因的dsRNA注射进入虫体,导致柞蚕滞育的终止,同时发现PTTH表达量增加,证明5HTRB可以抑制PTTH的合成,从而推测其可能是柞蚕的PTTH受体。为了研究PTTH对滞育蛹的作用,Mizoguchi等[11]于2013年研究发现甘蓝夜蛾Mamestra brassicae非滞育蛹化蛹后血淋巴中PTTH滴度维持在较高水平,而滞育蛹化蛹后PTTH滴度降到很低水平;相反化蛹后滞育蛹脑中PTTH表达量比在非滞育蛹脑中表达量高。这说明滞育蛹的脑中PTTH的表达量较高,但不释放到血淋巴中。在立即注射PTTH后滞育蛹被诱导而化蛹,因此蛹滞育被证实是由于PTTH的分泌终止造成的。
1990 年Kawakami等[12]用分子克隆的方法第一次得到全长的家蚕PTTH分子,并证实具有活性的家蚕PTTH是一个糖基化的同源二聚体,通过一个分子间和三个分子内的二硫键构成[13]。目前已经在烟芽夜蛾Heliothis virescens AY172671[14],棉铃虫Helicoverpa armigera AY286543[3],谷实夜蛾Helicoverpa zea AY172670[15],烟实夜蛾Helicoverpa assulta AY780526,甜菜夜蛾Spodoptera exigua AY780527[16],甘蓝夜蛾AB748456[11],家蚕Bombyx mori NM_001-043884,烟草天蛾Manduca sexta AY007724[17],惜古比天蚕AF288695[18],柞蚕U62535[19],日本柞蚕Antheraea yamamai AY461435中成功克隆得到PTTH基因,这些基因的获得为PTTH的深入研究提供了依据。
苜蓿夜蛾Heliothis viriplaca属鳞翅目,夜蛾科,主要危害豆科植物,如大豆、苜蓿等。苜蓿夜蛾以幼虫直接取食为害,其分布广泛,已成为大豆田中的重要食叶性害虫。本研究克隆苜蓿夜蛾PTTH,获取基因cDNA全长序列,并对该基因在大肠杆菌中的表达进行研究,旨在为进一步利用该基因从分子水平防治苜蓿夜蛾奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试虫源 利用黑光灯在田间诱集苜蓿夜蛾成虫,室内饲以5%蜂蜜水使其产卵,并用未接触任何农药的新鲜豆叶做饲料喂养到5龄幼虫备用。
1.1.2 菌株、质粒及主要试剂 受体菌DH5α、BL21、表达载体pET21b由本研究室保存。RNA提取试剂盒TRIzol®Reagent(购自Invitrogen公司);反转录酶M-MLV Reverse Transcriptase、T4 DNA连接酶、低熔点琼脂糖(购自Fermentas(FBI)公司);克隆载体pMD18-T、DNA 胶回收试剂盒、DL2000 DNA Marker、TaKaRa 5'-Full RACE Kit(购自TaKa-Ra公司);蛋白Marker和Ni-NTA亲和层析柱购于北京全式金公司。
1.2 方法
1.2.1 总RNA的提取及cDNA的合成 按照TRIzol®Reagent试剂说明提取已进行饥饿处理12 h的苜蓿夜蛾5龄幼虫的总RNA,进行纯度和完整性鉴定后放入-80℃冰箱中备用。以dt-R0-Ri(表1)为cDNA合成引物,利用反转录酶M-MLV合成cDNA。最终产物保存于-20℃冰箱中。
1.2.2 引物设计与合成 本研究所用引物及用途见表1,引物由南京金斯瑞生物科技有限公司合成。
1.2.3 PCR产物克隆、鉴定及序列测定 比较烟蚜夜蛾(AY172671)以及棉铃虫(AY286543)两种昆虫PTTH基因的cDNA序列,设计1对适用于克隆苜蓿夜蛾PTTH基因cDNA序列的部分片段的引物:PTTH 和antiPTTH(表1)。PCR反应条件为:94℃预变性5 min;94℃ 30 s,52℃ 30 s,72℃ 1 min,30个循环;72℃延伸10 min,PCR产物经1.0%琼脂糖凝胶电泳检测后,回收,与pMD18-T vector连接、转化到E.coli DH5α培养、双酶切鉴定。连接正确的重组子由哈尔滨博仕生物技术公司进行序列测定。
1.2.4 利用RACE技术克隆cDNA全长序列 根据得到的基因片段设计PTTH 3'端cDNA序列的引物PTTH3' Ro和PTTH3' Ri(表1)。用PTTH3' Ro与3'-Ro进行Outer PCR,电泳检测后,用PTTH3' Ri和3'-Ri对Outer PCR产物进行巢式PCR扩增,然后进行3'RACE产物电泳分离检测、克隆和测序,方法
同上。

表1 本试验中所用引物
5' RACE反应按照TaKaRa 5' Full RACE Kit说明书,合成cDNA第一链,用PTTH 5' Ro和试剂盒提供的5'-RACE Outer Primer进行第一轮扩增,然后以扩增产物为模板,用PTTH 5' Ri和5'-RACE Inner Primer(表1)进行巢式PCR扩增,最后5' RACE产物进行电泳分离检测、克隆和测序,方法同上。
进入21世纪以来,通过“数字黄河”工程建设、水质自动监测体系建设、黄河水资源保护重大问题研究等,水资源保护现代化水平和科技支撑能力不断提高。
对以上几个反应获得的序列片段进行拼接,获得PTTH的全长序列,根据全长序列设计克隆基因全长序列的引物PTTHF和PTTHR(表1),一次性克隆全长序列。
1.2.5 序列分析 用BioXM2.6软件对获得的cDNA序列进行翻译;利用ExPASy 网站(http://us. expasy.org/tools/dna.html)蛋白分析软件推导氨基酸序列的分子质量、等电点和结构域;SignalP 4.1 Server进行信号肽的预测;CFSSP软件进行二级结构的预测;SWISS-MODEL服务器进行自动建模(Automate Mode),预测该蛋白的三维结构;同源性比较采用NCBI中的BLAST工具;进化树构建采用ClustalX、MEGA4.1软件。
1.2.6 苜蓿夜蛾PTTH基因原核表达及纯化 用引物PTTH EcoR I(含EcoR I酶切位点)和PTTH Xho I(含Xho I酶切位点)(引物序列见表1)进行PCR扩增,反应结束后产物电泳检测并回收。对回收产物和表达载体pET21b分别进行双酶切,产物回收后使用T4连接酶16℃过夜连接,构建表达载体pET21b-PTTH,并转至DH5α感受态细胞中。蓝白斑筛选出阳性克隆,摇菌、测序、提取质粒,用EcoR I和Xho I双酶切鉴定并测序验证,鉴定正确的重组质粒转至BL21中。使用IPTG诱导表达,SDS-PAGE凝胶电泳检测,表达之后使用Ni-NTA亲和层析柱纯化带His-tag的目的蛋白。
2 结果
2.1 苜蓿夜蛾PTTH的cDNA序列
利用RT-PCR和RACE获得了苜蓿夜蛾PTTH的cDNA全长序列(图1)。序列大小为823个碱基,开放读码框编码226个氨基酸的多肽(图2),分子量为26.3 kD,等电点为8.51。核苷酸序列在GenBank登录,登录号为JF731347。

图1 苜蓿夜蛾PTTH全长cDNA序列的PCR扩增产物
2.2 PTTH基因编码蛋白质的氨基酸序列特征分析
利用Expasy molecular biology server的Scanprosite facility对推导的苜蓿夜蛾促前胸腺激素氨基酸
的结构域进行预测。推导得到的苜蓿夜蛾促前胸腺激素氨基酸序列含有一个N-位糖基化位点和一个O-位糖基化位点。SignalP4.0进行信号肽分析时发现PTTH推导的氨基酸在28和29位之间存在一个信号肽切割位点。含有PTTH特有的7个半胱氨酸残基。通过CFSSP软件预测PTTH蛋白的二级结构,预测结果(图3)显示,β-折叠和α-螺旋是其最主要的二级结构元件,其次是无规则卷曲和β-转角。预测得到PTTH蛋白的三维结构(图4)。

图2 苜蓿夜蛾PTTH基因核苷酸序列及推导的氨基酸序列

图3 苜蓿夜蛾PTTH蛋白的二级结构

图4 PTTH蛋白的三级结构
氨基酸序列比对结果表明,苜蓿夜蛾PTTH与其他登录GenBank的昆虫PTTH序列一致性达60%以上,其中与烟芽夜蛾(AY172671)、棉铃虫(AY286543)一致性最高,达92%,与谷实夜蛾(AY172670)、烟实夜蛾(AY780526)、甜菜夜蛾(AY780527)、甘蓝夜蛾(AB748456)的一致性分别为91%、91%、75%和73%(图5);聚类分析表明苜蓿夜蛾PTTH与夜蛾科昆虫PTTH亲缘性相对较近,与非夜蛾科的鳞翅目昆虫的亲缘关系相对较远。苜蓿夜蛾与烟蚜夜蛾同源性最高,其在分类学上属
于同一个属Heliothis;而谷实夜蛾、棉铃虫和烟实夜蛾所在属Helicoverpa与苜蓿夜蛾所在属Heliothis是近缘属,所以苜蓿夜蛾PTTH与这3个昆虫PTTH的同源性相对较高(图6)。

图5 不同昆虫PTTH氨基酸序列的多重比对
2.4 PTTH基因的原核表达分析
原核表达结果(图7)表明,含非重组载体pET21b的BL21经诱导后未检测到目的条带,而含目的基因的重组载体pET21b-PTTH的BL21经IPTG诱导后,在26.3 kD左右出现特异性蛋白表达条带,与预测的蛋白质分子量接近。利用Ni-NTA亲和层析柱纯化蛋白,从图7中5、6泳道可以看出,用咪唑缓冲液可以把目的蛋白洗脱出来,证明获得较高纯度的重组蛋白。
3 讨论
本试验克隆得到一条苜蓿夜蛾促前胸腺激素的cDNA序列,通过与其他昆虫PTTH基因进行同源性
比较,可以明显看出苜蓿夜蛾PTTH基因与鳞翅目4个夜蛾科昆虫烟蚜夜蛾、棉铃虫、烟实夜蛾和谷实夜蛾的同源性较高,而与家蚕、柞蚕、惜古比天蛾和日本柞蚕同源性较低。事实上,苜蓿夜蛾与烟芽夜蛾在分类学上属于同一个属Heliothis,所以同源性最高;而苜蓿夜蛾所在属Heliothis与谷实夜蛾、棉铃虫和烟实夜蛾所在属Helicoverpa是近缘属,所以苜蓿夜蛾PTTH与这3个昆虫PTTH的同源性相对较高;苜蓿夜蛾与甜菜夜蛾、甘蓝夜蛾虽然同属夜蛾科,但所在属是非近缘属,所以同源性相对较低;同理苜蓿夜蛾与其他鳞翅目非夜蛾科昆虫PTTH同源性更低。
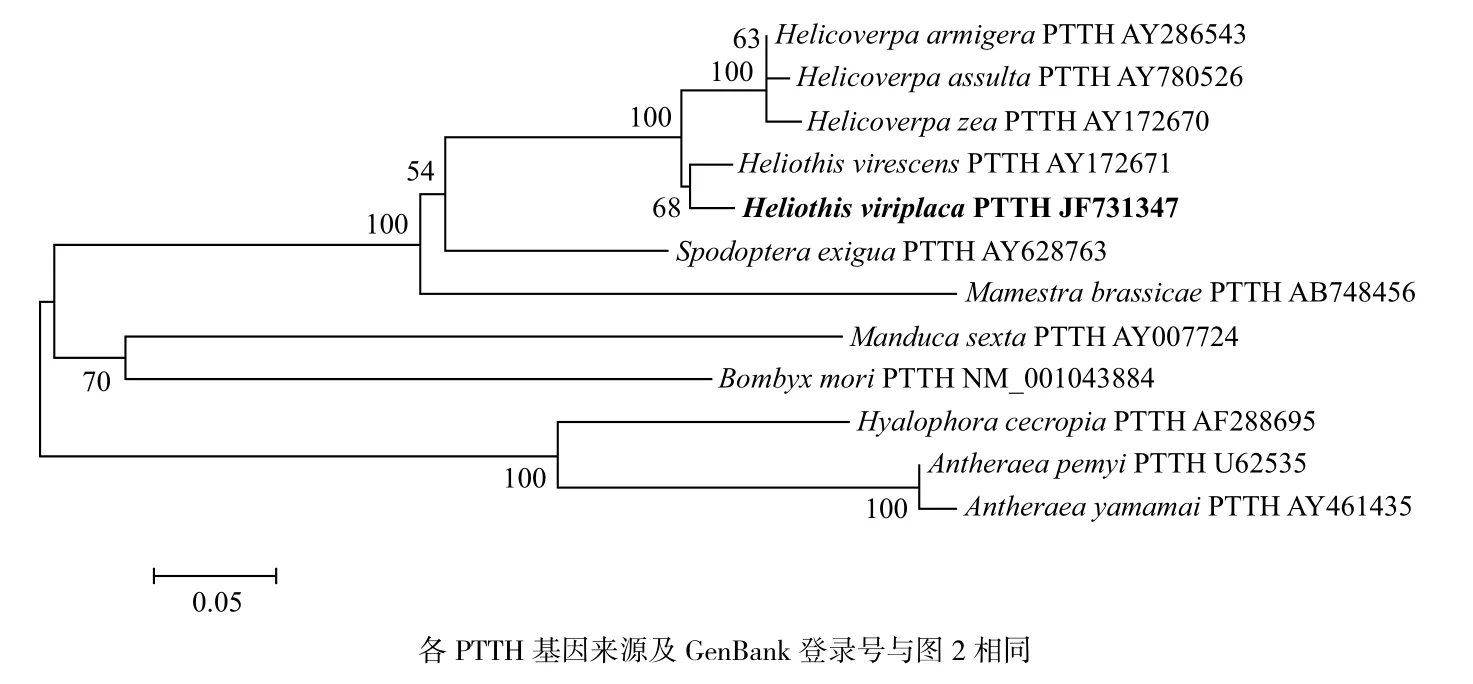
图 6 利用邻接法构建的鳞翅目不同种类昆虫的PTTH基因系统进化树

图7 苜蓿夜蛾PTTH SDS-PAGE 电泳结果
构建的原核表达载体pET21b-PTTH在37℃诱导表达,经SDS-PAGE分离,在大肠杆菌中高效表达出融合蛋白,但为包涵体蛋白。该表达系统能否表达出可溶性蛋白可通过进一步的条件优化进行探讨或者利用其他真核表达系统进行研究。表达蛋白的获得为下一步制备单克隆抗体及其生理功能研究奠定基础。
Xu等[16]在分析甜菜夜蛾PTTH mRNA不同时期表达量发现,mRNA在幼虫期有一定的表达,并且在龄末升高;在化蛹初期有高表达,蛹中期维持在一定的表达水平,蛹末期则不断增加,羽化前达到较高的表达水平;甜菜夜蛾幼虫期和蛹期的PTTH含量变化和蜕皮变态的周期是完全一致的,显示出PTTH在甜菜夜蛾行使其生物学功能很可能也是通过刺激前胸腺合成和分泌蜕皮激素来完成的。本研究后续工作将围绕PTTH调节机制展开,明确不同发育阶段、不同时间、不同光周期对苜蓿夜蛾PTTH及蜕皮激素表达量的变化,进而研究两者之间的关系。同时可通过RNAi技术手段研究苜蓿夜蛾PTTH的合成与释放,设计相应的药物分子控制害虫的生长发育,通过分子生物学手段以达到高效、绿色控制苜蓿夜蛾的目的。
4 结论
获得苜蓿夜蛾PTTH cDNA全长,序列含有823个碱基,包括一个681个碱基的开放阅读框,编码一个含226个氨基酸的蛋白,分子量约为26.3 kD,等电点为8.51。GenBank登录号JF731347。同源序列比对发现,苜蓿夜蛾PTTH氨基酸序列与其他昆虫高度同源。构建了原核表达载体pET21b-PTTH,在大肠杆菌(BL21)中成功表达并获得了纯化的目的蛋白。
[1]Denlinger DL. Hormonal control of diapause[M]//Kerkut GA,
Gilbert LI(Eds). Comprehensive Insect Physiology, Biochemistry and Pharmacology, 1985, 8:353-412.
[2]Gilbert LI, Rybczynski R, Warren JT. Control and biochemical nature of the ecdysteroidogenic pathway[J]. Annual Review of Entomology, 2002, 47(1):883-916.
[3]Wei ZJ, Zhang QR, Kang L, et al. Molecular characterization and expression of prothoracicotropic hormone during development and pupal diapause in the cotton bollworm, Helicoverpa armigera[J]. Journal of Insect Physiology, 2005, 51(6):691-700.
[4]Kopeć S. Studies on the necessity of the brain for the inception of insect metamorphosis[J]. The Biological Bulletin, 1922, 42(6):323-342.
[5]Bickmeyer U, Rössler W, Wiegand H. Calcium channel currents in cultured pars intercerebralis neurosecretory cells of adult Locusta migratoria[J]. Journal of Experimental Biology, 1994, 197(1):393-398.
[6]Williams CM. Physiology of insect diapause. II. Interaction between the pupal brain and prothoracic glands in the metamorphosis of the giant silkworm, Platysamia cecropia[J]. Biological Bulletin, 1947(2):89-98.
[7]于淼, 陈复生, 魏兆军.家蚕神经肽促前胸腺激素基因mRNA的发育表达[J].安徽农业科学, 2012, 38(10):5518-5520.
[8]Rewitz KF, Yamanaka N, Gilbert LI, et al. The insect neuropeptide PTTH activates receptor tyrosine kinase torso to initiate metamorphosis[J]. Science, 2009, 326(5958):1403-1405.
[9]Nagata S, Namiki T, Ko R, et al. A novel type of receptor cDNA from the prothoracic glands of the silkworm, Bombyx mori[J]. Bioscience, Biotechnology, Biochemistry, 2006, 70(2):554-558.
[10]Wang Q, Mohamed AAM, Takeda M. Serotonin receptor B may Lock the Gate of PTTH Release/Synthesis in the Chinese Silk Moth, Antheraea pernyi;A Diapause Initiation/Maintenance Mechanism?[J]. PloS One, 2013, 8(11):e79381.
[11]Mizoguchi A, Ohsumi S, Kobayashi K, et al. Prothoracicotropic hormone acts as a neuroendocrine switch between pupal diapause and adult development[J]. PloS One, 2013, 8(4):e60824.
[12]Kawakami A, Kataoka H, Oka T, et al. Molecular cloning of the Bombyx mori prothoracicotropic hormone[J]. Science, 1990, 247(4948):1333-1335.
[13]Shizaki H, Suzuki A. The brain secretory peptides that control moulting and metamorphosis of the silk-moth[J]. Biology, 1994, 38(2):301-310.
[14]Xu WH, Denlinger DL. Molecular characterization of prothoracicotropic hormone and diapause hormone in Heliothis virescens during diapause, and a new role for diapause hormone[J]. Insect molecular biology, 2003, 12(5):509-516.
[15]Xu WH, Rinehart JP, Denlinger DL. Structural characterization and expression analysis of prothoracicotropic hormone in the corn earworm, Helicoverpa zea[J]. Peptides, 2003, 24(9):1319-1325.
[16]Xu J, Su JY, Shen JL, et al. Molecular characterization and developmental expression of the gene encoding the prothoracicotropic hormone in the beet armyworm, Spodoptera exigua[J]. Science in China Series C:Life Sciences, 2007, 50(4):466-472.
[17]Shionoya M, Matsubayashi H, Asahina M, et al. Molecular cloning of the prothoracicotropic hormone from the tobacco hornworm Manduca sexta[J]. Insect Biochemistry and Molecular Biology, 2003, 33(8):795-801.
[18]Sehnal F, Hansen I, Scheller K. The cDNA-structure of the prothoracicotropic hormone(PTTH)of the silkmoth Hyalophora cecropia[J]. Insect Biochemistry and Molecular Biology, 2002, 32(2):233-237.
[19]Sauman I, Reppert SM. Molecular characterization of prothoracicotropic hormone(PTTH)from the giant silkmoth Antheraea pernyi:Developmental appearance of PTTH-expressing cells and relationship to circadian clock cells in central brain[J]. Developmental Biology, 1996, 178(2):418-429.
(责任编辑 马鑫)
Molecular Cloning and Prokaryotic Expression of Prothoracicotropic Hormone cDNA Sequence from Heliothis viriplaca
Zhou Xia Guo Bozhi Gao Yanling Zhao Kuijun Fan Dong
(College of Agriculture,Northeast Agricultural University,Harbin 150030)
Prothoracicotropic hormone(PTTH)is a group of important insect hormones. They have vital effect on regulation of growth, ecdysis, metamorphosis and diapause of insects. Total RNA was isolated from the fifth instar larvae of Heliothis viriplaca. The cDNA sequence was cloned by RT-PCR and rapid amplification of cDNA ends(RACE). The cDNA sequence was 823 base pairs in length and contained an open reading frame of 681 base pairs, encoding for a polypeptide of 226 amino acid residues, with a predicted molecular weight of 26.3 kD and pI 8.51. Sequence analysis showed that the predicted amino acid shared extensive similarities with those from other insects, especially the lepidopteran noctuid insects. The cDNA sequence has been deposited in GenBank with accession No. JF731347. The cDNA sequence was successfully expressed by the recombinant prokaryotic expression vector pET21b in E. coli. The recombinant protein with His-tag was purified by Ni-NTA affinity chromatography.
Heliothis viriplaca Prothoracicotropic hormone cDNA cloning Prokaryotic expression
2014-03-27
国家现代农业产业技术体系建设专项基金项目(CARS-04)
周夏,女,硕士研究生,研究方向:昆虫生物化学与分子生物学;E-mail:dnzhouxia@163.com
樊东,男,博士,教授,博士生导师,研究方向:昆虫生物化学与分子生物学;E-mail:dnfd@163.com

