腹膜透析患者第一年死亡的危险因素分析
吴晶晶 袁杨刚 黄抱娣 任海滨 张 莉 毛慧娟 邢昌赢
腹膜透析(PD)是治疗慢性肾衰竭的重要替代治疗方法之一。目前已有大量透析登记资料表明,PD患者前三年的存活率高于血液透析(HD)患者,因此对终末期肾病(ESRD)患者的一体化治疗提倡首选PD。尽管PD技术在不断进步,并且具有操作简单、无需体外肝素化、对血流动力性影响小等优点,对心肺功能差无法耐受HD、无法建立血管瘘及无条件行HD患者尤为适用,但仍有部分患者在行PD后短期内死亡[1,2]。本研究探讨可能导致PD患者一年内死亡的原因,为临床选择更适合PD的患者及更合理地制定PD患者的治疗方案提供参考。
资料与方法
一般资料收集2003年1月至2014年3月期间南京医科大学第一附属医院PD中心接受PD治疗的248例患者的临床资料。所有PD患者均在本中心置管,定期复诊,并根据患者腹膜特性,临床指标及透析充分性调整透析处方和用药,平时电话随访。所有患者PD液采用美国百特公司葡萄糖透析液。其中18例患者在PD一年内死亡,230例患者PD存活超过一年。收集所有患者的临床数据,包括性别、年龄、原发病、合并症、尿量、血压、估算的肾小球滤过率(eGFR)、血红蛋白(Hb)、血清肌酐(SCr)、尿素氮(BUN)、尿酸(UA)、血清白蛋白(Alb)、钙、磷、钾、全段甲状旁腺激素(iPTH)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL)、低密度脂蛋白胆固醇(LDL)、C反应蛋白(CRP)、每周尿素清除指数(Kt/V)、每周肌酐清除率(Ccr)、心胸比、心脏射血分数(EF),进行对比分析。
统计学方法采用SPSS 20统计软件,计量资料两组间比较采用两独立样本比较的t检验。率的显著性差异用χ2检验。对可能导致PD患者一年内死亡的危险因素先行单因素分析,对有统计学意义的变量行Logistic回归分析,探讨影响PD患者一年内死亡的危险因素。P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
一般情况18例患者(男女各9例)在进入透析一年内死亡,死亡率为7.26%,平均年龄67.94±15.28岁(28~87岁)。原发病为良性小动脉性肾硬化症5例(27.78%),慢性肾小球肾炎3例(16.67%),糖尿病肾病3例(16.67%),狼疮性肾炎3例(16.67%),系统性血管炎肾损害3例(16.67%),紫癜性肾炎1例(5.56%)。PD持续时间为6d~12月,中位时间为4月。透析一年内死亡的原因主要是肺部感染和心血管事件(表1)。
230例患者透析超过一年,其中男108例,女122例,年龄47.80±16.41岁(5~87岁)。原发病为慢性肾小球肾炎158例(68.70%),糖尿病肾病20例(8.70%),良性小动脉性肾硬化症18例(7.83%),狼疮性肾炎8例(3.48%),多囊肾8例(3.48%),痛风性肾病3例(1.30%),肾病综合征2例(0.87%),系统性血管炎肾损害2例(0.87%),乙肝相关性肾炎2例(0.87%),慢性间质性肾炎2例(0.87%),肾结石2例(0.87%),急进性肾炎1例(0.43%),急性肾衰竭1例(0.43%),肾淀粉样变1例(0.43%),慢性肾盂肾炎1例(0.43%),先天性肾发育不良1例(0.43%)。其中透析超过一年死亡的患者24例,死亡原因见表1。
一年内死亡的单因素分析将两组患者的年龄、性别、血压、合并症进行比较,可见一年内死亡患者年龄高于对照组,且进入透析时更多合并糖尿病、肺部感染及心血管疾病(冠心病5例,心力衰竭1例)及使用免疫抑制剂(表2)。而性别、是否合并高血压、肝炎在两组之间无统计学差异。一年内死亡组和一年后死亡组死亡原因相比较,两组之间未见统计学差异,但总体一年内死亡组肺部感染率偏高(表1)。
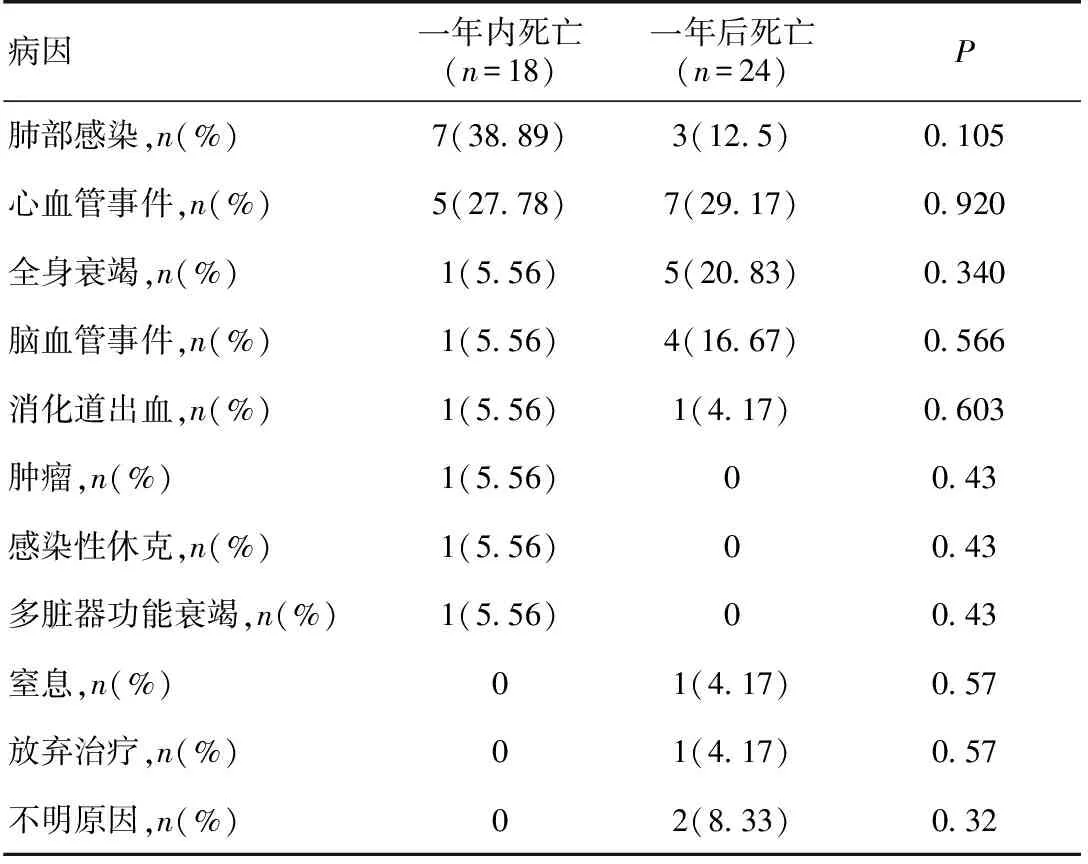
表1 两组患者死亡原因分析
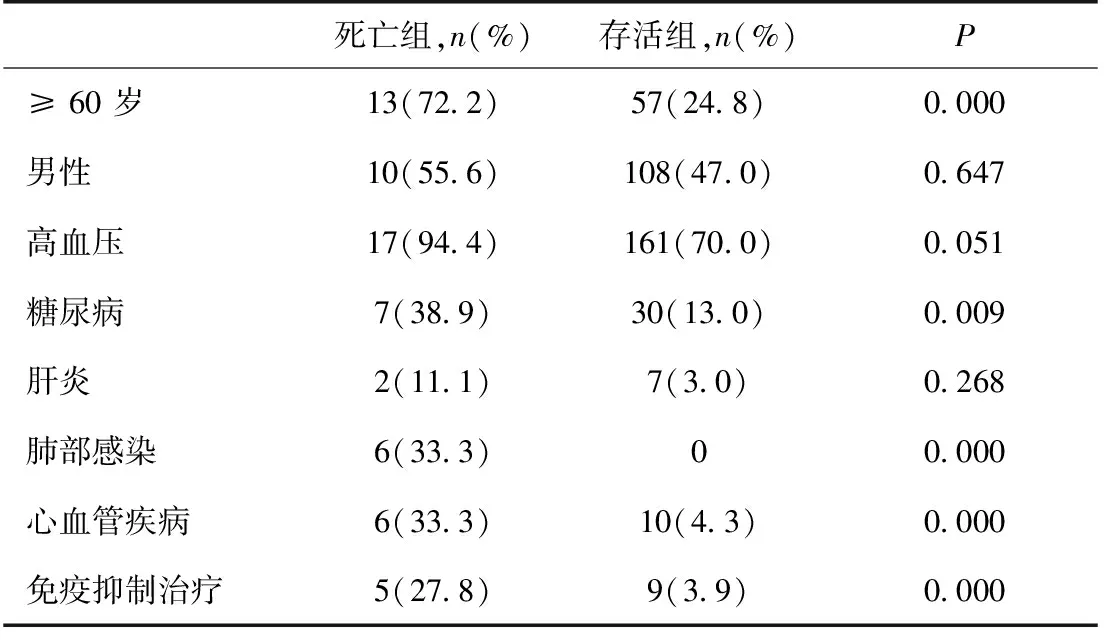
表2 两组患者透析一年内的临床基本情况及并发症
将两组患者的辅助检查结果进行单因素分析,两组之间尿量、Hb、TC、HDL、LDL、TG、BUN、UA、钙、磷、iPTH、每周Kt/V、每周Ccr、心胸比、EF之间无统计学差异(表3)。而一年内死亡患者eGFR高于对照组(P<0.05),Alb、SCr低于对照组(P<0.01),血钾低于对照组(P<0.05),CRP高于对照组(P<0.05)。

表3 辅助检查指标与一年内死亡的单因素分析
行Logistic回归分析显示,低Alb和高CRP是PD患者一年内死亡的独立危险因素(表4)。因变量取值为1=一年内死亡,0=一年内非死亡,Alb每增加一个单位一年内死亡的风险减少22.1%,CRP每增加一个单位一年内死亡的风险增加1.2%。
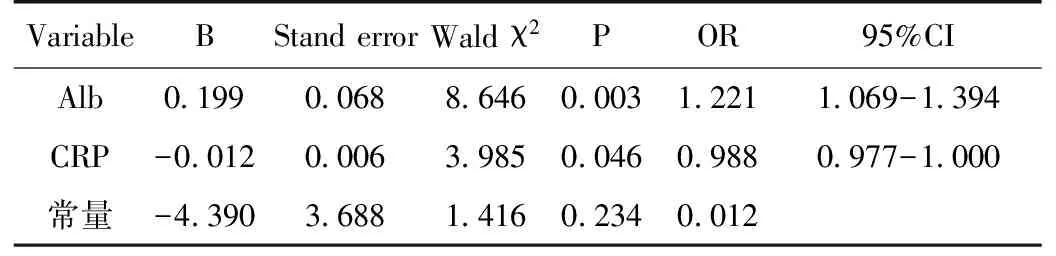
表4 腹膜透析患者一年内死亡危险因素的Logistic回归分析
讨 论
本中心PD患者一年内的死亡率为7.26%,低于Pulliam等[2]对北美的PD患者一年内死亡率10%,该研究显示,高龄、糖尿病史、慢性心力衰竭增加死亡率,而黑人,高白蛋白、Hb、Kt/V和低死亡率相关。本研究单因素分析显示,一年内死亡组患者年龄明显高于对照组,且开始透析时更多合并糖尿病、肺部感染及心血管疾病(冠心病、心力衰竭)及使用免疫抑制剂。高龄患者,本身脏器功能减退,免疫力下降,更容易并发感染、心脑血管疾病。而且高龄患者自理能力减弱,在饮食管理、PD操作方面均不及年轻患者,更易出现营养不良,PD相关性腹膜炎等并发症。PD对患者本身的要求较高,所以对于高龄患者,如没有外界的协助,尽量避免选择PD。糖尿病是心血管疾病的独立危险因素,同时合并糖尿病、心血管疾病,更容易出现心脑血管并发症。而糖尿病患者PD会给血糖控制带来困难,加重糖尿病并发症,并使感染难以控制,促进死亡。对于PD的糖尿病的患者,需要监测血糖,根据血糖调整用药。血糖控制欠佳的患者,除非不能耐受血液透析,不建议采用PD。与Pulliam等[2]的研究有所不同的是,本研究显示一年内死亡组免疫抑制剂使用率、肺部感染率高于对照组,免疫抑制剂可能是肺部感染的诱因,这提示在患有系统性疾病必须使用免疫抑制剂的PD患者,必须要防治感染。同时,与血液透析相比,PD时机体处于容量负荷状态,这种情况下,免疫抑制剂可能更加容易诱发肺部感染且难以控制,选择血液透析更合适。分析本研究中合并肺部感染的6例患者,均因为不能耐受血液透析或连续性肾脏替代治疗(CRRT),或因经济原因而选择PD。综上所述,对于高龄、未控制的高血糖、大量使用免疫抑制剂、肺部感染、严重心血管疾病患者不适合选择PD。尽管临床上严重心肺疾病患者不能耐受血液透析的情况下,只能选择PD姑息治疗。
本研究显示,一年内死亡组与对照组的尿量、HB、TC、HDL、LDL、TG、BUN、UA、钙、磷、iPTH、每周Kt/V、每周Ccr、心胸比、EF之间无统计学差异。一年内死亡组SCr低于对照组,eGFR高于对照组,可能与这组患者一般情况较差,且合并心肺功能不全,为了改善全身机体状况,进入透析的时机较早有关。这与Park等的报道类似[3]。虽然这组患者毒素不太高,残余肾功能较好,但由于其心肺功能差,合并症多,且肌肉质量低,其死亡率反而高于对照组。Vavruk等[4]研究显示,PD低钾血症的发生率达13.6%,Szeto等[5]在中国PD患者中的调查显示,低钾血症达22.2%,其与营养不良相关,是降低PD患者生存率的重要原因。本研究同样提示低血钾是促进死亡的因素,而PD液中不含钾,会进一步加重低钾血症,增加恶性心率失常的发生率,所以PD患者必须监测血钾,及时纠正低钾血症。
本研究中Logistic回归分析显示,低Alb和高CRP是PD患者一年内死亡的独立危险因素。低Alb是反映营养不良最可靠的指标,CRP是反映炎症的主要指标之一。而炎症与营养不良可互为因果。炎症细胞因子白细胞介素1(IL-1)、IL-6及肿瘤坏死因子α(TNF-α)通过影响患者胃肠功能、食欲、静息性能量消耗增加、蛋白水解增加、肌肉蛋白分解代谢引起营养不良。李卫魏等[6]的研究证实PD患者的微炎症状态与营养不良密切相关。而营养不良又可引起机体的防御功能下降从而增加了患者对感染的易感性,产生炎症。炎症、营养不良均是动脉硬化的危险因素。
Mehrotra等[7]研究显示,Alb是PD患者死亡的独立预测因子。PD患者Alb<30g/L,校正后的全因和心血管死亡危险增加3倍,感染相关死亡危险增加3.4倍。而Alb升高后,全因死亡则可显著降低。美国肾脏病数据系统(USRDS)数据表明,营养不良的ESRD患者心血管死亡危险比营养正常的患者高出27%,Alb每下降10g/L,心血管死亡危险增加39%[8]。本研究显示Alb每增加一个单位一年内死亡的风险减少22.1%。
PD患者要保证一定的蛋白质摄入及充足的能量摄入,维持正氮平衡,推荐CAPD患者蛋白质摄入量为1.0~1.2 g/(kg·d),其中60%的蛋白质为高生物价的蛋白,可以补充α酮酸制剂。同时要保证足够的热卡摄入,热卡摄入为35 Kal/(kg·d)(<60岁),30~35 Kal/(kg·d)(≥60岁)。而足够的营养摄入依赖于充分的透析,尿毒症的毒素会抑制食欲,引起厌食。保护残余肾功能,定期调整透析处方,保证透析充分性有利于防治营养不良。在临床上尽量减少高张葡萄糖透析液的使用,以免导致葡萄糖体内吸收增加,抑制食欲,造成营养缺乏。同时可采用含氨基酸的PD液,氨基酸从腹腔吸收能补充从透析液丢失的蛋白,增加蛋白合成代谢,从而增加血清白蛋白。微炎症状态是引起营养不良的重要原因,因此积极改善微炎症状态有利于患者营养不良的改善。代谢性酸中毒可显著增加体内蛋白降解,减少蛋白合成,从而加重营养不良。而且,代谢性酸中毒还可以加重患者的炎症状态。维持体内碳酸氢根浓度>22 mmol/L有利于控制患者的炎症状态,并减轻营养不良[9]。
除了感染时CRP会增高,早期研究发现,心血管疾病和ESRD患者体内存在急性时相反应,但并无明显感染征象,称为微炎症状态,可表现为炎症因子、CRP增高。患者体内内毒素、化学物质和免疫复合物等激活单核巨噬细胞系统,释放IL-6、TNF-α等促炎性细胞因子,而临床上无明显症状。导致PD患者微炎症状态的因素主要包括残余肾功能的丧失,传统葡萄糖透析液对腹膜的损伤,PD导管的生物不相容性,PD相关性腹膜炎,腹膜功能障碍和内毒素血症[10]。微炎症状态与ESRD患者多种并发症相关。Stencinkel等[11]研究表明,22%的ESRD患者同时存在营养不良、炎症及动脉硬化,且三者之间存在相互因果关系,故临床上提出营养不良-炎症-动脉粥样硬化(MIA)综合性,其中微炎症状态被认为是营养不良和动脉粥样硬化的中心环节。微炎症状态可以通过多种机制导致心血管事件发生率和死亡率增加,包括促进心肌肥厚;加剧心功能异常、心力衰竭;促进血管、心脏瓣膜钙化;加速动脉粥样硬化;诱发厌食症;增加蛋白质、能量消耗;诱导胰岛素抵抗等[12]。Wang等[13]研究表明,CRP升高,独立于其他心血管、透析、营养和生化参数等指标,预测死亡率及心血管疾病的发病率。对于蛋白质能量消耗合并微炎症状态及心血管疾病的患者,每年的死亡率则高达45%,其死亡风险是对照组的7.5倍[14]。本研究中CRP每增加一个单位一年内死亡的风险增加1.2%。
持续的微炎症状态可加重营养不良、动脉硬化等并发症,因此早期干预微炎症状态,对于降低PD患者并发症的发生率、死亡率非常重要。药物治疗主要包括阿司匹林、他汀类、血管紧张素转换酶抑制剂和血管紧张素Ⅱ受体拮抗剂、过氧化物酶体增殖物激活受体激动剂、左卡尼汀、乙酮可可碱等。抗细胞因子治疗方面,被推荐的有IL-1、IL-6受体拮抗剂、可溶性TNF受体、抗TNF抗体。非药物治疗包括避免肾毒性药物的使用、改进透析液的生物不相容性、使用不易形成生物膜的PD导管、控制容量负荷、防治急慢性感染等[10]。最近一项研究表明,牙周疾病是引起微炎症状态的重要因素之一,及时治疗牙周疾病有利于减轻PD患者微炎症状态,改善营养状况,增强促红细胞生成素的反应性[15]。
综上所述,高龄、糖尿病、肺部感染、心血管疾病、使用免疫抑制剂、低钾血症均是PD患者透析一年内死亡的危险因素,低Alb和高CRP是其独立危险因素。高龄、难以控制的高血糖、大量使用免疫抑制剂、严重肺部感染、心血管疾病和低钾血症患者不适合选择PD。积极控制感染、纠正低钾血症、改善营养及微炎症状态有利于改善PD患者生存。
1Jain AK,Sontrop JM,Perl J,et al.Timing of peritoneal dialysis initiation and mortality:analysis of the Canadian Organ Repalcement Registry.Am J Kidney Dis,2014,63(5):798-805.
2Pulliam J,Li NC,Maddux F,et al.First-year outcomes of incident peritoneal dialysis patients in the united states.Am J Kidney Dis,2014,64(5):761-769.
3Park J,Mehrotra R,Rhee CM,et al.Serum creatinine level,a surrogate of muscle mass,predicts mortality in peritoneal dialysis patients.Nephrol Dial Transplant,2013,28(8):2146-2155.
4Vavruk AM,Martins C,Nascimento MM,et al.Association between hypokalemia,malnutrition and mortality in peritoneal dialysis patients.J Bras Nefrol,2012,34(4):349-354.
5Szeto CC,Chow KM,Kwan BC,et al.Hypokalemia in Chinese peritoneal dialysis:prevalence and prognostic implication.Am J Kidney Dis,2005,46(1):128-135.
6李卫魏,石永兵,金东华,等.腹膜透析患者微炎症状态对营养状况的影响.苏州大学学报(医学版),2009,29(3):501-503.
7Mehrotra R,Duong U,Jiwakanon S,et al.Serum albumin as a pridictor of mortality in peritoneal dialysis:comparisons with hemodialysis.Am J Kidney Dis,2011,58(3):418-428.
8Fung F,Sherrard DJ,Gillen DL,et al.Increased risk for cardiovascular mortality among malnourished end-stage renal disease patients.Am J Kidney Dis,2002,40(2):307-314.
9陈香美.腹膜透析患者营养状况的评估及营养不良的治疗//陈香美.腹膜透析标准操作规程.北京:人民军医出版社,2011:119-122.
10 Cho Y,Hawley CM,Johnson DW.Clinical causes of inflammation in peritoneal dialysis patients.Int J Nephrol,2014,2014:909373.
11 Stenvinkel P,Heimburger O,Paultre F,et al.Strong association between malnutrition,inflammation,and atherosclerosis in chronic renal failure.Kidney Int,1999,55(5):1899-1911.
12 王涵,俞雨生.微炎症状态与腹膜透析.肾脏病与透析肾移植杂志,2012,21(2):183-189.
13 Wang AY,Lam CW,Chan IH,et al.Long-term mortality and cardiovascular risk stratification of peritoneal dialysis patients using a combination of inflammation and calcification markers.Nephrol Dial Transplant,2009,24(12):3826-3833.
14 de Mutsert R,Grootendorst DC,Axelsson J,et al.Excess mortality due to interaction between protein-energy wasting,inflammation and cardiovascular disease in chronic dialysis patients.Nephrol Dial Transplant,2008,23(9):2957-2964.
15 Siribamrungwong M,Yothasamutr K,Puangpanngam K.Periodontal treatment reduces chronic systemic inflammation in peritoneal dialysis patients.Ther Apher Dial,2014,18(3):305-308.

