尿液miR-30a-5p预测激素治疗局灶节段性肾小球硬化的疗效
张婉芬 陈慧梅 张昌明 施少林 刘志红
原发性局灶节段性肾小球硬化(FSGS)是临床常见的肾小球疾病病理类型。国内外的研究均显示FSGS是引起肾病综合征及导致终末期肾病(ESRD)的主要病因之一。糖皮质激素是目前治疗FSGS的首选药物,但成人FSGS患者激素治疗反应较差,完全缓解(CR)率<30%[1]。FSGS的肾小球局部病变性质不均一,对治疗的反应和预后也不相同[2]。目前临床主要通过治疗8周时尿蛋白水平判定疾病的缓解情况,标准单一。对于激素治疗反应差的患者,8周后激素无效更换治疗方案耽误了治疗的最佳时机。而尿蛋白水平受饮食、尿量、尿中细胞、保存方式等影响较大,且不是一个疾病特异性的标志物。因此,找寻预测FSGS患者激素治疗反应,或提前判断FSGS患者对激素治疗反应的标志物具有重要意义。
近来越来越多的研究发现,血液及尿液等多种体液中miRNAs的种类及变化与很多生理及病理过程有关,能作为判断疾病状态的生物标志物[3-5]。我们之前的研究证实尿液miR-196a、miR-30a-5p和miR-490的水平与FSGS疾病的活动性呈正相关,大量蛋白尿的FSGS患者尿中miRNAs水平显著高于缓解的患者[6]。本研究进一步通过回顾性研究和前瞻性研究相结合,分析尿液miR-196a、miR-30a-5p和miR-490水平与FSGS激素治疗反应的关系,并与传统的标志物尿蛋白进行比较,判断尿液miRNAs作为预测治疗反应的新型标志物的可能性,从而协助指导临床实践。
对象和方法
实验设计本研究采用回顾性队列研究和前瞻性队列研究两部分评估miR-30a-5p、miR-196a和miR-490对FSGS患者激素治疗反应的预测作用。所有患者来自于南京军区南京总医院肾脏科,入选标准包括:(1)经临床与肾活检确诊的原发性FSGS,排除因其他疾病造成的继发性FSGS;(2)所有患者为初治患者,尿蛋白定量>3.5 g/d ;(3)年龄在16~65岁之间;(4)血清肌酐<265.2 μmol/L;(4)无严重其他脏器或系统疾病。激素治疗效果评定标准:(1)CR组:尿蛋白定量<0.3 g/d,血清肌酐(SCr)水平正常,血清白蛋白水平(Alb)>35 g/L;(2)未完全缓解(non-CR)组包括部分缓解(PR)组和治疗无效(NR)组:PR指尿蛋白定量在0.3~3.5 g/d之间,且SCr水平稳定(SCr变化<25%);NR指在接受1 mg/(kg·d)的足量激素治疗(最大剂量60 mg/d)16周后患者尿蛋白定量仍>3.5 g/d。
回顾性研究共纳入139例FSGS患者,所有患者均接受1 mg/(kg·d)的足量激素治疗(最大剂量60 mg/d)8周,若治疗8周时患者达CR,则激素逐渐减量,若8周时未达到CR,则足量激素治疗延长至16周,此时再次评估患者的治疗效果。其中68例患者经治疗CR,27例PR,44例NR。因PR组例数较少,故在正式分析时将后两组合并为non-CR组(71例)。分析治疗前尿液miRNAs水平与激素疗效的关系。另外共完成了两项前瞻性队列研究:一项入选了55例初治的FSGS患者,接受60 mg/d的激素治疗8周,治疗结束时据患者蛋白尿的水平评估治疗效果,其中33例经治疗达CR,22例non-CR。比较尿液miRNAs水平在激素治疗前后的变化,并比较两组间变化的差别。另一项研究则入选了22例初治的FSGS患者,接受60 mg/d的激素治疗8周,每4周定期随访,8周后 11例达到了CR,11例non-CR。观察两组miRNAs水平随治疗的变化趋势及与尿蛋白消长的关系。
入选时详细记录所有患者性别、年龄、尿蛋白定量、SCr、总胆固醇(CH)、三酰甘油(TG)等临床资料。每个随防点及治疗结束时收集尿液,检测尿液中尿蛋白及miRNAs的水平。患者的所有标本留取都取得本人的同意,经伦理委员会批准。
尿液RNA提取方法患者留取随机尿液样本,样本留取后4h内进行处理,1 500 r/min离心10分钟,留取尿液上清-80℃保存。单个尿液样本miRNAs提取方法:取300 μl样品加入到100 μl DEPC水中,充分混匀后加入等体积的酸性酚(PH=4.7~5.5)和氯仿,酸性酚氯仿体积1∶ 1,进行抽提,后续抽提方法同血清中提取RNA方法一致[3,7],RNA用10 μl DEPC水溶解,-80 ℃保存。
miRNAs定量PCR检测(qRT-PCR)采用探针法检测尿中的miRNAs的含量,探针购于Applied Biosystems(Foster City,CA,USA)。逆转录酶及taq聚合酶购于takara。qRT-PCR采用ABI Prism 7900 定量PCR仪器进行检测。逆转录使用RNA 2 μl,所得到的cDNA于-20℃保存备用。qRT-PCR每反应体系使用不稀释的cDNA 1 μl。尿液miRNAs选用绝对定量的方法计数[8-10]。
统计学分析采用SPSS 18.0进行数据分析。临床指标用均数±标准差表示;临床指标两组比较采用t检验;miRNAs表达水平的两组比较采用nonparametric Mann-Whitney U-test检验。P<0.05为差异有统计学意义。采用受试者工作特征曲线(ROC曲线)评估miRNAs区分两治疗反应组的价值。
结 果
尿液miR-30a-5p水平对回顾性队列FSGS患者激素治疗的预测效应在本组研究中,两组患者治疗前性别、年龄,尿蛋白、SCr、CH水平无差异(表1)。qRT-PCR结果显示,治疗前尿液miR-30a-5p水平在未完全缓解组和完全缓解组存在显著性差异(P=0.03),而miR-196a和miR-490的水平在两组之间无显著性差异(图1A)。

表1 回顾性研究中FSGS患者临床指标基线水平
ROC曲线分析显示,治疗前尿液miR-30a-5p的水平能显著区分未完全缓解组和完全缓解组,曲线下面积(AUC)为0.628(95%CI 0.536~0.721,P=0.03;图1B)。而治疗前尿液miR-196a和miR-490的水平则不能区分CR组和non-CR组。这部分研究结果表明,治疗前尿液miR-30a-5p的水平在一定程度上具有对FSGS患者激素治疗反应的预测作用。
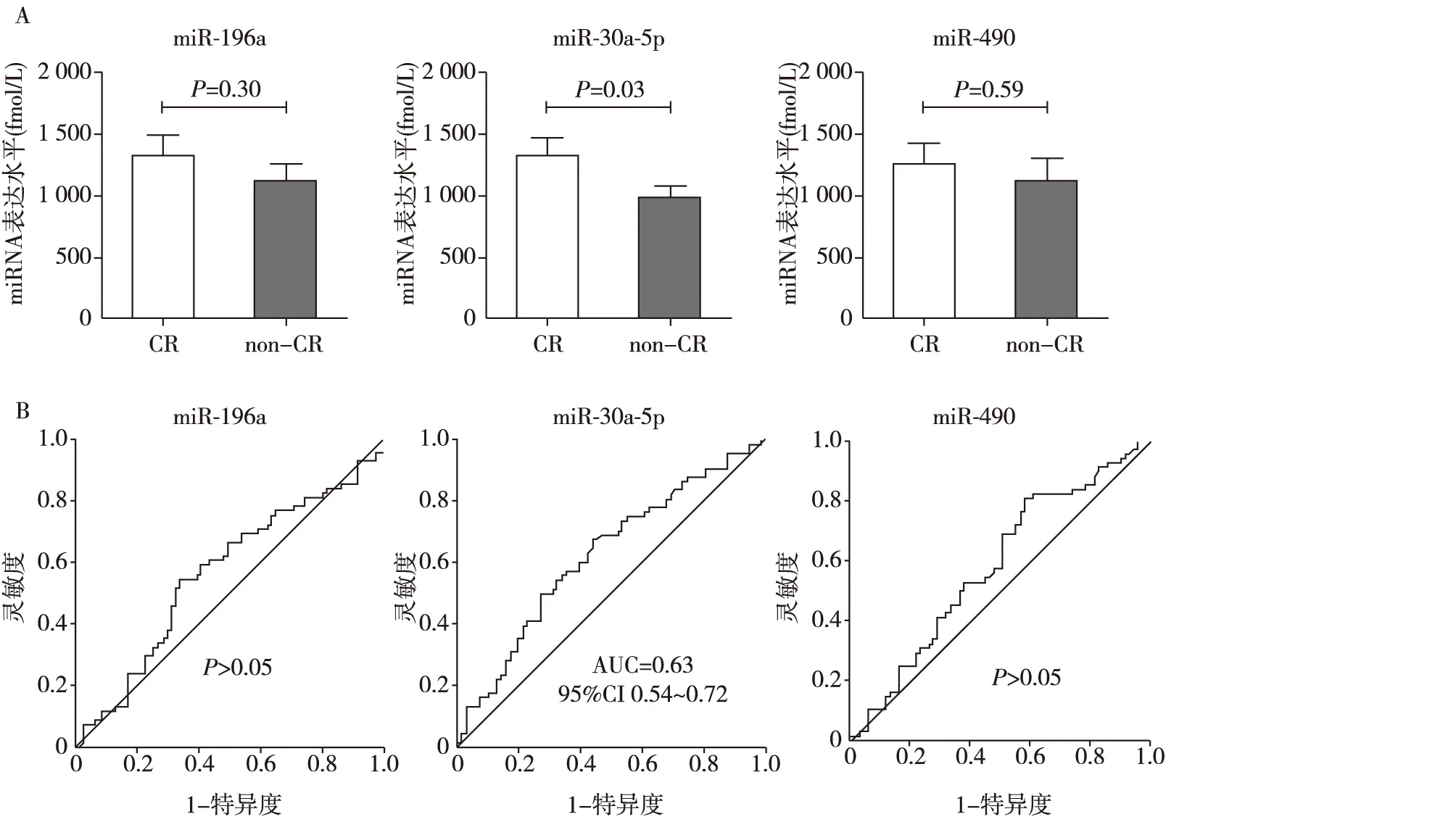
图1 回顾性研究中完全缓解组和未完全缓解组治疗前尿液miRNAs的水平
尿液miR-30a-5p水平预测前瞻性队列FSGS患者激素治疗的反应前瞻性55例初治FSGS患者队列研究,给予足量激素治疗8周,33例患者经治疗达CR,而22例患者未达到CR,治疗前两组间患者的年龄、性别、尿蛋白定量、SCr、CH的水平无显著差异(表2)。结果显示,激素治疗CR的33例FSGS患者,尿液miR-30a-5p的表达水平随着病情的缓解明显下降(P<0.001);而激素治疗未完全缓解的22例FSGS患者,尿液miR-30a-5p在治疗前后没有明显的变化(P>0.05)(图2)。
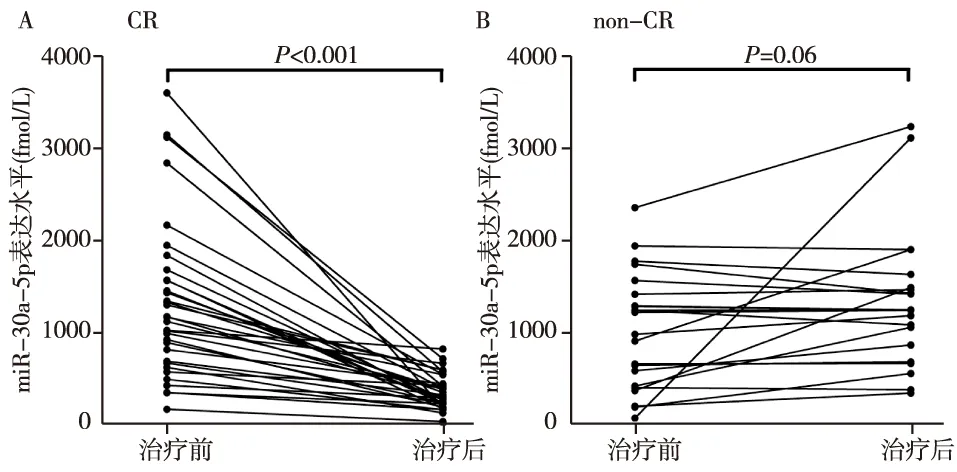
图2 FSGS患者治疗前后尿液miR-30a-5p的变化
尿液miR-30a-5p对激素治疗反应的指示作用先于蛋白尿水平的变化在另一组22例初治的FSGS患者,给予足量激素治疗8周后,11例完全缓解,11例未完全缓解,治疗前两组间患者的年龄、性别、尿蛋白的水平无显著差异(表2)。在治疗前(0周)完全缓解组和未完全缓解组的miR-30a-5p水平无明显差异(P=0.48),尿蛋白水平无明显差异(P=0.06)。治疗4周、8周时两组miR-30a-5p水平存在明显差异(P=0.008;P=0.03),尿蛋白水平存在明显差异(P=0.03;P<0.001),具体见表2。
此外,为避免有个别个体的蛋白尿绝对水平下降显著,而对整体的绝对蛋白尿水平造成分析上的偏差,选择用相对于初始的相对蛋白尿水平和相对miR-30-5p水平来分析变化趋势。以治疗前水平作标准化处理后分析,治疗4周时相对miR-30a-5p水平在完全缓解组显著低于未完全缓解组,存在明显差异(P=0.03),而此时尿蛋白水平在两组之间未见明显差异(P=0.29)。治疗在8周时,两组间的相对miR-30a-5p的水平和尿蛋白水平均存在明显差异(P=0.003,P<0.001)(图3)。这部分结果显示,在完全缓解的患者,miR-30a-5p下降的速度早于蛋白尿的变化,进一步证实了尿液miR-30a-5p水平对FSGS患者激素治疗的效果具有预测作用。

表2 前瞻性研究中FSGS患者基线及治疗中指标水平

图3 激素治疗过程中CR组和non-CR组尿蛋白和尿液miR-30a-5p水平变化的比较
讨 论
在之前的研究中我们发现尿液miR-196a、miR-30a-5p和miR-490的水平与FSGS患者疾病的活动性相关,临床FSGS疾病的活动性根据尿蛋白水平判断,因此,本文进一步的究分析尿液miRNAs水平与疾病预后及激素治疗效果之间的关系。首先通过回顾性研究发现,尿液miR-30a-5p治疗前的水平能够区分CR组和non-CR组,能预测激素治疗的反应,而尿液miR-196a和miR-490则不能。再进一步前瞻性的研究发现,激素治疗后FSGS CR组尿液miR-30a-5p的水平较治疗前显著下降,而non-CR组治疗前后无显著差异。最后发现在CR组,尿液miR-30a-5p的水平不仅随着激素治疗的过程逐渐下降,而且在4周时即可体现出与non-CR组的差别,而此时尿蛋白水平在两组间无显著差异。研究结果证实,尿液miR-30a-5p的水平不仅能在治疗前预示疾病的预后,而且能反映激素治疗的效果,能作为判断FSGS激素治疗和疾病预后的很好的标志物。
既往研究证实,蛋白尿、SCr、治疗无效及间质纤维化为成人原发性FSGS肾脏远期预后的危险因素[11]。因此在回顾性研究中,FSGS患者均为初治的患者,在完全缓解组和未完全缓解组两组间初治的蛋白尿水平、SCr水平无显著性差异,避免了蛋白尿水平、SCr水平差异造成的治疗反应的差别。在研究中发现,同样是大量蛋白尿的患者,CR组和non-CR组miR-30a-5p的水平在治疗前即存在明显差异,表明尿液miR-30a-5p对激素治疗效果具有一定的预测作用,可能是影响FSGS远期预后的重要因素。miR-30a-5p与miR-196a、miR-490相比,可能在疾病的发生、发展过程中起着更为关键的作用。
在前瞻性的研究中,尿液miR-30a-5p的水平随着疾病的缓解在激素治疗后比治疗前显著地降低了;而non-CR的患者,其水平在治疗前后无明显差异。这一结果表明,治疗8周时,尿液miR-30a-5p水平的变化与尿蛋白的变化一致,并没有体现出与尿蛋白的差别。但进一步研究发现,治疗4周相对治疗前水平,在CR组和non-CR组尿蛋白水平尚未出现明显差异时,而尿液miR-30a-5p下降的程度在两组间已经出现明显的差别,这种变化趋势与尿蛋白变化存在明显差别,提示尿液miR-30a-5p的变化快于尿蛋白的变化。临床通常在治疗8周时通过尿蛋白的水平判断患者激素治疗的效果,miR-30a-5p能提前判断FSGS患者对激素治疗的反应,为临床实践提供了一个新的方法。
尿液miRNAs和其他体液中的循环miRNAs一样,都是在疾病的发生和发展过程中由组织、细胞产生的[12,13]。通常细胞内的miRNAs从受损的细胞中被动的漏出或是细胞在受到外界刺激后主动释放进入循环中。释放出的miRNAs被包裹在微囊泡中[14,15]或与高密度脂蛋白结合从而保持在循环中的稳定性[16,17]。miR-196a、miR-30a-5p和miR-490在组织中的表达和作用也从另一方面支持了它们作为FSGS疾病标志物的潜能。miR-30家族在人体肾脏的含量明显高于心、肺、肝、脾、结肠[18]。之前的研究,包括我们自己的研究发现[19,20], miR-30 家族在FSGS患者肾小球的足细胞中显著表达,其功能的缺失或表达下降可导致足细胞的损伤和凋亡,进一步造成肾小球硬化和蛋白尿的产生;激素治疗能够减轻由转化生长因子β,脂多糖等刺激因素造成的足细胞中miR-30a家族的下降,激素对miR-30家族的调控作用可能与减少Notch1通路的激活及减轻足细胞损伤有关[19]。本研究发现治疗前尿液miR-30a-5p的水平CR组高于non-CR组,目前尚不能清楚地阐释其机制。可能的原因与两组患者本身对激素治疗反应不同的原理有关。对于该指标在治疗后迅速下降,我们推测,激素治疗后,治疗有效组足细胞中miR-30a-5p水平得到了维持,减少了足细胞对其主动或被动的释放,从而尿中miR-30a-5p的水平显著下降。而治疗无效组,由于足细胞损伤未得到很好的修复,足细胞释放miR-30a-5p的水平未明显减轻,从而治疗结束时下降的水平不如治疗有效组。这些研究证实了miR-30家族在FSGS的发病中起着关键的作用,也从侧面支持了miR-30a-5p能作为判断FSGS激素治疗效果的标志物。miR-196a在肾脏中表达丰富,但是其在肾脏中的功能还不清楚,研究认为其与病毒免疫、细胞的发育和分化有关[21,22]。目前还没有研究证实miR-490在肾脏中的表达与功能。因此尽管之前的研究发现尿液miR-196a和miR-490的水平随着疾病的缓解而下降[6],但是他们在FSGS疾病中的作用与miR-30a-5p可能存在差别。本研究结果提示了不同的miRNAs在FSGS疾病中所存在的差别,但是很难解释miRNAs在FSGS,特别是miR-30a-5p在疾病发生发展中所发挥的作用,因此,还需要更多体内和体外的研究来进一步帮助我们发现其中的内在的联系与差别。
本研究也存在一些不足之处。首先,我们研究的尿液miRNAs不全面,可能存在其他的miRNAs对疾病的预后有更好的预测作用。另外,如果多个miRNAs的组合,弥补了个体间的差异,比单个miRNAs作为疾病的标志物更有优越性[23]。其次,我们在前瞻性研究中选择的病例较少,因此,影响了对这几个miRNAs的变化与FSGS激素治疗之间的联系更深入的讨论。尽管研究发现miR-30a-5p对激素治疗反应的预测作用,但是没有提供一个具体的临界值为临床诊断服务。因此,进一步探寻FSGS患者miR-30a-5p在尿液中的变化及其调控机制,对于提高FSGS发病机制的认识和尿液miRNAs的临床应用具有重要的意义。
总之,尿液miR-30a-5p的水平不仅能在治疗前预示激素治疗的效果,而且在治疗中的变化提前于尿蛋白的变化,并在治疗后随着疾病的缓解而下降,是作为预测FSGS激素治疗反应和疾病预后的良好的标志物。
1张炯,刘志红,曾彩虹,等.泼尼松治疗成人局灶节段性肾小球硬化的临床疗效.肾脏病与透析肾移植杂志,2009,18(1):13-19.
2曾彩虹,刘志红,苏健,等.局灶节段性肾小球硬化肾组织形态学特点与临床表现的联系.肾脏病与透析肾移植杂志,2006,15(1):18-24,41.
3Chen X,Ba Y,Ma L,et al.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases.Cell Res,2008,18(10):997-1006.
4Zen K,Zhang CY.Circulating microRNAs:a novel class of biomarkers to diagnose and monitor human cancers.Med Res Rev,2012,32(2):326-348.
5Mitchell PS,Parkin RK,Kroh EM,et al.Circulating microRNAs as stable blood-based markers for cancer detection.Proc Natl Acad Sci U S A,2008,105(30):10513-10518.
6Zhang W,Zhang C,Chen H,et al.Evaluation of MicroRNAs miR-196a,miR-30a-5P,and miR-490 as Biomarkers of Disease Activity among Patients with FSGS.Clin J Am Soc Nephrol,2014,9(9):1545-1552.
7张婉芬,张昌明,刘春蓓,等.尿液microRNAs作为局灶节段性肾小球硬化疾病活动生物标志物的研究.肾脏病与透析肾移植杂志,2013,22(4):315-323.
8Liu R,Zhang C,Hu Z,et al.A five-microRNA signature identified from genome-wide serum microRNA expression profiling serves as a fingerprint for gastric cancer diagnosis.Eur J Cancer,2011,47(5):784-791.
9Chen X,Hu Z,Wang W,et al.Identification of ten serum microRNAs from a genome-wide serum microRNA expression profile as novel noninvasive biomarkers for nonsmall cell lung cancer diagnosis.Int J Cancer,2012,130(7):1620-1628.
10 Zhang C,Wang C,Chen X,et al.Expression profile of microRNAs in serum:a fingerprint for esophageal squamous cell carcinoma.Clin Chem,2010,56(12):1871-1879.
11 Tang X,Xu F,Chen DM,et al.The clinical course and long-term outcome of primary focal segmental glomerulosclerosis in Chinese adults.Clin Nephrol,2013,80(2):130-139.
12 Miranda KC,Bond DT,McKee M,et al.Nucleic acids within urinary exosomes/microvesicles are potential biomarkers for renal disease.Kidney Int,2010,78(2):191-199.
13 Alvarez ML,Khosroheidari M,Kanchi Ravi R,et al.Comparison of protein,microRNA,and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers.Kidney Int,2012,82(9):1024-1032.
14 Valadi H,Ekström K,Bossios A,et al.Exosome-mediated transfer of mRNAs and microRNAs is a novel mechanism of genetic exchange between cells.Nat Cell Biol,2007,9(6):654-659.
15 Michael A,Bajracharya SD,Yuen PS,et al.Exosomes from human saliva as a source of microRNA biomarkers.Oral Dis,2010,16(1):34-38.
16 Wagner J,Riwanto M,Besler C,et al.Characterization of levels and cellular transfer of circulating lipoprotein-bound microRNAs.Arterioscler Thromb Vasc Biol,2013,33(6):1392-1400.
17 Vickers KC,Palmisano BT,Shoucri BM,et al.MicroRNAs are transported in plasma and delivered to recipient cells by high-density lipoproteins.Nat Cell Biol,2011,13(4):423-433.
18 Wang N,Zhou Y,Jiang L,et al.Urinary microRNA-10a and microRNA-30d serve as novel,sensitive and specific biomarkers for kidney injury.PLoS One,2012,7(12):e51140.
19 Wu J,Zheng C,Fan Y,et al.Downregulation of microRNA-30 facilitates podocyte injury and is prevented by glucocorticoids.J Am Soc Nephrol,2014,25(1):92-104.
20 Shi S,Yu L,Chiu C,et al.Podocyte-selective deletion of dicer induces proteinuria and glomerulosclerosis.J Am Soc Nephrol,2008,19(11):2159-2169.
21 Tripurani SK,Lee KB,Wee G,et al.MicroRNA-196a regulates bovine newborn ovary homeobox gene(NOBOX) expression during early embryogenesis.BMC Dev Biol,2011,11:25.
22 Chen C,Zhang Y,Zhang L,et al.MicroRNA-196:critical roles and clinical applications in development and cancer.J Cell Mol Med,2011,15(1):14-23.
23 陈熹,张峻峰,曾科,等.血清microRNA——一种非侵入性的肿瘤标志物.生命科学,2010,7:649-654.

