基于CCD的阵列毛细管电泳芯片检测系统研究
杨晓博,闫卫平,杨 飞,窦伟峰
(1.许昌学院电气信息工程学院,河南许昌 461000;2.大连理工大学电子科学与技术学院,辽宁大连 116024)
0 引言
毛细管电泳(Capillary Electrophoresis,CE)芯片是微流控生物芯片的一种,广泛应用于蛋白质组分研究、药物筛选、基因诊断等生化分析领域[1]。阵列CE芯片由于能够同时对多种分析样品进行并行检测,效率更高、成本更低,已成为生化分析领域前沿的研究热点之一[2]。在利用CE芯片进行生化分析的过程中,被测样品的组分及含量等相关信息由检测系统来测定。由于CE芯片中毛细管的内径一般为10~100 μm,样品进样量极少,因而对检测系统的灵敏度、分辨率及响应速度都有较高的要求,检测系统的性能将直接决定CE芯片分析系统的整体性能[3]。
电荷耦合器件(Charge Coupled Device,CCD)是20世纪70年代发展起来的一种新型半导体集成光电器件。它具有噪声低、响应光谱宽、精度和灵敏度高、可靠性好等优点。近几十年来,CCD器件及其应用技术的研究取得了飞速发展,在图像传感和非接触测量领域的发展尤其迅速[4]。针对传统CE芯片荧光检测系统功耗高、体积庞大、噪声难于消除等问题,设计采用CCD作为光电转换器件,搭建出阵列CE芯片荧光检测系统,实现了对多个CE通道荧光信号的同时检测和显示。
1 检测系统组成及其工作原理
基于CCD的阵列CE芯片检测系统结构如图1所示,它主要由绿色LED光源、光路系统、光电转换器件CCD和信号处理系统组成。其工作原理为:绿色LED光源发出的绿光(峰值波长为532 nm)照射至阵列CE芯片分离通道内的荧光染料样品(Rhodamine B)时,样品会在激发光的照射下发出橘红色荧光信号(峰值波长为580 nm);由于CE芯片采用的是玻璃材料,不可避免的在其表面会产生光的反射和折射现象,发射光与折射光都属于与荧光信号无关的背景噪声,因此需要通过滤光片将其滤除掉;荧光信号经过黑色胶片上的针孔聚焦后传输至光电转换器件CCD,CCD将检测到的荧光信号转换为模拟信号,再通过数据采集卡上集成的高速A/D转换模块,最后经USB总线发送到上位机进行实时显示,根据荧光图谱的峰值即可判断样品的含量。

图1 基于CCD的阵列毛细管电泳芯片检测系统结构示意图
2 CCD芯片及其驱动电路设计
系统中使用的CCD芯片为TCD1304AP芯片。其内部结构如图2所示,主要包括光敏单元(由光电二极管和电荷转移电极组成,含复位脉冲)、移位寄存器(2个)、转移栅电极(2个)、内部驱动信号逻辑电路、输出信号缓冲电路[5]。其中,感光区位于CCD的中央,光敏阵列由光电二极管组成;感光单元中前面32个及后面的14个称为哑元,没有信号输出,用Dn表示;中间的3 648个像素单元是有效的感光单元,用Sn表示。每个光敏单元的大小为8 μm × 200 μm.内部CCD驱动电路由脉冲产生电路和CCD驱动器组成,驱动时钟频率为0.8~4 MHz,时序驱动要求开启电子快门功能的最短光积分时间为10 μs.
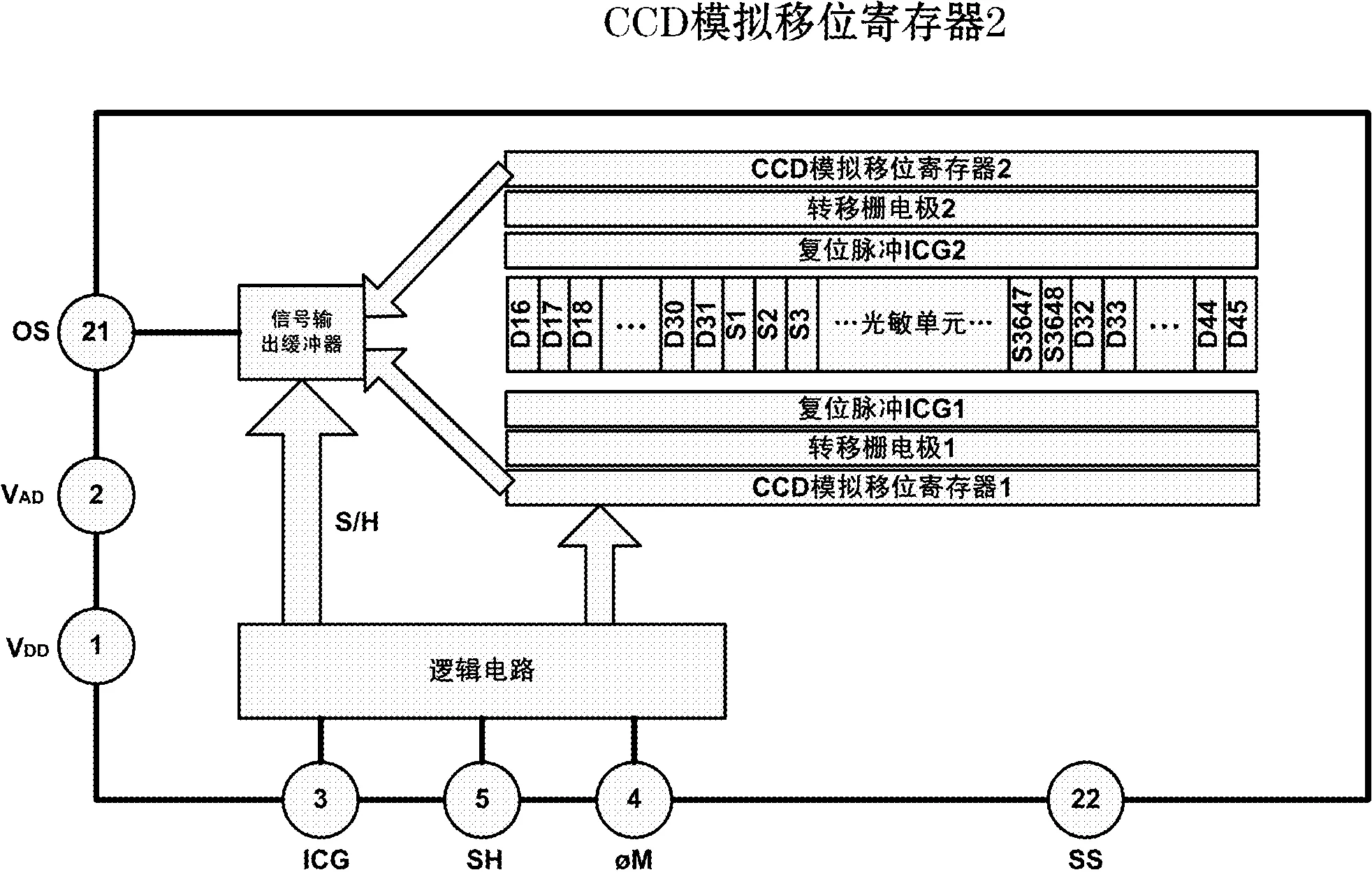
图2 TCD1304AP CCD芯片内部结构图
2.1CCD芯片驱动原理
CCD芯片内部感光区两侧分别是2个复位脉冲电极和转移栅电极;最外层是模拟位移寄存器,它由一系列的MOS电容器组成。模拟寄存器负责接收、存储和转移光电二极管产生的电荷包,其中电荷包的转移受控于转移栅电极的作用。
光敏单元在光照作用下获得光生载流子从而形成电荷包,电荷包在转移脉冲信号SH的作用下将会按奇偶序号分开并被转移至两侧的移位寄存器中。电荷包通过奇偶分离的方式后转移速度会得以提高,而当外部驱动电路对ΦM、ICG、SH信号提供合适的脉冲信号时,模拟移位寄存器中的电荷包将由右向左顺次进行转移,这就是外围驱动电路对CCD进行驱动的原理。
为保证检测系统的精确度、测量速度及抗干扰能力,需要解决2个主要问题:为CCD提供正常工作时所需要的时序驱动信号;对CCD输出信号的处理。因此,CCD驱动电路设计包括电源电路设计、时序驱动电路设计及输出信号调整电路设计。此外,还设计了4个光积分时间控制输入端口,用以对CCD芯片光积分时间进行控制。
2.2CCD驱动电源电路
5 V电源电路原理如图3所示,它的工作原理为:1个周期开始时,芯片OUTP引脚被置低,打开与其相连的P沟道场效应管Q2,电流从输入端流经检测电阻、MOS场效应管及电感线圈流到输出端,电流幅度将增大并且受控于电感线圈;落在检测电阻R1上的电压在芯片内部放大,经过内部补偿后稳定在1个区间内,补偿后的信号将与误差放大器的输出进行比较,当此信号与误差电压相等时,P沟道场效应管被截止;电感中的电流将通过二极管D在LC回路中振荡,与此同时,N沟道场效应管被打开,MOS场效应管的电压降小于二极管上的正向电压降,这使得转换器的效率得以提高;在1个周期的最后,N沟道场效应管在控制器的控制下关闭,新的周期循环开始,如此往复,使得电源电路输出持续稳定的电压。
2.3CCD时序驱动电路
CCD驱动模块的逻辑连接如图4所示。其中,CCD驱动模块的输入端有系统时钟输入clkin、复位信号reset、光积分时间调整输入端M1~M4;输出信号端有复位脉冲ICG、帧转移信号SH、CCD驱动时钟Mclk、像元同步信号SP及行同步信号FC.另外,FPGA芯片的所有输入、输出端口均通过TC74HC04芯片与外界相连。该芯片是一种高速的CMOS反相器,其转换速度可以与LSTTL电路相媲美,具有高噪声限和输出稳定的特性,所有的输入端都有电流保护装置。
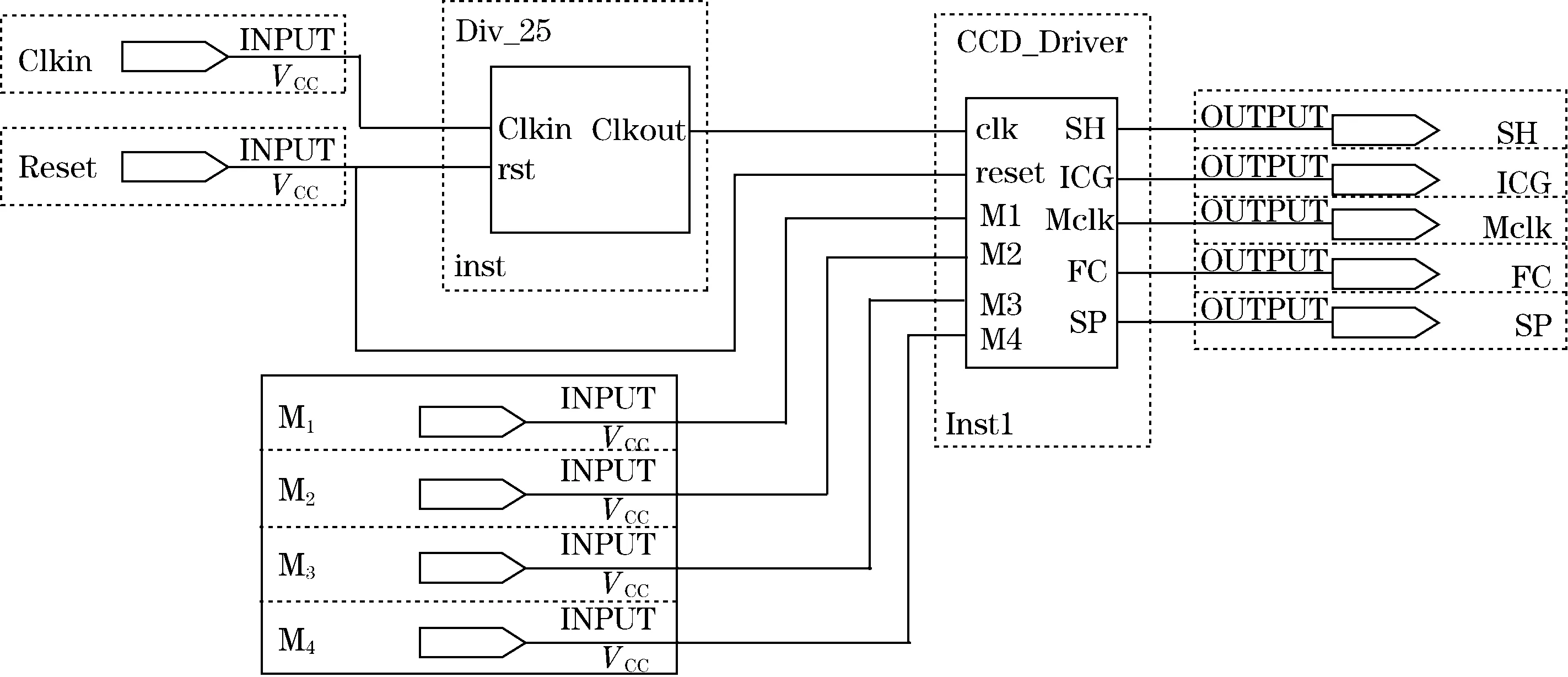
图4 CCD驱动模块逻辑连接图
2.4CCD输出电压调整电路
CCD输出电压调整电路如图5所示。其中,电容C7~C9为滤波电容,用以滤除电源或输出端的高频干扰;放大器采用AD8031电压反馈式轨对轨放大器,其正向输入端为电压补偿电路,VCC经过R9和R10分压后的电压V+补偿到放大器的正向输入端以提高输出端的电压;反向端构成1个电压负反馈电路,起到放大CCD的OS端输出电压VOS的作用;通过调整可变电阻器R10和R5的值可以使输出电压VO的值满足后续A/D转换芯片的满量程要求,进而提高CCD采集数据的精度和测量范围。
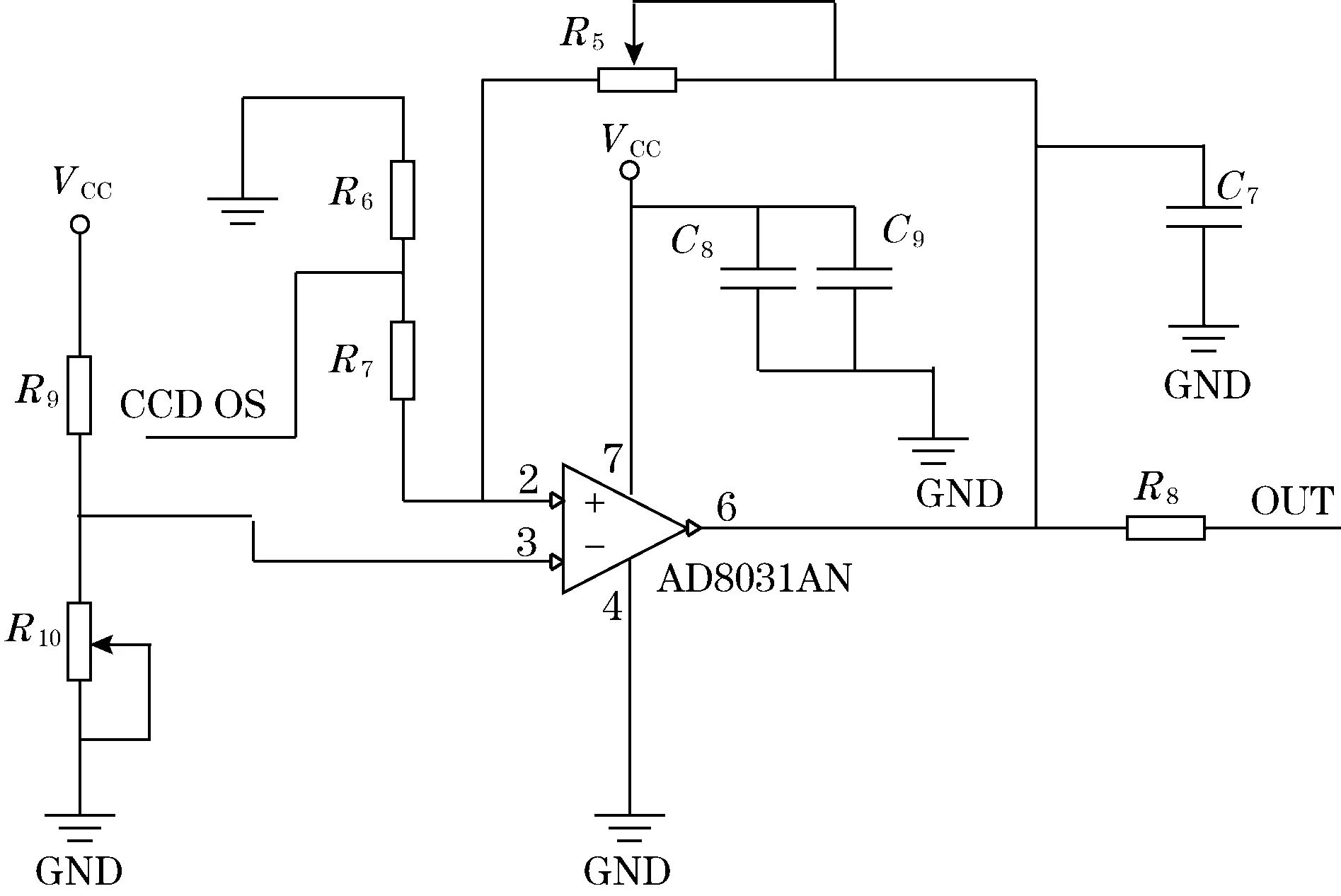
图5 CCD输出电压调整电路
2.5CCD积分时间控制电路
CCD驱动模块有4个输入端(M1~M4),用来控制CCD的积分时间,其控制信号来自CY7C68013的PC0~PC3端口。当MCU接收到上位机的设置积分时间指令后,先读出配置参数,然后对PC端口的低四位进行配置,经过如图6所示的电路后到达CCD驱动器的M1~M4端口,起到控制积分时间的作用[6]。由图中可以看出,当PCx口置高时,三极管被导通,Mx被置低;反之则被置高,即PCx端口和Mx端口逻辑反相。例如,若要分配积分时间最长,即{M1,M2,M3,M4}为{1,1,1,1},则将PC0~PC3口全部置零即可。

图6 CCD积分时间控制电路
3 系统软件设计
系统硬件环境的搭建是功能实现的基础,而系统软件的设计则是系统功能实现的具体过程。根据系统的具体功能,软件的设计主要包括两部分:上位机程序,包括PC机端USB设备的驱动及相应的检测控制程序;下位机程序,包括8051增强型单片机固件程序及保证芯片FX2模块工作在Slave FIFO模式下的FPGA实现。
USB驱动程序开发采用Windows Driver Module模式,即Windows驱动程序模式。它的实现过程是在Visual C++ 6.0的编程环境下,利用Driver Studio自带的Driver Wizard产生设备驱动程序框架,进而完成系统所需的USB驱动程序。固件编程即为USB外设所编写的单片机程序,主要完成以下工作:USB芯片内嵌的增强型8051单片机接收并识别出上位机发送的命令,比如开启CCD、设置CCD参数、数据采集等命令,然后执行相应的操作。程序采用C语言开发,使用Keil C进行编译和调试。下位机软件的流程图如图7所示。
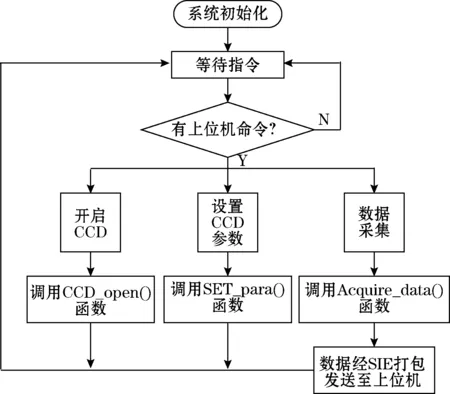
图7 下位机软件流程图
软件设计使用FPGA芯片将FX2模块配置为Slave FIFO模式进行数据采集,并通过USB接口传输至上位机。
FPGA程序设计使用Verilog HDL语言实现,在QUARTUS II 9.0平台上完成程序的综合、实现及下载,同时使用ModelSim软件进行仿真。通过对CCD驱动输入信号时序要求的分析可知,CCD的像元同步信号和行同步信号需作为输出信号,以便于对后续A/D转换进行同步。
4 测试结果及分析
4.1CE芯片结构
检测系统中使用的四通道阵列毛细管电泳芯片结构如图8所示。芯片通道单元结构为基本的十字构型,其中进样通道长10 mm,分离通道长40 mm,检测点与十字交叉点处的距离为30 mm,相邻两分离通道间距离为6 mm;通道深60 μm,宽100 μm(深40 μm处),储液池直径为2 mm,容积约为5 μL;整个芯片尺寸为40 mm × 80 mm.此外,设计的支撑网格起到更有效封接基片和盖片的作用。
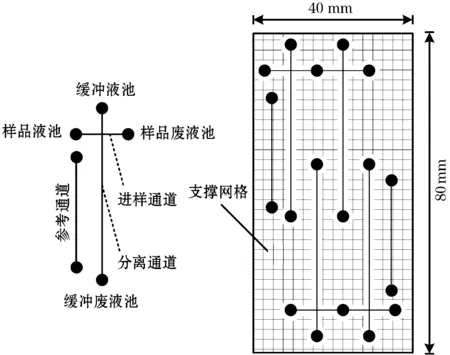
图8 四通道阵列毛细管电泳芯片结构示意图
4.2芯片电泳分离操作
每次电泳实验前,依次使用1 mol/L(M)的NaOH溶液、去离子水(18 MΩ)和tris-borate-EDTA (2 × TBE,pH 8.3)缓冲溶液清洗CE芯片微通道。实验过程中采用电动进样模式进行荧光染料Rhodamine B样品的进样。进行电泳操作前,首先取适量Rhodamine B储备液稀释在无水乙醇中配制成一定浓度的样品溶液,接着将缓冲液和样品加入各自的储液池中。进样阶段,样品从S(600 V)迁移至SW,B和BW电极电压分别为400 V和600 V,SW电极悬浮。进样20 s后,高压电源切换,样品带从B(800 V)迁移至BW进行分离并检测。此时,S和SW电极电压均为600 V,BW电极悬浮(S、SW、B、BW见图1)。每次电泳操作结束后,立即用去离子水清洗芯片微通道,以免缓冲溶液水分蒸发引起毛细管通道堵塞。
4.3样品电泳分离结果
为验证设计出的阵列CE芯片荧光检测系统的性能,将CE芯片的4个分离通道中依次注入4种不同浓度的Rhodamine B样品溶液进行电泳分离,其浓度依次为1.0×10-6M,1.0×10-5M,1.0×10-4M,1.0×10-3M.得到的电泳分离谱图如图9所示,由图可以看出,4个荧光信号的峰值由左至右依次增高,它与4个毛细管电泳通道中注入的样品溶液浓度依次增大相对应,浓度越大,峰值越高。
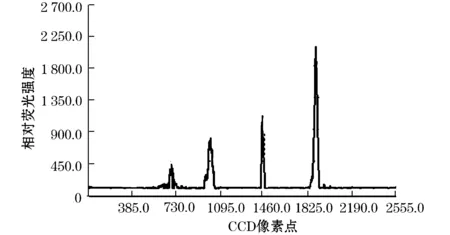
图9 四通道毛细管电泳芯片注入不同浓度样品时的电泳分离谱图
5 结束语
设计出的基于CCD的阵列CE芯片荧光检测系统使用绿色LED光源代替传统的半导体泵浦固体激光器;采用线阵高灵敏度的CCD作为荧光信号检测器件,实现了同一检测视野范围内多个通道的同时检测,系统结构简单、成本低、具有较高的信噪比和灵敏度。
参考文献:
[1]王立鼎,刘军山,于建群.集成毛细管电泳芯片研究进展.大连理工大学学报,2003(4):385-392.
[2]EMRICH C A,TIAN H,MEDINTZ I L,et al.Microfabricated 384-lane capillary array electrophoresis bioanalyzer for ultrahigh-throughput genetic analysis.Analytical Chemistry,2002,74(19):5076-5083.
[3]PAEGEL B M,EMRICH C A,WEDEMAYER G J,et al.High throughput DNA sequencing with a microfabricated 96-lane capillary array electrophoresis bioprocessor.PNAS,2002,99(2):574-579.
[4]胡渝,荣健.CCD的发展现状及展望.仪器仪表学报,2005,26(8):718-720.
[5]李明伟,黄鸽.一种高速线阵CCD图像数据采集系统.仪器仪表学报,2005,26(8):716-717.
[6]翟晶晶.基于电子快门自动增益的CCD驱动电路研究.现代电子技术,2010(19):188-190.

