一个水稻白化致死突变体abl25鉴定及其基因定位
朱环环, 刘艳霞, 潘倩文, 郑凯伦, 林冬枝,2, 董彦君,2
(1.上海师范大学 生命与环境科学学院, 上海200234; 2.上海师范大学 植物种质资源开发中心, 上海 200234)
0 引 言
叶绿体是个半自主细胞器,它不仅是光合作用的重要场所,而且还负责各种代谢物的生物合成和储存[1],一个具有光合活性的叶绿体的生成,需要光、质体和核基因组的控制,并伴随着类囊体膜的产生[2-3].越来越多的证据表明,叶绿体的生成是个高度被监管的过程,包括基因表达,蛋白生物合成以及选择性的蛋白质降解[4].所以,当叶绿体的发育受到阻碍的时候,会影响叶绿素合成,从而引起叶色异常[5-6],甚至导致植株死亡[7].很多与叶绿体相关水稻突变体已经被发现,并根据不同的表型被命名为virescent (v),stripe (st),albino,chlorina,zebra,and yellow-variegated[8].在这些突变体中,v突变体在叶片生长早期表现为叶绿体不足,在后期生长中会产生大部分的绿色叶片[9].St为条纹状叶片突变体;chl突变体会产生淡绿色苗,是由于叶绿素的合成出现了问题[10];至于zebra和 yellow variegated突变体,发生后大都不会导致它们的死亡.而水稻白化苗(albino),叶片一产生就发生白化,大多数在三叶期枯死.关于水稻白化突变体的研究目前也取得一些进展,日本的Iwata[12-13]等报道的11个水稻白化突变体al1-al11,其突变基因位于第1,4,5,6号等染色体.夏久成等将一个返绿的白化突变基因al12,定位在第8染色体上[11].另外,通过白化致死突变体abl4 对研究,发现编码的ABL4蛋白定位于类囊体膜,推测ABL4基因是叶绿体正常发育过程所必需的[14].余庆波等将水稻白化突变体alb21的突变基因定位在第3染色体,并发现其叶绿体中只有一些空泡状结构[15];白化突变体osalb23被定位在第2染色体上[16].巩孝帝[17]等水稻白化突变体asl1基因定在第1染色体,是编码核糖体白蛋白基因突变引起.本研究发现并鉴定了一个水稻白化苗突变体abl25,它的白化致死表型不受温度影响,对白化苗突变体的叶色表型、叶绿素水平,叶绿体超微显微镜进行观察和分析,并利用了SSR及InDel分子标记对该突变基因进行了定位,为该基因的分子克隆及其作用机理的研究奠定基础.
1 材料与方法
1.1 材 料
突变体abl25从粳稻“嘉花1号”干种子经60Coγ射线辐照后代获得.嘉花种子经过辐照之后发生突变(Aa),进行自交之后选取苗期分离出白化突变体的株系(上一代为杂合单株),随机选取4株生长正常的单株挂牌,收获挂牌的单株种子播种,根据后代分离情况确定上一代的基因型,弃纯合野生型单株,保留杂合单株.之后,突变体杂合子与籼稻广占63S杂交,得到F1代种子,自交后得到F2代分离群体,用于遗传分析与基因定位.
1.2 方 法
1.2.1 突变体的表型观察
为了进一步确定突变体abl25的表型,将突变体杂合子及其野生型嘉花1号的种子在32 ℃条件下催芽4 d后,播种在装有水稻土的塑料盆内,因为有好多温敏感的突变体被报道,为排除这种温度差异,将abl25突变体放置在20、24、28、32 ℃的光照培养箱(GXZ智能型,宁波,江南仪器厂)内,每天12 h光照(光照强度为180 μmol/m2·s)和自然条件(25 ℃)下,进行培养,观察突变体及其野生型叶色变化,并对其进行拍照.
1.2.2 叶片光合色素含量的测定
在上述32 ℃培养条件下,待突变体abl25与野生型嘉花1号长至3叶期时,参照沈伟其[18]描述的水稻叶片叶绿素浸提法.具体为取新鲜叶子1 g,加4倍的100%丙酮和少许石英砂进行在低温下研磨,收集匀浆液;倒入10 mL离心管中3000 r/15 min低温离心后取上清;若离心后沉淀物还呈现绿色则继续研磨离心,直至离心后下层无绿色为止.所有的上清用80%丙酮定容至50 mL,然后测吸光值.然后使用BECKMANCOULTER-DU720分光光度计分别测定470、645、663 nm 3个波长下的吸光值,分别计算叶绿素a、b和类胡萝卜素的含量,重复3次,取其均值.
1.2.3 叶绿体显微结构观察
取上述在32 ℃条件下生长3周的野生型与abl25突变体叶片,用2.5%戊二醛和l %四氧化锇磷酸缓冲液4°下固定5 h后,用50%,70%,80%,95%,100%的乙醇和丙酮梯度下进行脱水,逐级脱5 min,最后用环氧化树脂包埋样品,切片后,经醋酸铀-柠檬酸铅双染色后,Hitachi765型透射电镜进行观察和拍照.
1.2.4 构建定位群体
突变体杂合子(ABL25/abl25)与籼稻广占63S杂交获得F1种子,收获单株种子播种,根据后代分离情况确定上一代的基因型,只保留杂合基因型(ABL25/abl25)的杂交种,获得能用于遗传分析F2代群体,选取表现为白化突变的单株提取DNA.
1.2.5 水稻DNA的提取
采用TPS法[19]以及CTAB[20]法,提取亲本以及F2代遗传群体基因组DNA.
1.2.6 基因定位
本研究中,首先选取本实验室的保存SSR及InDel的分子标记检测突变体abl25和广占63S的多态性,然后选取均匀分布在水稻12条染色体上的有多态性的引物,然后,随机挑选F2中分离出22株白化苗作连锁分析,确定突变基因在那条染色体上,接着进一步扩大F2群体进行遗传定位.在目标区域内通过 NCB公布的粳稻日本晴和籼稻9311的全基因组序列的差异InDel 位点,利用Primer Premier 5.0软件设计引物[引物由上海生工生物工程技术服务公司合成](表 2),对突变基因进行进一步定位,应用MAPMAKER/EXP3.0[21]软件,构建目的基因区域的遗传图谱.PCR反应体系包括:100 mmol/L Tris-HCl(pH=9.0)、100 mmol/L KCl、20 mmol/L MgSO4、80 mmol/L (NH4)2SO4、2.5 mmol/L dNTP、10 μmol/L引物、5 U/mLTaq酶和20 ng模板DNA.在Eppendorf 和东胜PCR仪上进行扩增,PCR反应程序为:94 ℃预变性4 min,94 ℃变性30 s,55 ℃退火30 s(退火温度随不同引物变化),72 ℃延伸30 s,35个循环;72 ℃延伸10 min.反应产物用2.5%~3.5%的琼脂糖凝胶电泳检测,经溴化乙锭染色后在UVP凝胶成像仪上成像,而对于多态性不明显的引物的PCR产物,用8%的非变性聚丙烯酰胺凝胶电泳检测,银染之后用冷光源胶片观察灯观察,并拍照记录.
2 结果与分析
2.1 突变体的表型鉴定
在20,24,28,32 ℃人工气候箱条件下以及自然条件下生长的突变体苗期表型均一致,不论发芽后首先长出的叶鞘,还是不完全叶,以及第2、3叶完全为白色,3叶期后,突变体逐渐死亡(图1),表明突变体abl25叶色的变化不受温度及其他外部条件所改变,是水稻苗期白化致死突变体.
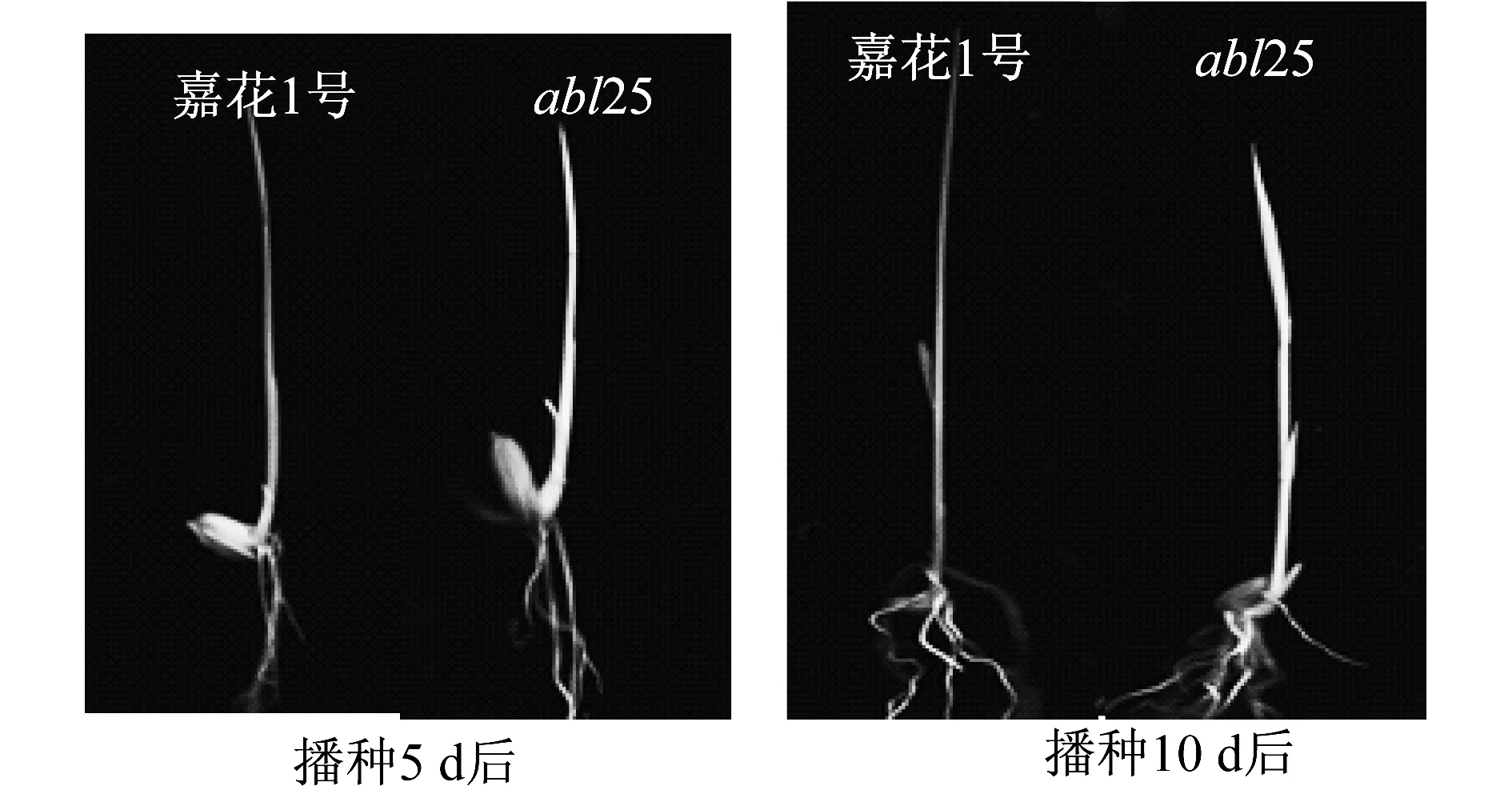
图1 abl25突变体的表型
2.2 突变体光合色素的含量变化
为了探究突变体中光合色素含量的变化,测定了野生型嘉花1号与突变型abl25的叶绿素,类胡萝卜素的含量,结果显示突变体abl25的叶绿素a、叶绿素b、类胡萝卜素的含量明显低于正常水平,与野生型形成鲜明比对(表1),说明突变体中叶绿素的含量明显降低,可能为叶绿素合成受到的影响而导致.

表1 abl25突变体的光合色素含量 (mg·g-1)
2.3 abl25叶绿体超细微结构的变化
通过透射电镜观察野生型嘉花1号与abl25突变体的叶绿体超微结构发现,野生型嘉花1号的叶绿体密度无明显缺陷,可以看到井然有序的类囊体堆叠,而abl25突变体中无明显的类囊体堆叠结构,只有些空泡结构(图2).这说明叶绿体的发育受到严重阻碍,导致abl25叶片内没有正常的叶绿体产生,叶绿素更是无法正常合成.
2.4 遗传分析及基因定位
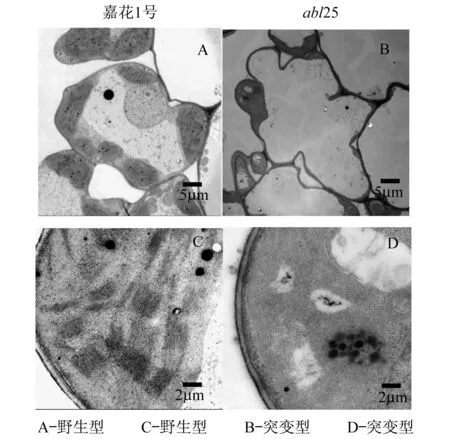
图2 野生型和abl25突变体叶绿体的超微结构
选取22株F2代白化苗进行粗定位分析,发现水稻第2染色体上的分子标记RM424,RM475(图3)有强烈的偏态扩增,因此,判断abl25位于第2染色体,然后扩大群体198株(图4A),将该基因定位在ID9047与 ID10317之间,其遗传距离分别为0.8 和8.4 cM.为了精细定位目标基因区域,定位群体扩大至4700株,将突变基因定位在ID9111到ID9261之间,物理距离约为150 kb(图4B),并发现ID9234与突变基因共分离.根据http://ricegaas.dna.affrc.go.jp/和 http://rice.plantbiology.msu.edu在该区间跨越了2个不重叠的BAC (AP005777.2和AP005631.3)克隆群,预测包含23个候选基因.

图3 分子标记RM424在亲本(P1,P2)及22株具有突变表型F2代单株的DNA分离带型

图4 突变体基因abl25在水稻第2染色体上的定位

表2 本研究中新发展的有多态的分子标记
3 讨 论
水稻不仅是重要的粮食作物,也是单子叶植物和禾本科的模式植物,水稻叶色突变体,越来越引起人们的研究兴趣,但是只有很少一部分白化突变体能够从分子水平作出阐释.比如,水稻白化突变体alb21无完整的叶绿体结构,只是些空泡结构,其定位在第3染色体上1520 kb的区域内[14].同样的,abl4白化致死突变体没有成熟的叶绿体结构,只有些类似前质体的结构,以及部分囊泡状结构,定位第4染色体210 kb内;目前较为详细的是对白化突变体asl1的研究,表明asl1白化突变体是由编码核糖体白蛋白基因突变引起[17].
到目前为止,与本研究abl25定位于同条染色体的已知突变基因有alb23[15],其叶绿体中无类囊体及其他颗粒,定位在280 kb的区间内;以及gra(t)[22],其在三叶期之前表现为白化苗,三叶期之后渐渐恢复绿色表型,定位于42.3 kb区间内.都与本文研究所确定在ID9111到ID9261之间150 kb内的位置完全不同,因此,abl25是一个新的白化突变基因.通过对ID9111到ID9261之间的生物信息学预测,发现其中共有23个候选基因,包括功能未知蛋白3个,其余20个编码蛋白的基因中,通过前导肽预测显示有1个叶绿体基因(LOC_Os02g16250)(http://ipsort.hgc.jp/),查阅水稻基因表达预测网站(http://ricexpro.dna.affrc.go.jp/category-select.php)发现在叶片中高表达的基因有LOC_Os02g15660,LOC_Os02g15880,LOC_Os02g15900 LOC_Os02g16060,LOC_Os02g16250,通过对上述相关基因测序对比,显示在野生型和abl25突变体中没有差异,这说明上述候选基因可能与abl25白化致死无关.由于叶绿体自身所含有的蛋白或者定位于叶绿体以外的蛋白都可能影响植物叶绿体的正常发育[5].因此导致abl25白化致死的真正原因更是难以断定,有可能不是叶绿体蛋白基因突变引起的.
本研究发现的abl25突变体,叶绿素和胡萝卜素的含量大大降低(图1),叶肉细胞超显微电镜观察发现突变体叶绿体中无任何堆叠的类囊体结构,叶绿体的形态不正常(图2),这都表明突变体的叶绿体形成在叶片发育过程中受到严重阻碍,导致叶绿素无法正常合成.更有趣的,定位过程发现在候选目标基因所在的9003~9234 kb区域之间,引物扩增的野生型DNA条带非常清晰,而abl25突变体中暗淡或不清楚,推测ABL25基因的突变可能会对基因组的复制产生消极影响,影响突变体某些基因DNA的合成,类似现象在水稻virescent(v3)突变体到得证明[8],但对于abl25来说还需要进一步验证.今后,将在此基础上扩大定位群体,发展更多新的分子标记,进一步对该基因进行克隆和功能分析,将有助于加深对水稻苗期白化致死作用机理的了解.
参考文献:
[1] MULLET J E.Dynamic regulation of chloroplast transcription[J].Plant Physiology,1993,103(2):309-313.
[3] SAKAMOTO W,MIYAGISHIMA S,JARVIS P.Chloroplast biogenesis:control of plastid development,protein import,division and inheritance[J].The Arabidopsis Book,2008,6:e0110.
[4] KATO Y,SAKAMOTO W.A new insights into the types and function of proteases in plastids[J].International Review of Cell and Molecular Biology,2010,280(4):185-218.
[5] MOORE M,GOFORTH R L,MORI H.Functional interaction of chloroplastSRP/FtsYwith theALB3 trans-locase in thylakoids:substrate not required[J].Journal of Cell Biology,2003,162(7):1246-1254.
[6] MOTOHASHI R,NAGATA N,ITO T,et al.An essential role of aTatChomologue of aDpH-dependentprotein transporter in thylakoid membrane formation during chloroplast development in Arabidopsis thaliana[J].Proceedings of the National Academy of Sciences (USA),2001,8:10499-10504
[7] 何冰,刘玲珑,张文伟,等.植物叶色突变体[J].植物生理学讯,2006,42(1):1-9.
[8] YOO S C,CHO S H,SUGIMOTO H,et al.RiceVirescent3andStripeencoding the large and small subunits of ribonucleotide reductase are required for chloroplast biogenesis during early leaf development.May[J].Plant Physiology,2009,150(1):388-401.
[9] ARCHER E K,BONNETT H T.Characterization of a virescent chloroplast mutant of tobacco[J].Plant Physiology,1987,83(11):920-925.
[10] 史典义,刘忠香,金危危.植物叶绿素合成、分解代谢及信号调控[J].Hereditas(Beijing),2009,31(7):698-704.
[11] 夏九成,王玉平,马炳田,等.水稻(OryzasativaL.) 苗期低温白化突变体al12的超微结构与基因定位[J].遗传学报,2006,33(12):1112-1119.
[12] IWATA N,OMURA T.Linkage studies in rice (OryzasativaL.) some albino genes and their linkage relation with marker genes[J].Science Reports of the Research Institutes Tohoku University Series A-physics Chemistry and Metallurgy,1978,33(1):18.
[13] IWATA N,SATOH H,OMURA T.Linkage analysis by use oftriso-micsin rice(Oryza sativa L):IV.Linkage groups locating on chromosomes 2 and 10[J].Japanese Journal of Breeding,1981,31(0):66-67.
[14] GERDES L,BALS T,KLOSTERMANN E,et al.A second thylakoid membrane localized Alb3/Oxa1/YidC homologue is involved in proper-chloroplast biogenesis in arabidopsis thaliana[J].Journal of Biological Chemistry,2006,281:0021-9258.
[15] 余庆波,江华,米华玲,等.水稻白化突变alb21生理特性和基因定位[J].上海师范大学学报:自然科学版,2005,34(1):70-75.
[16] 孙萌萌,余庆波,张慧琦,等.控制水稻叶绿体发育基因Os-ALB2 3的定位[J].植物生理与分子生物学报,2006,32 (4):433-437.
[17] GONG X D,JIANG Q,XU J L,et al.Disruption of the rice plastid ribosomal protein S20 leads to chloroplast developmental defects and seedling lethality[J].G3:Genes| Genomes| Genetics,2013,3(7):1769-1777.
[18] 沈伟其.测定水稻叶片叶绿素含量的混合液提取法[J].植物生理学通讯,1988(3):62-64.
[19] 张向前,邹金松,朱海涛,等.水稻早熟多子房突变体font5的遗传分析和基因定位[J].Hereditas(Beijing),2008,30(10):1349-1355.
[20] MURAY M G,THOMOSON W F.Rapid isolation of high molecular weigt plant DNA[J].Nucleic Acids Research,1980,8(19):4321-4325.
[21] LANDER E S,GREEN P,ABRAHAMSON J,et al.An interactive computer package forconstructing primary genetic linkage maps of experimental and natural populations[J].Genomics,1987,1(2):171-181.
[22] 陈涛,张亚东,赵凌,等.水稻白化转绿突变基因gra(t)的精细定位与候选基因分析[J].遗传学报,2009,36(2):117-123.

