去氢骆驼蓬碱通过下调COX⁃2表达抑制胃癌细胞迁移和侵袭
孙坤 李晓林 张皓 张凯 庞珊珊 孙为豪
去氢骆驼蓬碱通过下调COX⁃2表达抑制胃癌细胞迁移和侵袭
孙坤 李晓林 张皓 张凯 庞珊珊 孙为豪
目的探讨去氢骆驼蓬碱对人胃癌MKN⁃45细胞环氧化酶⁃2(cyclooxygenase⁃2,COX⁃2)表达、迁移和侵袭的影响。方法MKN⁃45细胞接种于含10%胎牛血清的RPMI⁃1640培养液中,常规培养24 h后加去氢骆驼蓬碱(2、4、8、16、32μg/ml),同时设置对照组不加药物,空白组只加培养液不含细胞,分别培养24 h、48 h、72 h,MTT法检测细胞增殖率;western blot法检测COX⁃2表达;划痕损伤愈合实验及Transwell小室基质侵袭实验检测胃癌细胞体外迁移和侵袭。结果去氢骆驼蓬碱剂量依赖性抑制MKN⁃45细胞COX⁃2表达(P<0.01);与对照组相比,去氢骆驼蓬碱组MKN⁃45细胞迁移和侵袭能力明显下降(P<0.01)。结论去氢骆驼蓬碱可能通过下调COX⁃2表达抑制胃癌细胞迁移和侵袭。
去氢骆驼蓬碱;胃癌;环氧化酶⁃2;迁移;侵袭
胃癌是常见的消化道恶性肿瘤之一,在世界范围内其发病率及死亡率一直居高不下。在我国,胃癌的发病率及死亡率居各类恶性肿瘤之首[1]。侵袭和转移是恶性肿瘤最显著的生物学特性之一,也是恶性肿瘤患者的主要死亡原因。近年来,中草药及其提取物的抗癌作用越来越受到国内外学者的重视。骆驼蓬碱是从蒺藜科多年生草本植物骆驼蓬的种子中提取的主要活性成分,具有抗肿瘤、抗氧化、抗炎等作用,已成为肿瘤防治研究的热点[2]。Hamsa等[3]研究发现,去氢骆驼蓬碱在体外能有效抑制黑色素瘤B16F⁃10细胞的侵袭和转移。然而,去氢骆驼蓬碱对胃癌细胞迁移和侵袭的影响尚不清楚。
环氧化酶(cyclooxygenase,COX)是前列腺素合成过程中一个重要的限速酶,已知COX至少有2种同工酶,即环氧化酶⁃1(COX⁃1)和环氧化酶⁃2(COX⁃2)。COX⁃2是诱导型酶,在正常生理状态下多数组织内几乎不表达或很少表达,但在胃癌等多种肿瘤细胞内表达明显增加。研究表明,过度表达的COX⁃2参与胃癌的发生、发展过程,并且与胃癌的侵袭转移以及预后密切相关[4⁃5]。本研究探讨去氢骆驼蓬碱对人胃癌MKN⁃45细胞COX⁃2表达、迁移和侵袭的影响,旨在明确去氢骆驼蓬碱的抗肿瘤作用及机制。
1 材料和方法
1.1 细胞株、药物及主要试剂 人胃腺癌低分化细胞株MKN⁃45购自中国科学院上海细胞生物研究所。去氢骆驼蓬碱、3⁃(4,5二甲基噻唑⁃2)2,5⁃二苯基四氮唑溴盐(MTT)、二甲基亚砜(DMSO)购自美国Sigma公司;RPMI⁃1640培养液和胎牛血清购自美国Gibcol BRL公司;兔抗人COX⁃2多克隆抗体、GAPDH多克隆抗体及辣根过氧化物酶标记的山羊抗兔IgG抗体均购自美国Cell Signaling Technology公司;PVDF膜和ECL发光试剂盒为英国Amersham公司产品;X线胶片为日本柯达公司产品。Matrigel胶购自美国Becton Dick⁃inson公司;Transwell小室购自美国Corning公司。
1.2 去氢骆驼蓬碱的配制 先以DMSO溶解,而后以RPMI⁃1640培养液稀释至所需浓度,DMSO在培养液中的浓度不超过0.1%,0.22μm的微孔滤膜过滤除菌后4℃保存备用。
1.3 细胞培养 MKN⁃45细胞常规传代培养于含10%胎牛血清、100 kU/L青霉素和100 mg/L链霉素的RPMI⁃1640培养液中,37℃、5%CO2饱和湿度的细胞培养箱中培养生长。隔天换液,3 d传代1次。
1.4 MTT法检测去氢骆驼蓬碱对胃癌细胞增殖的影响 将传代后处于对数生长期的细胞经0.25%胰蛋白酶消化,低速离心,制成5×107/L的MKN⁃45单细胞悬液后接种于96孔细胞培养板,每孔200μl,常规培养24 h至细胞贴壁,换无血清培养液再培养24 h,分组进行MTT比色实验。去氢骆驼蓬碱组药物终浓度为2、4、8、16μg/ml和32μg/ml;对照组:不加药物;空白组:只加培养液不含细胞。各组细胞分别培养24、48 h和72 h后每孔加入浓度为5mg/ml的MTT液20 μl,继续培养4 h,小心吸弃上清,加入DMSO 150μl终止反应。将96孔板移入平板震荡器,避光水平震荡10min,使MTT结晶充分溶解。将96孔板置于酶联免疫检测仪(美国Bio⁃Rad公司)中,以空白组调零,波长570 nm处测定各孔的吸光度(A)值(每组设4个平行孔,独立重复3次)。细胞增殖率(%)=实验组A值/对照组A值×100%。
1.5 细胞蛋白提取和western blot检测 取对数生长期MKN⁃45细胞接种于6 cm培养皿,不同浓度去氢骆驼蓬碱(0、4、8、16μg/ml)干预培养24 h,用预冷的PBS洗涤3次,以100μl细胞裂解液(PBS内含:1% Nonidet P⁃40,脱氧胆酸钠5 g/L,SDS 1 g/L,PMSF 0.1 g/L和抑肽酶10mg/L)4℃处理60 min。细胞裂解物经12 000×g 4℃离心20 min后取上清,BCA试剂盒测定其蛋白浓度。常规进行SDS⁃PAGE电泳后转印至PVDF膜,室温封闭2 h,分别加入一抗(COX⁃2抗体和GAPDH抗体),4℃孵育过夜,辣根过氧化物酶标记的山羊抗兔IgG抗体为第二抗体。ECL发光,X线胶片感光。为评价COX⁃2蛋白的表达水平,应用扫描仪(EPSON GT⁃8000,Seiko公司,日本)扫描western blot胶片,使用NIH Image图像分析软件对蛋白电泳带的密度进行半定量分析。
1.6 划痕损伤愈合实验 1×106个细胞接种于6孔培养板中,常规培养待细胞长满单层,弃去培养液,无血清RPMI⁃1640培养液漂洗1次,用灭菌的200μl移液器滴头沿培养板底部呈“一”字形划痕,培养液小心洗去悬浮细胞,并立即拍照,记为0 h。用无血清培养液漂洗2次,去氢骆驼蓬碱实验组药物浓度为8μg/m l(此药物浓度对增殖无明显影响),对照组只加入无血清培养液,不含药物。将6孔板置37℃、5%CO2饱和湿度的细胞培养箱中培养,分别在24 h和36 h后置于100倍的相差倒置显微镜下拍照。
1.7 Transwell小室基质侵袭实验 将Matrigel胶用无血清RPMI⁃1640培养液按1∶1.5稀释后取100μl,加入Transwell小室的上室中,室温下干燥1 h,并用无血清RPMI⁃1640培养液冲洗2次,将小室置入预先加入750μl含10%胎牛血清的RPMI⁃1640培养液的24孔板内;取不同浓度去氢骆驼蓬碱(0、4、8、16μg/m l)作用24 h的MKN⁃45细胞,以无血清的RPMI⁃1640培养液制成单细胞悬液,分别取200μl加入上室内,含细胞数为1×105个,置37℃、5%CO2的培养箱内培育24 h后取出,以棉签小心刮除滤膜上面的细胞,侵袭并黏附到滤膜下的细胞以甲醇固定,结晶紫染色计数,每张滤膜在光学显微镜(×200)下随机取9个视野计数侵袭的细胞数。实验重复3次,计算平均值。
2 结果
2.1 去氢骆驼蓬碱对MKN⁃45细胞增殖的影响MTT结果表明,随着去氢骆驼蓬碱浓度的增加及作用时间的延长,MKN⁃45细胞的增殖率逐渐降低。2、4、8 μg/ml去氢骆驼蓬碱作用24 h及2μg/ml去氢骆驼蓬碱作用48 h,对MKN⁃45细胞增殖抑制作用与对照组(0μg/ml)作用相同时间后比较,差异无统计学意义(P>0.05)。见表1。
2.2 去氢骆驼蓬碱对MKN⁃45细胞COX⁃2蛋白表达的影响 western blot结果显示,与对照组(0μg/m l)相比,不同浓度去氢骆驼蓬碱抑制MKN⁃45细胞COX⁃2蛋白的表达水平具有剂量依赖性。见表2。
表1 去氢骆驼蓬碱抑制MKN⁃45细胞增殖率(±s,%)
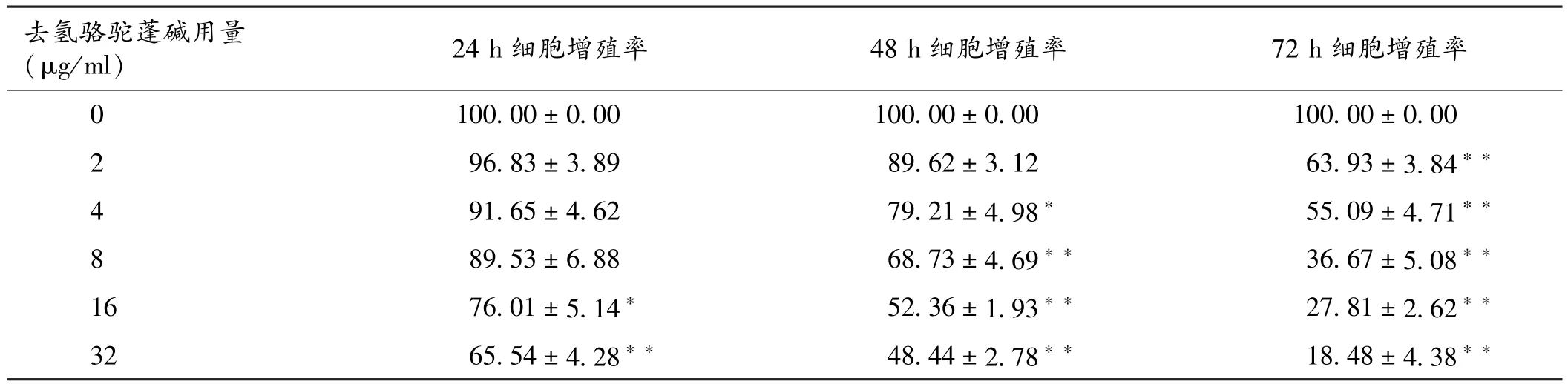
表1 去氢骆驼蓬碱抑制MKN⁃45细胞增殖率(±s,%)
注:与0μg/ml比较,∗P<0.05,∗∗P<0.01
去氢骆驼蓬碱用量(μg/m l)24 h细胞增殖率48 h细胞增殖率72 h细胞增殖率0 100.00±0.00 100.00±0.00 100.00±0.00 96.83±3.89 89.62±3.12 63.93±3.84∗∗4 91.65±4.62 79.21±4.98∗55.09±4.71∗∗8 89.53±6.88 68.73±4.69∗∗36.67±5.08∗∗16 76.01±5.14∗52.36±1.93∗∗27.81±2.62∗∗32 65.54±4.28∗∗48.44±2.78∗∗18.48±4.38∗∗2
表2 不同浓度去氢骆驼蓬碱抑制MKN⁃45细胞COX⁃2蛋白表达(±s)

表2 不同浓度去氢骆驼蓬碱抑制MKN⁃45细胞COX⁃2蛋白表达(±s)
注:与0μg/ml比较,∗∗P<0.01
指标去氢骆驼蓬碱0μg/ml去氢骆驼蓬碱4μg/m l去氢骆驼蓬碱8μg/ml去氢骆驼蓬碱16μg/m l COX⁃2(灰度值)999.77±211.46 662.57±110.41 424.00±42.42 271.83±41.38 GAPDH(灰度值)443.33±30.65 466.00±24.66 478.33±17.44 464.00±24.12 COX⁃2/GAPDH 2.23±0.35 1.43±0.27∗∗0.89±0.11∗∗0.59±0.12∗∗
2.3 去氢骆驼蓬碱对MKN⁃45细胞迁移的影响 在划痕损伤愈合实验中,经过划痕处理,随时间的延长,MKN⁃45细胞逐渐向痕迹内部生长、迁移,去氢骆驼蓬碱作用后迁移速率较对照组(0μg/ml)显著降低,而且随着药物作用时间的延长,抑制效果更加明显(图1)。

图1 去氢骆驼蓬碱对MKN⁃45细胞迁移能力的影响(划痕损伤愈合实验,×100)
2.4 去氢骆驼蓬碱对MKN⁃45细胞侵袭的影响 Tr⁃answell小室基质侵袭实验结果显示,与对照组(0μg/ml)相比,不同浓度去氢骆驼蓬碱组(4、8、16 μg/ml)均显著抑制胃癌细胞的侵袭能力,穿膜细胞数随着去氢骆驼蓬碱浓度的增加逐渐减少,差异均有统计学意义(P<0.01)(表3)。
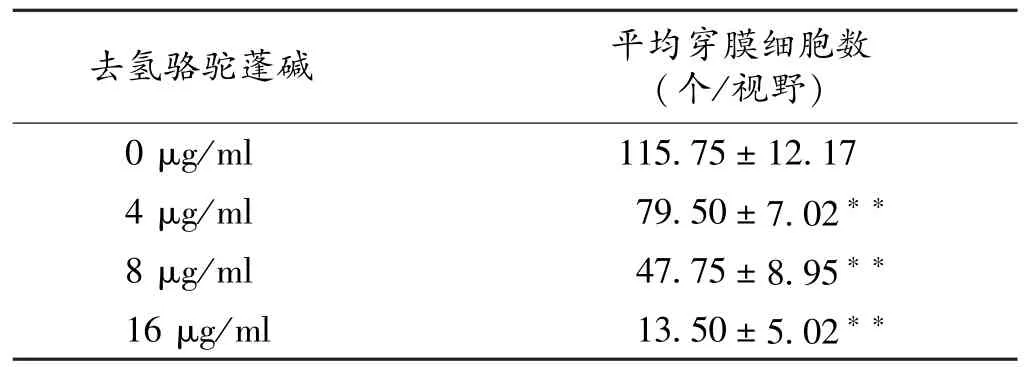
表3 去氢骆驼蓬碱对MKN⁃45细胞侵袭力的影响
3 讨论
3.1 侵袭和转移是影响胃癌预后的重要因素 胃癌是威胁人类生命健康最常见的恶性肿瘤之一,是癌症死亡的主要原因。侵袭和转移是恶性肿瘤的主要生物学行为,也是影响治疗效果和预后的重要因素。研究胃癌侵袭和转移的机制并采取有效的措施进行干预,对降低胃癌死亡率具有重要意义。侵袭与转移是一个复杂的多步骤连续过程,至少包含以下步骤:原发部位肿瘤细胞脱离原发瘤,侵袭穿越基底膜并向周围间质浸润性生长,穿越局部毛细血管或淋巴管壁进入管腔,随血液或淋巴液运输到达靶器官,并与该部位的血管或淋巴管内皮细胞发生粘附,穿越管壁和基底膜进入周围间质,不断增殖形成转移瘤。近年来中医药的抗肿瘤、抗侵袭与转移研究备受关注,已有大量研究表明某些中草药及其提取物具有抑制肿瘤侵袭与转移的作用[6⁃9]。本研究在体外观察了去氢骆驼蓬碱对胃癌细胞迁移和侵袭的影响,旨在探讨去氢骆驼蓬碱的抗侵袭与转移的作用及机制。
3.2 COX⁃2表达与胃癌侵袭、转移的相关性 COX⁃2在多种胃癌细胞株内高表达,且对胃癌细胞的存活和增殖是必要的[10]。过度表达的COX⁃2参与胃癌的发生、发展过程,尤其与胃癌侵袭性密切相关。目前认为,COX⁃2催化花生四烯酸合成的前列腺素可通过多种途径增强多种基质金属蛋白酶活性,增加CD44表达以及降低上皮钙黏素表达,从而增强肿瘤的侵袭力[11]。研究发现,胃癌组织中COX⁃2蛋白表达与患者年龄、性别、肿瘤大小、肿瘤部位及肿瘤的组织学类型无关,与病变的浸润深度、淋巴结转移及远处转移有关,可作为反映胃癌侵袭转移的生物学指标[12]。据报道,应用选择性COX⁃2抑制剂或基因干扰技术降低COX⁃2的表达,能显著抑制多种恶性肿瘤的侵袭和转移[13⁃14]。本研究证实,去氢骆驼蓬碱可有效抑制胃癌细胞COX⁃2的表达。
3.3 去氢骆驼蓬碱抑制胃癌细胞迁移和侵袭 为评价去氢骆驼蓬碱对胃癌MKN⁃45细胞侵袭与转移的影响,本研究采用划痕损伤愈合实验及Transwell小室基质侵袭实验来模拟体外胃癌细胞侵袭、转移的过程。研究发现,去氢骆驼蓬碱能有效抑制胃癌细胞的迁移和侵袭。因此,我们推测去氢骆驼蓬碱可能通过下调COX⁃2表达抑制胃癌侵袭、转移,为临床应用中药去氢骆驼蓬碱治疗胃癌提供理论和实验依据。
[1] 黄海,史冬梅,于晓峰,等.老年人胃癌癌前变化的随访研究[J].实用老年医学,2012,26(5):404⁃407.
[2] Cao MR,LiQ,Liu ZL,et al.Harmine induces apoptosis in HepG2 cells viamitochondrial signaling pathway[J].Hepa⁃tobiliary Pancreat Dis Int,2011,10(6):599⁃604.
[3] Hamsa T,Kuttan G.Studies on anti⁃metastatic and anti⁃inva⁃sive effects of harmine using highlymetastatic murine B16F⁃10 melanoma cells[J].J Environ Pathol Toxicol Oncol,2011,30(2):123⁃137.
[4] Wallace JL.COX⁃2:a pivotal enzyme in mucosal protection and resolution of inflammation[J].Scientific World Journal,2006,25(6):577⁃588.
[5] Sun WH,Sun YL,Fang RN,et al.Expression of cyclooxy⁃genase⁃2 and matrixmetalloproteinase⁃9 in gastric carcinoma and its correlation with angiogenesis[J].Jpn JClin Oncol,2005,35(12):707⁃713.
[6] 郑学芝,刘晓霓,孙卫,等.姜黄素抗人胃癌SGC⁃7901细胞侵袭和转移的作用[J].中国药师,2008,11(10):1183⁃1184.
[7] 于丽波,王晶,孙文洲,等.熊果酸对卵巢癌细胞黏附、运动和侵袭的影响[J].中国老年学杂志,2010,30(15):2169⁃2170.
[8] 刘威,沈克平,胡兵,等.夏龙方对人胃癌SGC⁃7901细胞黏附和侵袭的影响[J].中国实验方剂学杂志,2011,17(2):192⁃195.
[9] 黄炜,黄继群,张东方,等.五环三萜类化合物抗人肺癌细胞侵袭和诱导细胞凋亡的研究[J].中国肺癌杂志,2003,6(4):254⁃257.
[10]Ma D,Liu M,Wang AP,etal.Cycloxygenase⁃2 is essential for the survival and proliferation of gastric cancer cells[J]. Cell Biochem Biophys,2011,61(3):637⁃641.
[11]罗毅,叶远良,陈勇.COX⁃2在肿瘤的侵袭及转移作用研究进展[J].齐齐哈尔医学院学报,2011,32(16):2632⁃2633.
[12]马丹,刘敏,梁平,等.COX⁃2在人胃癌中的表达及与胃癌临床病理特征的关系[J].重庆医学,2009,38(3):290⁃292.
[13]方征东,李建生,徐修才.选择性环氧化酶⁃2抑制剂对肝癌细胞侵袭力的影响[J].世界华人消化杂志,2006,14(3):293⁃298.
[14]王轩,韩磊,杨旸,等.靶向AKT1和COX⁃2的RNAi抑制U251胶质瘤细胞侵袭的体外实验[J].中国神经精神疾病杂志,2010,36(4):241⁃245.
Harm ine inhibitsm igration and invasion of human gastric cancer cells through down⁃regulating COX⁃2 expression
SUN Kun,LIXiao⁃lin,ZHANG Hao,ZHANGKai,PANG Shan⁃shan,SUNWei⁃hao.Department ofGeriatric Gastroen⁃terology,the First Affiliated Hospital of Nanjing Medical University,Nanjing 210029,China
ObjectiveTo investigate the effects of harmine on the expression of cyclooxygenase⁃2(COX⁃2),and themigration and invasion of a human gastric cancer cell line,MKN⁃45.M ethodsMKN⁃45 cellswere seeded in RPMI⁃1640 medium supplemented with 10%heat⁃inactivated fetal calf serum and routinely incubated for 24 h.After treatment with harmine at a final concentration of 2,4,8,16 and 32μg/ml for 24,48 and 72 h,the cell proliferation was deter⁃mined using MTT colorimetric assay.The expression of COX⁃2 was detected by western blot analysis.In vitro wound⁃healing and transwell invasion assayswere used to assess the effects of harmine on themigration and invasion of MKN⁃45 cells.ResultsHarmine significantly suppressed the expression of COX⁃2 in a dose⁃dependentmanner(P<0.01).Compared with control group,harmine significantly inhibited migration and invasion of MKN⁃45 cells(P<0.01).ConclusionsThis study demonstrates that harmine inhibitsmigration and invasion of human gastric cancer cells through down⁃regulating COX⁃2 expression.
harmine;gastric cancer;cyclooxygenase⁃2;migration;invasion?
R 735.2
A
10.3969/j.issn.1003⁃9198.2014.02.008
2013⁃05⁃30)
210029江苏省南京市,南京医科大学第一附属医院老年消化科
孙为豪,Email:weihaosun@hotmail.com

