毕赤酵母表面展示棘孢曲霉β-葡萄糖苷酶催化合成APG的工艺条件优化
胡霞艳 刘端玉 郑穗平
(华南理工大学生物科学与工程学院,广州 510006)
毕赤酵母表面展示棘孢曲霉β-葡萄糖苷酶催化合成APG的工艺条件优化
胡霞艳 刘端玉 郑穗平
(华南理工大学生物科学与工程学院,广州 510006)
使用毕赤酵母细胞表面展示棘孢曲霉的β-葡萄糖苷酶作为全细胞催化剂,以葡萄糖为底物,在水-醇双相体系中逆水解合成C6-C10烷基糖苷。讨论了含水量、葡萄糖添加量、全细胞催化剂添加量、乙酸-乙酸钠缓冲液pH值和温度等主要因素对反应的影响,并与商品酶苦杏仁β-葡萄糖苷酶、Novozym188进行比较。结果表明,Novozym188不适合逆水解合成APG,苦杏仁β-葡萄糖苷酶反应所需时间短,但最终转化率不如全细胞催化剂。在 5 mL反应体系中,合成HG的最优条件:葡萄糖0.1 g,全细胞催化剂0.05 g,10% pH 3.0 buffer;合成OG的最优条件:葡萄糖0.2 g,全细胞催化剂0.05 g,15% pH3.0 buffer;合成DG的最优条件:葡萄糖0.2 g,全细胞催化剂0.2 g,20% pH 3.0 buffer;放置55℃ 200 r/min 恒温振荡器中,反应时间为72 h,HG和DG的最大产率分别为11.69%和3.58%,而OG的产率则在96 h到达最大值6.34%。
细胞表面展示 β-葡萄糖苷酶 全细胞催化剂 烷基糖苷
烷基糖苷(Alkyl polyglycoside,APG)是生物降解迅速且彻底,无毒低刺激的“绿色”表面活性剂。它不仅具有表面张力低,泡沫丰富而稳定,去污性优良,而且配伍性能极佳,可广泛于洗涤剂、化妆品、农药、纺织等行业,是下一代新型表面活性剂最有希望的品种之一[1]。化学合成法是合成APG的传统方法,但是由于化学法需要选择性保护基团,激活和耦合等步骤,不仅耗时长,还不可避免地存在副反应。过去的十多年中利用酶法合成糖苷和低聚糖成为研究热点,因为酶法合成APG具有很多化
学法不可比拟的优点,例如,不需要保护-去保护过程,具有较好的区域选择性和立体专一性,可以避免异头物的产,反应条件温和产物杂质少且易于纯化。在水-醇双相体系中,酶促逆水解反应合成糖苷只需一步,因此可以大大节省后续的产物提取成本,因而受到人们的广泛关注[2,3]。
棘孢曲霉生产的β-葡萄糖苷酶,既可以水解可溶性纤维寡糖,也可以水解不溶性纤维寡糖[4]。一直以来相关研究报道都是围绕纤维素水解,用于合成APG的研究仍处于探索阶段。近些年,酵母表面展示技术得到了迅速的发展[5],其中巴斯德毕赤酵母(P.pastoris)作为一种新型的真核表达系统,具有表达量高分泌能力强,生长快和操作简便等特点,还具有真核细胞翻译后的加工和修饰功能,适合表达需翻译后修饰的外源蛋白。它能将外源A-BGL以融合蛋白的形式展示在细胞的表面,保持A-BGL原有的生物活性和相对独立的空间构象,因此展示有A-BGL的酵母细胞可以作为全细胞催化剂表现出耐温、耐有机溶剂和热稳定性好等优良特性。韦斌如等[6]在毕赤酵母细胞表面成功展示了A-BGL,并初步用于催化合成APG。
本研究利用棘孢曲霉β-葡萄糖苷酶重组毕赤酵母菌株GS115/pKFS-ABGL作为全细胞催化剂,在水-醇双相体系中逆水解合成APG,并探讨含水量、葡萄糖添加量、全细胞催化剂添加量、乙酸-乙酸钠缓冲液pH值和温度等主要因素对反应的影响,并根据对影响大小确定主次影响因素,为后续工艺优化试验奠定基础。
1 材料与方法
1.1 材料
棘孢曲霉β-葡萄糖苷酶重组毕赤酵母菌株GS115/pKFS-ABGL由本实验室构建和保存,Novozym 188购于诺维信,游离苦杏仁β-glucosidase购自Sigma。对硝基苯基β-D-葡萄糖苷(pNPG)、己基β-D-葡萄糖苷(HG)、辛基β-D-葡萄糖苷(OG)、癸基β-D-葡萄糖苷(DG)、购自Sigma公司;其它试剂均为市售试剂。
1.2 方法
1.2.1 毕赤酵母表面展示棘孢曲霉β-葡萄糖苷酶催化剂的制备 棘孢曲霉β-葡萄糖苷酶重组毕赤酵母菌株GS115/pKFS-ABGL培养于 YPD 琼脂固体平板上,培养24 h后接种至YPD液体培养基中,30℃,250 r/min 培养 24 h,以1%的接种量转接到新鲜BMGY 培养基中,30℃,250 r/min 24 h,然后在4℃、8 000 r/min 离心10 min 得到菌体,转入 BMMY培养基中,30℃,250 r/min 培养 5 d,每隔 24 h 加入0.5%(V/V)甲醇诱导。然后收集发酵菌体,离心,用双蒸水洗两次,最后用少量双蒸水重悬,通过真空冷冻干燥得到全细胞催化剂干粉。培养基均按 Invitrogen 公司毕赤酵母表达操作手册配方配制。
我们首先从GPS数据中去除事件前的偏移。然后我们假设加速度仪每个分量的基线误差是时间的函数,并一般可用线性函数结合正弦函数表示:
1.2.2 GS115/pKFS-ABGL冻干酶粉逆水解合成APG在水-有机构成的5 mL体系中以葡萄糖为底物逆水解合成APG,分别探讨了含水量、葡萄糖添加量、全细胞催化剂添加量、乙酸-乙酸钠缓冲液pH值和温度等主要因素对反应的影响,并优化反应条件。最后在相同的反应条件下,比较实验室自制的全细胞催化剂GS115/pKFS-ABGL冻干酶粉和商品酶苦杏仁β-葡萄糖苷酶、Novozym188合成HG、OG和DG的催化效率。
1.2.3 GS115/pKFS-ABGL冻干酶粉合成APG的操作稳定性 全细胞催化剂的预处理:取全细胞催化剂于丙酮中,置于恒温摇床中55℃,200 r/min,放置24 h。离心除去有机溶剂丙酮,收集酶粉,于30℃恒温箱中放置24 h。然后取全细胞催化剂用于催化合成HG、OG和DG。反应72 h后的反应液,离心去掉上清,酶粉用丙酮洗两次,收集得到全细胞催化剂,置于30℃恒温箱中放置24 h,重复用于催化合成HG、OG和DG,如此重复使用5次。
1.2.4 HPLC-ELSD定量分析 APG APG的检测采用Waters 2695型高效液相色谱仪。色谱条件:色谱柱Zorbax SB-C18(5 μm,250 mm×4.6 mm i.d),流速1 mL/min,柱温30℃,2424 型ELSD 检测器,进样量10 μL,漂移管温度55℃,氮气流速30 psi。以APG的标准品,制作校正曲线,并根据保留时间定性。HG和OG检测均用流动相甲醇∶水=80∶20,葡萄糖、HG和OG的保留时间分别为3.46 min,4.80 min,6.08 min。DG检测用流动相甲醇∶乙酸乙酯∶水=48∶39∶13,葡萄糖和DG的保留时间分别为3.04 min 和3.98 min。
APG的产率=Mg/Me ×100%
式中,Me:反应体系中APG的质量,Mg:反应体系中葡萄糖的质量。
2 结果
2.1 含水量对全细胞催化剂合成APG的影响
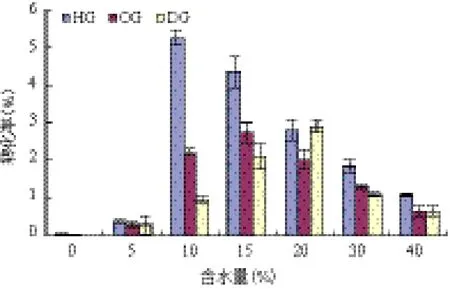
图1 含水量对全细胞催化剂合成APG的影响
2.2 葡萄糖和全细胞催化剂添加量对全细胞催化剂合成APG的影响
如图2所示,APG的转化率随葡萄糖添加量的变化有相同的趋势,先升后降。HG最佳的添加葡萄糖量为0.1 g,继续增加葡萄糖量,转化率略会降低。中长链的OG和DG的合成需要更多的底物作为驱动力,最佳葡萄糖添加量比HG的高,添加0.2-0.3g葡萄糖,转化率相似,为了节约成本,均可取最优葡萄糖添加量为0.2 g。总体来说,因为APG含量并没有随着葡萄糖添加量增加而发生变化,所以产率会下降。
优化酶量对于减少反应时间以及过程中的成本是非常重要的。从图3中可以看出,随着酶浓度的增加,APG的产率提高。当全细胞催化剂用量大于0.05 g,再增加全细胞催化剂用量HG和OG产率变化较小。而当全细胞催化剂用量超过0.1 g 时,HG却有一定量的下降。原因可能是过多的酶粉会使传质阻力增大[17]。而对于合成DG而言,在全细胞催化剂添加量低于0.075 g 时,几乎不能检测到DG。而在全细胞催化剂添加量由0.075 g 增加到0.2 g 时,产率增加显著。此后体系中全细胞催化剂添加量继续增加,催化剂很难维持均匀悬浮状态,存在传质阻力,而且酶浓度过高也会导致产物的水解加剧。所以在该反应中0.2 g 是比较合适的全细胞催化剂添加量。
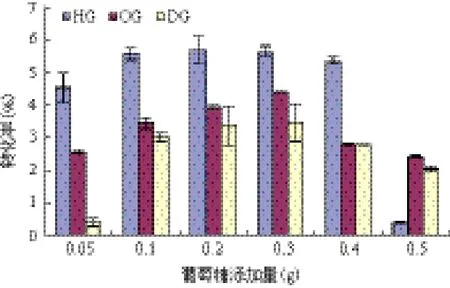
图2 葡萄糖添加量对全细胞催化剂合成APG的影响
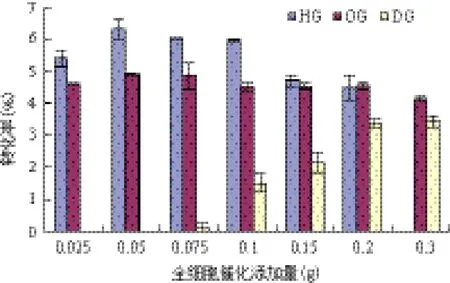
图3 全细胞催化剂添加量对APG合成的影响
2.3 乙酸-乙酸钠缓冲液pH值对A-BGL合成APG的影响
如图4所示,反应体系的pH值对反应体系APG产率影响较大,当乙酸-乙酸钠缓冲液pH 值为3时,A-BGL催化合成APG的产率最高。当以水杨苷为底物时,A-BGL的最适pH为4.0-4.5。但从本试验所得结果看,A-BGL通过展示毕赤酵母表面在其对酸度适应性比较强,可适应的pH值范围较广。
2.4 温度对A-BGL合成APG的影响
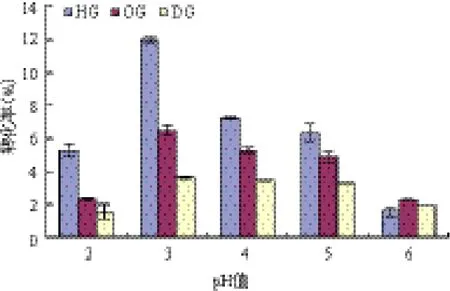
图4 乙酸-乙酸钠缓冲液pH值对合成APG的影响
从图5中可以看出,温度对反应体系的APG产率有较大的影响,随着温度的变化APG产率会有着明显的变化规律;从30℃到50℃的温度区间内APG产率随着温度的增加而增大,50℃时HG产率达到最大值11.84%。但是随着反应温度到达60℃时其产物浓度和产率却降低了,可能是棘孢曲霉β-葡萄糖苷酶在高温下变性而失活,酶促反应速度下降。同时温度对反应影响也依赖于介质成分,在合成OG和DG时,反应温度从50℃上升到55℃,其产率增加趋势均相对较大,55℃为其最佳反应温度。
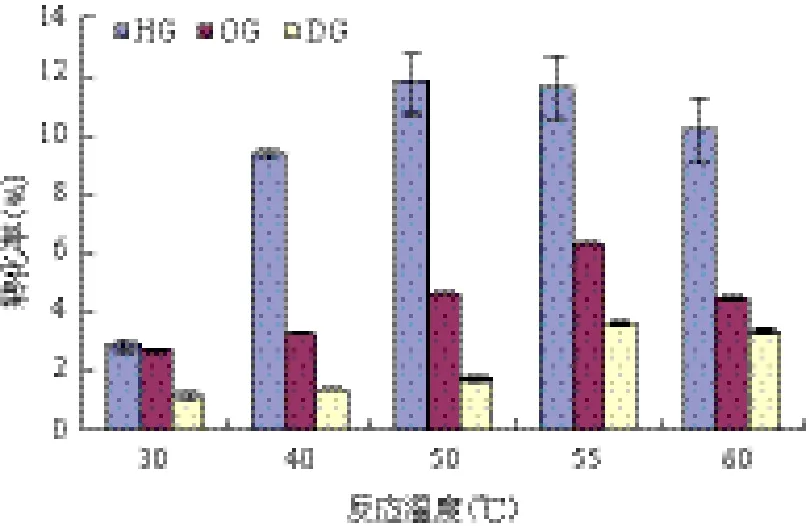
图5 温度对A-BGL合成APG的影响
2.5 全细胞催化剂、游离苦杏仁β-葡萄糖苷酶和Novozyme 188催化合成APG的比较
从图6中可以看出在等酶活的条件下,全细胞催化剂与商品化苦杏仁β-葡萄糖苷酶、Novozym188在合成APG效率上比较。由于Novozym188属于纤维素二糖酶,不适合于逆水解反应,催化合成APG效果较差,尤其是对于长链脂肪醇而言。由于苦杏仁β-葡萄糖苷酶是游离酶,全细胞催化剂比酶活小,单位重量酵母细胞表面展示的棘孢曲霉β-葡萄糖苷酶蛋白较苦杏仁β-葡萄糖苷酶要少。体系处于等酶活的条件,加入酶量较少,杏仁β-葡萄糖苷酶能较好分散在水中,混合均匀,传质阻力相对较小。所以在催化合成APG时,6 h 时产率就到达最大值,之后变化不大。相比之下,全细胞催化剂都所需的反应时间要长一些,但最终的产率全细胞催化剂要略高于商品化苦杏仁β-葡萄糖苷酶。由此可以通过提高展示系统蛋白表达量,进行毕赤酵母的高密度发酵,提高单位干重细胞酶活,可以进一步提高其催化合成APG的效率。
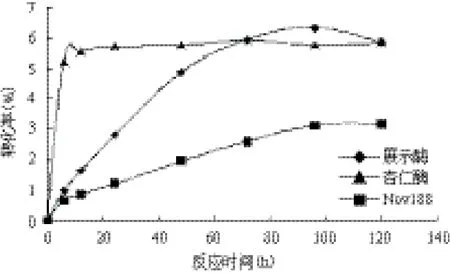
图6 OG合成的反应曲线
2.6 全细胞催化剂合成APG的操作稳定性
酶的操作稳定性是全细胞催化剂的重要特性之一,它直接影响着连续化、自动化生产过程和生产成本。如图7,全细胞催化剂有较好的操作稳定性。在反应5批次后,APG的相对产率变化不大略有下降,其中反应2批次均逐步增加。
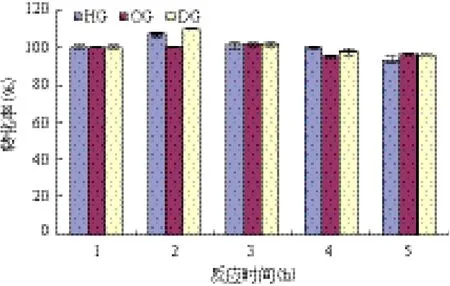
图7 全细胞催化剂合成APG的操作稳定性
3 讨论
反应体系中含水量对APG的逆水解合成有较大的影响,Ito等[7]也报道在酿酒酵母细胞表面展示的A-BGL催化以pNPG为底物转糖苷合成APG时,当含水量为5%时,几乎不能合成HG,其最佳含水
量为20%。因为水不仅对维持酶的构象起着重要作用,而且作为溶剂能溶解底物葡萄糖,但是过多的水便会阻碍反应向生成APG的方向进行,导致APG产率下降,所以对反应平衡影响很大,APG的最终产率是由两个反应之间的比例决定的[8]。
理论上底物葡萄糖的提高应有利于反应向合成方向的推动,从而提高APG的产物浓度,但事实证明,增加葡萄糖浓度反而会使产物浓度略有下降,产率显著下降[9]。APG浓度降低主要是因为葡萄糖的浓度过高会对β-葡萄糖苷酶的活性起到抑制作用。在已被研究的β-葡萄糖苷酶中,绝大多数β-葡萄糖苷酶被葡萄糖强烈抑制[10-12],而且在极低浓度的葡萄糖就能抑制β-葡萄糖苷酶活性[13]。通常葡萄糖对β-葡萄糖苷酶活力的抑制常数Ki为0.2-100 mmol/L[14,15],也有极少数来自酵母和真菌的β-葡萄糖苷酶,其对葡萄糖的抑制常数超过200 mmol/L[16,17]。Vulfson等[18]报道了在1-己醇为20 mL,添加的葡萄糖为1 mmol(0.18 g)时产率最大。
温度是酶促反应又一个重要因素之一,因为温度不仅影响底物的溶解度,也影响酶活。Ito等报道了棘孢曲霉β-葡萄糖苷酶转糖苷催化HG时,50℃的产率明显高于30℃的。这是由于提高反应温度可以提高底物葡萄糖的溶解度,降低脂肪醇介质黏度,增加双相反应体系中各相的相容性,使合成反应容易进行。本试验合成APG的最适温度为55℃,这与周亚军[19]报道的固定酶催化合成OG的反应中,温度对葡萄糖转化率的影响相一致。
展示在毕赤酵母表面的A-BGL类似于固定化酶,相比游离酶耐酸性更强,操作稳定性强,可回收利用。本研究全细胞催化剂重复利用了5次,转化率几乎不变,这与任昌琼[20]报道在有机溶剂中用表面展示南极假丝酵母脂肪酶B合成果糖酯的操作稳定性的结果相似。脂肪醇和乙酸-乙酸钠缓冲液可能有助于酶表面形成一层结构水膜,对酶有一定的保护作用,从而增加其热稳定性。由此可知全细胞催化剂具有良好的水-醇双相体系稳定性和重复利用性,为进一步扩大化生产奠定了良好的基础。
4 结论
本研究通过试验探讨了几种主要单因素对全细胞催化剂GS115/pKFS-ABGL在水-醇双相体系中逆水解催化合成APG产率的影响,并进行优化。合成不同碳链的APG最适条件有所不一样,但总体变化趋势相同。在0-24 h 内,全细胞催化剂催化合成APG的合成速率较低,随着APG合成速率迅速增加,72 h后达到最大产率,其中HG和DG的产率分别为11.69%和3.58%,而OG产率在96 h 才到达最大值6.34%。虽然苦杏仁β-葡萄糖苷酶催化合成APG较好的转化率,但是成本较高。
采用毕赤酵母展示的棘孢曲霉β-葡萄糖苷酶能极大降低酶的应用成本,该酶具有与苦杏仁酶相当甚至略高的转化率。此外,毕赤酵母展示的全细胞催化剂GS115/pKFS-ABGL有较好的操作稳定性,在反应5批次后,APG的相对产率变化不大,可以为酶工业化生产APG大大节省了生产成本,具备较好的应用前景。
[1] Putnik CF, Borys NF. Alkyl polyglycosides[J]. Soap Chem Spec, 1986, 62:34-37.
[2] Milosavić NB, Prodanović RM, Jankov RM. A simple and efficient one-step, regioselective, enzymatic glucosylation of arbutin by α-glucosidase[J]. Tetrahedron Letters, 2007, 48(40):7222-7224.
[3] Perugino G, Trincone A, Rossi M, et al. Oligosaccharide synthesis by glycosynthases[J]. Trends in Biotechnology, 2004, 22(1):31-37.
[4] 杜娟, 庄蕾, 季明杰, 等. 棘孢曲霉SM-L22 β-葡萄糖苷酶的纯化与性质[J]. 菌物系统, 2002, 21(2):239-245.
[5] Kondo A, Ueda M. Yeast cell-surface display—applications of molecular display[J]. Appl Microbiol Biotechnol, 2004, 64(1):28-40.
[6] 韦斌如, 刘端玉, 郑穗平, 等. 棘孢曲霉 β-D-葡萄糖苷酶在毕赤酵母中的表达及烷基糖苷的催化合成[J].高等学校化学学报, 2012, 33(7):1498-1504.
[7] Ito J, Ebe T, Shibasaki S, et al. Production of alkyl glucoside from cellooligosaccharides using yeast strains displayingAspergillus aculeatusβ-glucosidase 1[J]. J Mol Catal B:Enzym, 2007, 49(1):92-97.
[8] Rather MY, Mishra S, Chand S. β-glucosidase catalyzed synthesis of
octyl-β-D-glucopyranoside using whole cells ofPichia etchellsiiin micro aqueous media[J]. J Biotechnol, 2010, 150(4):490-496.
[9] Ismail A, Soultani S, Ghoul M. Optimization of the enzymatic synthesis of butyl glucoside using response surface methodology[J]. Biotechnol Prog, 1998, 14(6):874-878.
[10] Bothast RJ, Saha BC. Ethanol production from agricultural biomass substrates[J]. Adv Appl Microbiol, 1997, 44:261-286.
[11] Gueguen Y, Chemardin P, Arnaud A, et al. Purification and characterization of an intracellular β-glucosidase fromBotrytis cinerea[J]. Enzyme Microb Technol, 1995, 17(10):900-906.
[12] Woodward J, Wiseman A. Fungal and other β-D-glucosidases—their properties and applications[J]. Enzyme Microb Technol, 1982, 4(2):73-79.
[13] Saha BC, Bothast RJ. Production, purification, and characterization of a highly glucose-tolerant novel β-glucosidase fromCandida peltata[J]. Appl Environ Microbiol, 1996, 62(9):3165-3170.
[14] Karnchanatat A, Petsom A, Sangvanich P, et al. Purification and biochemical characterization of an extracellular β-glucosidase from the wood—decaying fungusDaldinia eschscholziiRehm[J]. Microbiol. Lett., 2007, 270(1):162-170.
[15] Mamma D, Hatzinikolaou DG, Christakopoulos P. Biochemical and catalytic properties of two intracellular β-glucosidase from the fungusPenicillium decumbensactive on flavonoid glucosides[J]. J Mol Catal B:Enzym, 2004, 27(4):183-190.
[16] Bronnenmeier K, Staudenbauer WL. Purification and properties of an extracellular β-glucosidase from the cellulolytic thermophileClostridium stercorarium[J]. Appl Microbiol Biotechnol, 1988, 28(4-5):380-386.
[17] Xu Y, Wang D, Mu XQ, et al. Biosynthesis of ethyl estersof shortchain fatty acids using whole-cell lipase fromRhizopus chinesisCCTCC M201021 in non-aqueous phase[J]. J Mol Catal B:Enzym, 2002, 18(1):29-37.
[18] Vulfson EN, Patel R, Beecher JE, et al. Alkyl-β-glucoside synthesis in a water-organic two-phase system[J]. Biotechnol Lett, 1990, 12(6):397-402.
[19] 周亚军, 赖雪雷, 刘艳菊, 等. 固定酶催化合成正辛基葡萄糖苷工艺研究[J]. 现代化工, 2010, 30(2):163-165.
[20] 任昌琼. 表面展示南极假丝酵母脂肪酶B的毕赤酵母全细胞催化合成糖酯[D]. 广州:华南理工大学, 2010.
(责任编辑 李楠)
Optimization of the Synthesis of Alkyl Glucoside Catalyzed by Aspergillus aculeatus β-glucosidase-displaying Pichia pastoris Whole-cells
Hu Xiayan Liu Duanyu Zheng Suiping
(School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510006)
Aspergillus aculeatus β-glucosidase displayed Pichia pastoris cell surface was used as whole-cell biocatalyst, glucose as substrate, catalyzed synthesis alkyl glucosides of C6-C10 with reverse hydrolysis in water-alcohol two-phase system. The effects of various reaction factors, including water content, whole-cell biocatalyst dose, glucose concentration, pH and temperature were optimized. The catalytic effect of whole-cell biocatalyst were compared with commercial enzyme almond β-glucosidase and Novozym188 . The results showed that Novozym188 was not suitable for synthesis of APG, almond β-glucosidase need shorter time than whole-cell biocatalyst, but the final conversion of whole-cell biocatalyst was higher. In 5 mL total reaction volume, the optimal reaction conditions of HG:0.1 g glucose, 0.05 g whole-cells biocatalyst, 10% pH3.0 buffer;the optimal reaction conditions of OG:0.2 g glucose, 0.05 g whole-cells biocatalyst, 15% pH3.0 buffer;the optimal reaction conditions of DG:0.2 g glucose, 0.2 g whole-cells biocatalyst, 20% pH3.0 buffer, temperature 55℃, 200 r/min. After 72 h the maximum HG and DG yield could be 11.69% and 3.58%. The highest yield of OG was 6.34% after 96 h.
Cell surface displaying β-glucosidase Whole-cell biocatalyst Alkyl glucosides
2013-12-09
国家自然科学基金项目(31171633),广东省工业科技攻关项目(2010B011000004)
胡霞艳,女,硕士,研究方向:酶与酶应用;E-mail:lucksnail@163.com
郑穗平,男,博士,教授,研究方向:酶工程;E-mail:spzheng@scut.edu.cn

