毕赤酵母高密度培养表达鸡α-干扰素的工艺研究
姜正军刘树海王茂超程全明黄金,2
(1.山东华辰生物科技有限公司,潍坊 261061;2.浙江工业大学药学院,杭州 310014)
毕赤酵母高密度培养表达鸡α-干扰素的工艺研究
姜正军1刘树海1王茂超1程全明1黄金1,2
(1.山东华辰生物科技有限公司,潍坊 261061;2.浙江工业大学药学院,杭州 310014)
考察了10 L罐规模条件下pH、温度、装液量以及碳源流加模式对毕赤酵母高密度培养表达鸡α-干扰素的影响,确定了最优的生产工艺:在pH5.5、28℃、40%装液量条件下,当初始碳源耗尽的情况下,进行甘油和甲醇混合(流加体积速率比为20∶1)脉冲流加,产物鸡α-干扰素抗病毒活性最高,可达3×106IU/mL。将该工艺在50 L发酵罐规模条件下进行放大,重复20批,结果表明此过程重复性较好,且目的蛋白表达量稳定,具有工业化生产的实际应用价值。
毕赤酵母 鸡α-干扰素 优化 放大
近年来,鸡的烈性病毒性传染病在我国部分地区及世界范围呈流行趋势,如禽流感、法氏囊病、新城疫、马立克氏病等,已成为公共卫生的一大危害。仅2013年国内报道了135例人感染禽流感病例,造成45例发病死亡,长三角地区因H7N9禽流感疫情扑杀销毁的禽类据不完全统计达到数百万只。同时,据报道目前种种迹象和最新的科学试验结果都表明今年秋冬季节天气转冷时H7N9禽流感很可能还将在我国卷土重来[1]。届时,无疑对畜禽业的发展又将是一场劫难。
随着分子生物学技术的不断发展,加之天然干扰素在生产和应用中的限制,使得利用基因工程手段介入干扰素的生产成为了生产和研发的主流。20世纪70年代起,研究者就开始探索利用基因工程手段进行IFN的生产,取得了很大进步。近年来,国内对鸡干扰素的研究陆续展开,但多数侧重于鸡II型干扰素(IFN-γ)的研究和开发,而对鸡I型干扰素(IFN-α)的研究和开发主要集中在基因克隆及其表达上[2,3]。因中下游发酵技术以及高密度培养理论未能有效衔接上游分子改造,致使利用重组工程菌高密度培养生产干扰素过程中遇到高密度培养困难、工艺控制复杂、生产稳定性差、生产规模放大困难等问题,已成为制约我国干扰素生产和应用的瓶颈问题。
本课题组前期研究利用毕赤酵母表达系统成功地进行了鸡I型干扰素(IFN-α)的表达,将去掉全阅读框的信号肽序列后的鸡干扰素成熟蛋白的基因序列整合到酵母表达载体pPICZa-A上。重组菌获得外源蛋白(鸡IFN-α)纯度大于70%,经过65 636倍稀释发现能完全抑制100-1 000 TCID50的水疱性口炎病毒的攻击。同时其对VSV和禽流感病毒的转录、翻译阶段抑制能力尤为明显[4,5]。本研究在前期试验的基础上,进行毕赤酵母高密度培养表达鸡α-干扰素的工艺优化和放大试验,获得较为成熟的工艺,旨在为鸡α-干扰素规模化生产提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种 鸡α-干扰素重组酵母菌Pichia pastorisIFNα-pPICZαA,由南京农业大学农业部动物疫病诊断与免疫重点开放实验室保藏。
1.1.2 培养基 活化培养基:1%酵母粉,2%胰蛋白胨,2%葡萄糖,18.218% D-山梨醇。115℃,20 min灭菌。
种子培养基:1%酵母粉,2%胰蛋白胨,1%甘油,1.34% YNB和4×10-7生物素(灭菌后过滤添加),用磷酸缓冲液调节初始pH6.0,121℃,20 min灭菌。
初始发酵培养基:1%酵母粉,2%胰蛋白胨,0.5%甲醇、1.34% YNB和4×10-7生物素(灭菌后过滤添加),用磷酸缓冲液调节初始pH6.0,121℃,20 min灭菌。
1.2 方法
1.2.1 培养方法 将从平板单菌落挑2环接入活化培养基(100 mL/500 mL摇瓶)中,在30℃,220 r/min下培养24 h后,以10 %(V/V)接种量接入装有2.5 L种子培养基的5 L种子罐中进行扩大培养,培养温度为30℃,pH6.0,转速300 r/min,通风量为1.0 vvm,培养至OD650= 40以上时,以10%(V/V)接种量压入10 L发酵罐中,初始转速为300 r/min,初始装液量60%,温度30℃,pH6.0;对于50 L规模发酵放大试验,以10 L罐为二级种子罐(其培养条件同5 L种子罐),初始发酵条件与10 L规模试验相同,过程调控转速和通气量保持溶解氧浓度大于10%;发酵过程脉冲流加甲醇、甘油或葡萄糖,通过测定和监控使甲醇、甘油或葡萄糖浓度控制在0.1%-0.5%。
1.2.2 分析方法
1.2.2.1 菌体生长 采用比浊法,使用紫外分光光度计测定。将发酵液样品经适当稀释,测定其在650 nm下的光密度OD650;测定细胞干重时,将从发酵罐中所采具有不同OD650值的样品,离心洗涤2次,80℃下烘干至恒重,得到表达鸡α-干扰素重组毕赤酵母的细胞干重与OD650之间的关系为:Y(DCW)= 0.417 OD650。
1.2.2.2 抗病毒活性测定 测定用细胞和病毒由南京农业大学赠送,细胞为鸡胚成纤维细胞(CEF),病毒为水泡性口炎病毒(VSV)。测定方法参照参考文献[6]的抗病毒活性测定方法。
1.2.2.3 甘油浓度测定 采用HPLC法,Agilent 1100 液相色谱仪,C18反向柱,5 μm,4.6 mm× 250 mm;流动相:70%乙腈,30%水;流速:0.6 mL/min;柱温:30℃;进样量:5 μL;检测器:示差折光检测器。
1.2.2.4 甲醇浓度测定 参照文献方法[7]用气相色谱仪测定。
1.2.2.5 葡萄糖浓度测定 利用SBA-40生物传感仪测定(山东省农业科学院)。
2 结果
2.1 pH对毕赤酵母高密度培养表达鸡α-干扰素的影响
在10 L罐发酵水平,维持不同的pH条件下,考察其对干扰素表达及菌体合成的影响。结果(图1)显示,维持pH5.5条件下,发酵42 h,细胞干重达到25.5 g/L,产物鸡α-干扰素IFN-α抗病毒活性达
到2×106IU/mL。虽在pH6.0条件下获得的细胞干重与pH5.5相比更高,但产物抗病毒活性相对较低,所以选择维持pH5.5进行后续试验。
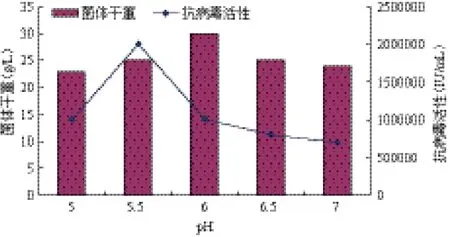
图1 pH对毕赤酵母高密度培养表达鸡α-干扰素的影响
2.2 温度对毕赤酵母高密度培养表达鸡α-干扰素的影响
通过考察不同温度条件下对菌体合成和产物鸡α-干扰素抗病毒活性的影响发现,维持全过程温度28℃时,产物鸡α-干扰素抗病毒活性最高,可达到2×106IU/mL(图2)。
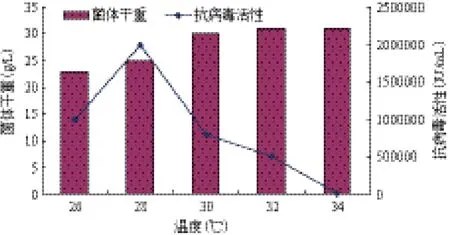
图2 温度对毕赤酵母高密度培养表达鸡α-干扰素的影响
2.3 装液量对毕赤酵母高密度培养表达鸡α-干扰素的影响
鉴于装液量对于工程菌发酵的重要性(影响营养物及氧气的传递性能),考察了10 L发酵罐中不同装液量(80%、70%、60%、50%和40%)对菌体合成及鸡α-干扰素表达的影响。结果(图3)表明,随着装液量的增加菌体合成量大致呈下降趋势。而在装液量为50%条件下,在获得较大菌体量的同时,产物获得了最高的抗病毒活性(3×106IU/mL)。在40%装液量条件下的发酵液经镜检发现大量细胞碎片的存在,推测原因可能是在相同搅拌功率条件下,随着装液量的减少,P/V(单位体积功率系数)将增大,从而对菌体细胞产生较大的剪切力,造成细胞破碎。

图3 装液量对毕赤酵母高密度培养表达鸡α-干扰素的影响
2.4 碳源流加模式对毕赤酵母高密度培养表达鸡α-干扰素的影响
考察不同流加模式对毕赤酵母高密度培养表达鸡α-干扰素的影响,结果(表1)显示,以模式1,即甘油和甲醇混合(流加体积速率比为20∶1)脉冲流加,在获得最大菌体量的同时,获得鸡α-干扰素最大的抗病毒活性为5.1×106IU/mL。
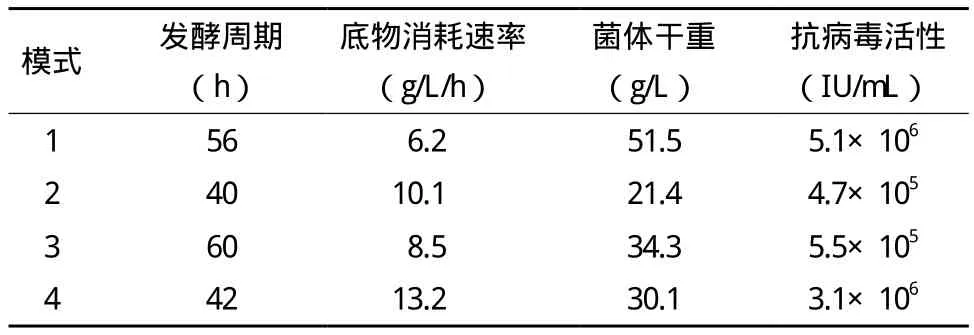
表1 碳源流加模式对毕赤酵母高密度培养表达鸡α-干扰素的影响
2.5 规模放大试验
将10 L自控发酵罐的补料批次发酵过程(图4)显示,在50 L规模进行放大,重复20批。结果显示,与10 L罐上的各项表观参数相比,50 L罐发酵过程各项目标参数与10 L没有较大的变化,结果重现性较好,生产过程各项参数较为稳定(表2),且目的蛋白表达量稳定(图5),具有工业化生产的实际价值。
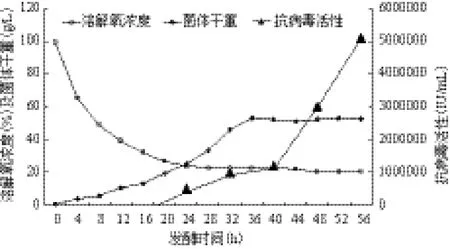
图4 10 L自控发酵罐的补料批次发酵过程图
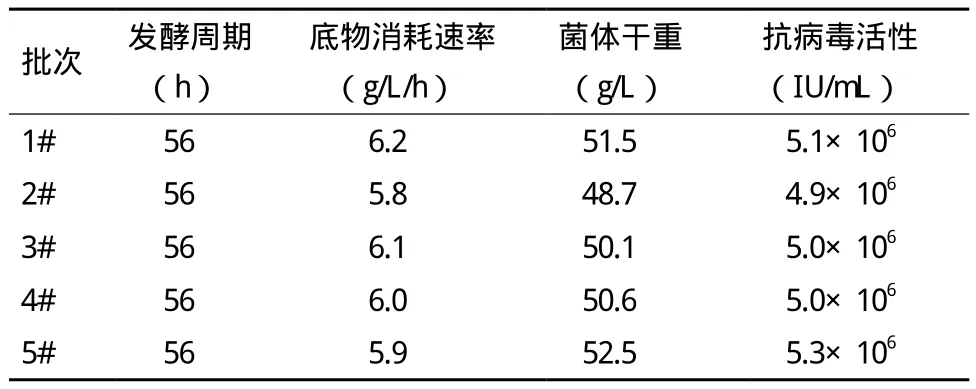
表2 50 L发酵规模毕赤酵母高密度培养表达鸡α-干扰素过程稳定性
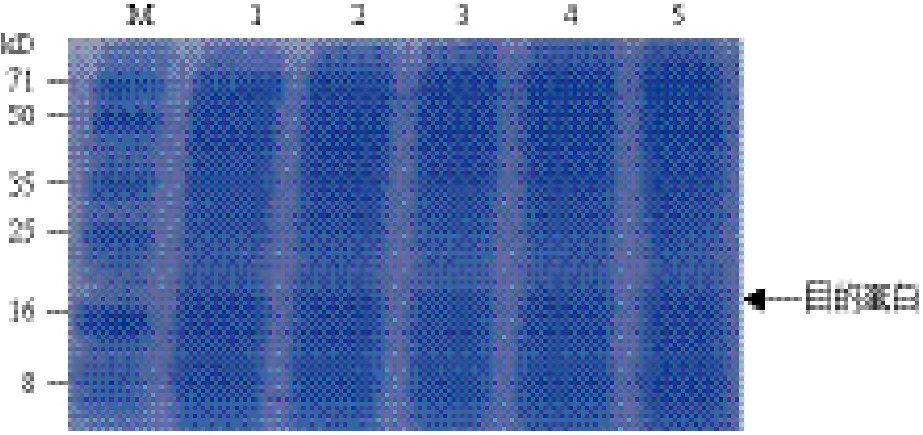
图5 50 L发酵罐中不同批次重组鸡α-干扰素的表达
3 讨论
目前利用毕赤酵母表达系统进行鸡I型干扰素(IFN-α)表达的报道已经屡见不鲜,且其表达产物IFN-α对VSV和禽流感病毒的转录、翻译阶段具有确切的抑制作用[4,5]。温度对毕赤酵母高密度流加培养表达外源蛋白表达过程有极大的影响,过高的温度会导致细胞代谢活性低(表现为过低的AOX活性),而过低的温度同样会带来大量毒性物质甲醛和过氧化氢积累[8,9]。在通常条件下,毕赤酵母利用甲醇表达外源蛋白过程中,甲醇同时充当诱导剂、碳源和能源的角色,直接导致能量再生速度不足限制目标蛋白的高效可持续表达;另一方面,甲醇代谢途径过重的能量再生运转负担还会诱发中间毒性代谢产物(如甲醛)的生成积累,造成细胞过早衰亡[10]。
一般来说,重组毕赤酵母进行干扰素表达多采用补料-分批发酵形式进行,以指数形式补料使细胞以恒定速率生长,易于实现菌体生长的高密度,从而对重组蛋白的表达十分有利。此过程分为两个阶段:高密度流加培养和蛋白诱导表达阶段。对于高密度流加培养过程报道主要集中在基于比生长速率的最优甲醇流加控制以及甲醇浓度的控制方面。而高生长速率条件下,溶解氧通常是一个限制性因素,通过富氧提供、提高罐压、保持培养液中甲醇低浓度等手段来维持和改善细胞呼吸代谢往往成为现有生产过程控制的主要方式。但提供富氧和提升罐压,往往会造成细胞毒性和呼吸代谢受到抑制等问题。由于甲醇充当碳源、能源和诱导剂的三重角色,致使维持培养液中甲醇低浓度对能量/呼吸代谢也是无益的(外源蛋白的形成和生产过程中需要消耗大量的能量,能量的供给和储存与外源蛋白表达的同化合成途径严重地互相依存),同时甲醇浓度过低诱导强度不够,蛋白表达效率将受到影响[11-13]。
本研究从pH、温度、装液量以及碳源流加模式等方面对毕赤酵母高密度培养表达鸡α-干扰素的生产工艺进行了摸索,并进行了发酵规模的放大试验,以期获得适用于工业化生产的工艺条件。而基于高密度环境条件下的能量/呼吸代谢的响应机理正在研究之中。
4 结论
本研究首先在10 L罐规模条件下考察了pH、温度、装液量以及碳源流加模式对毕赤酵母高密度培养表达鸡α-干扰素的影响,确定了最优的生产工艺:在pH5.5、28℃、40%装液量条件下,当初始碳源耗尽的情况下,进行甘油和甲醇混合(流加体积速率比为20∶1)脉冲流加,产物鸡α-干扰素抗病毒活性最高,可达3×106IU/mL。在50 L发酵罐规模条件下,将该工艺进行放大,重复20批,结果表明此过程重复性较好,且目的蛋白表达量稳定,具有工业化生产的实际应用价值。
[1] Cowling BJ, Jin L, Lau EHY, et al. Comparative epidemiology of human infections with avian influenza A(H7N9)and A(H5N1)viruses in China:a population-based study of laboratory-confirmed cases[J]. Lancet, 2013, 382(9887):129-137.
[2] 葛忠源, 张秀云.鸡干扰素研究进展[J].家禽科学, 2010, 5:46-48.
[3] 岳道友, 索勋, 汪明, 等.鸡α-干扰素研究进展[J].中国家禽, 2010, 32(17):45-47.
[4] 陈溥言, 蔡梅红, 曹瑞兵.一种重组鸡α干扰素的生产方法及
其重组载体:中国, CN200410041075.0[P].2004-06-24.
[5] 蔡梅红, 张素芳, 曹瑞兵, 等.重组酵母鸡γ干扰素的抗病毒活性测定及临床初步应用[J].微生物学报, 2006, 46(1):115-119.
[6] 蔡梅红, 曹瑞兵, 曹景立, 等.重组酵母鸡干扰素的诱导表达及其抗MDV、NDV能力[J].西北农林科技大学学报, 2010, 38(9):37-41.
[7] 邓兵兵, 方宏清, 薛冲, 等.甲醇营养型酵母高密度培养过程中甲醇和乙醇的GC快速检测[J].工业微生物, 2001, 31(2):69-72.
[8] Wegner G. Emerging applications of the methylotrophic yeasts[J]. FEMS Microbiol Rev, 1990, 87(3-4):279-283.
[9] Li ZJ, Xiong F, Lin QS, et al. Low-temperature increases the yield of biologically active herring antifreeze protein inPichia pastoris[J]. Protein Express Purif, 2001, 21(3):438-445.
[10] Ramón R, Ferrer P, Valero F. Sorbitol co-feeding reduces metabolic burden caused by the overexpression of aRhizopus oryzaelipase inPichia pastoris[J]. J Biotechnol, 2007, 130(1):39-46.
[11] Kobayashi K, Kuwae S, Ohya T, et al. High level secretion of recombinant human serum albumin by fed-batch fermentation of the methylotrophic yeast,Pichia pastoris, based on optimal methanol feeding strategy[J]. J Biosci Bioeng, 2000, 90(3):280-288.
[12] Zhang W, Bevins MA, Plantz BA, et al. ModelingPichia pastorisgrowth on methanol and optimizing the production of a recombinant protein, the heavy-chain fragment C of botulinum neurotoxin, serotype A[J]. Biotechnol Bioeng, 2000, 70(1):1-8.
[13] Krainer FW, Dietzsch C, Hajek T, et al. Recombinant protein expression inPichia pastorisstrains with an engineered methanol utilization pathway[J]. Microb Cell Fact, 2012, 11:22.
(责任编辑 马鑫)
The Improvement of Chicken Alpha Interferon Expression by a Recombinant Pichia pastoris with Cultural Condition Optimization
Jiang Zhengjun1Liu Shuhai1Wang Maochao1Cheng Quanming1Huang Jin1,2
(1. Shandong Huachen Bio-tech Co.,Ltd,Weifang 261061;2. College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310014)
To achieve excellent performance of Pichia pastoris for chicken alpha interferon expression, pH value, temperature, culture volume and carbon source feeding pattern were optimized. The maximum anti-virus activity(3×106IU/mL)was harvested in the conditions of pH5.5, 28℃, and 40% culture volume in 10 L fermentor, as well as the glycerol-methanol(20∶1, V/V)co-feeding pattern was conducted when carbon source exhausted. This process was successfully scaled up to 50 L fermentor and the fermentation performance was also steady, which could be taken advantage of for its industrial application.
Pichia pastoris Chicken alpha interferon Optimization Up-scale
2013-12-03
山东省2011年科技发展计划资助项目(2011GGH22109)
姜正军,男,硕士,高级工程师,研究方向:蛋白类药物;E-mail:sinostar5555@gmail.com
黄金,博士,副教授,研究方向:蛋白类药物研发;E-mail:huangjin979@zjut.edu.cn

