敲减FST基因对猪成纤维细胞中相关基因表达的影响
孙亚蒙张冬杰汪亮张旭尹雪刘娣,
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.黑龙江省农业科学院畜牧研究所,哈尔滨 150086)
敲减FST基因对猪成纤维细胞中相关基因表达的影响
孙亚蒙1张冬杰2汪亮2张旭1尹雪1刘娣1,2
(1.东北农业大学动物科学技术学院,哈尔滨 150030;2.黑龙江省农业科学院畜牧研究所,哈尔滨 150086)
旨在获得敲减FST基因的猪胎儿成纤维细胞,并探讨对相关基因表达的影响。将构建成功并鉴定准确的发夹RNA真核表达载体FR1-shRNA利用脂质体转染至猪胎儿成纤维细胞中,并进行G418筛选,获得稳定转染细胞株,并利用Real-time检测了相关基因表达的变化。结果表明,在稳定转染的细胞株中,FST基因的表达受到显著抑制,结果导致了ActivinRⅡA、Myostatin和Bmp4基因的表达出现下调趋势,并且极显著地降低MyoD基因的表达。
卵泡抑素(FST) RNA干扰 猪胎儿成纤维细胞 相关基因
Follistatin基因编码的卵泡抑素(follistatin,FST)是一种富含半胱氨酸的单链糖蛋白,因其对卵泡刺激素有较强的抑制作用,又称其为促卵泡素(FSH)抑制蛋白。FST基因含6个外显子(exon)和5个内含子(intron),全长约6 000 bp,其中最后一个外显子编码了氨基酸前体的C末端,在后期的加工修饰过程中,能形成羧基末端截去27个氨基酸的同系物[1,2]。在功能上,长期以来仅知是一种辅助生殖调节的调节激素,近年来研究表明,FST在垂体、肾上腺、骨髓、肾、脂肪、骨骼肌和胰腺等多种组织器官中广泛表达[3,4],在胚胎发育、红细胞生成[5]、神经细胞分化[6]、促进骨骼肌发育[7]等方面发挥多种生物学作用。
RNA干扰技术(RNAi)因其设计简单,操作性强,并能高效特异地抑制靶基因的特点,近年来发展迅速,并成功应用于包括人在内的多种物种的基因功能研究和基因治疗等领域[8]。本研究通过RNAi技术,利用shRNA载体获得稳定抑制FST基因表达的猪胎儿成纤维细胞系,并检测抑制FST基因表达后对ActRⅡA、MSTN、Bmp4和MyoD四个基因表达的影响,旨在为FST基因的功能研究提供一定的试验基础和理论依据。
1 材料与方法
1.1 材料
RNA干扰载体pSilencer4.1-CMV neo购自北京欧比特公司;大肠杆菌感受态菌株DH5α,购自原平皓生物;限制性内切酶、dNTP、DL2000 Marker、rTaq、氨苄青霉素等均购自宝生物工程(大连)有限公司;FST蛋白抗体和猪β-actin蛋白抗体购自TransGen Biotech;蛋白Marker、蛋白抽提试剂盒、BCA蛋白定量试剂盒均购自康为世纪;SYBR Green PCR Master Mix(5 mL)购自ABI;DMEM培养基、LipofectamineTM2000购自Invitrogen。
1.2 方法
1.2.1 猪FST基因干扰载体的构建 根据GenBank登录号为NM_001003662.1提供的mRNA序列,将FST基因完整编码区序列输入ABI公司的在线网站进行干扰靶序列的设计与筛选。最终选择了3条干扰序列,FR1:5'-GATCCGCCTACTGTGTGACATGTATTCAAGAGATACATGTCACACAGTAGGCTTA-3';FR2:5'-GATCCCCTACTGGGCAGATCTATTTTCAAGAGAAATAGATCTGCCCAGTAGGTTA-3';FR3:5'-GATCCCCTCAAGGCCAGATGTAAATTCAAGAGATTTACATCTGGCCTTGAGGTTA-3',序列两端分别引入BamHⅠ和Hind Ⅲ酶切位点,以试剂盒所提供的与猪的任何一个基因序列无同源性的非特异性质粒作为阴性对照,同时合成其对应的互补链,退火、连接,构建成功的质粒通过测序验证其准确性。
1.2.2 猪胎儿成纤维细胞的培养 选取35 d的胎猪,无菌条件下剪去头、尾和内脏,用含高浓度双抗的PBS将预处理的组织漂洗5遍,将组织块剪成1 mm3的小块,向培养皿中加入0.25%胰蛋白酶的消化液37℃消化40 min,每隔10 min摇匀一次,消化后,收集消化液,用200目灭菌的细胞筛过滤,收集滤液以1 000 r/min离心15 min,弃上清,将沉淀重悬于37℃预温的完全培养基中,然后进行常规的细胞培养和传代,或冷冻保存。
1.2.3 细胞的转染及筛选 将转化成功的FST-shRNA干扰质粒和阴性对照质粒进行去内毒素的抽提和纯化,当细胞生长汇合至80%-90%时,使用LipofectamineTM2000(Invitrogen)将上述质粒进行转染,其中质粒与脂质体的比例为8 μg质粒:20 μL脂质体。同时设置一个正常培养的空白对照组。当转染至72 h时,细胞用400 μg/mL的G418筛选2周,直至空白组细胞完全死亡,然后使用200 μg/mL的G418维持培养。
1.2.4 Real-time和Western blot方法筛选干扰序列 提取各组细胞的RNA,利用Invitrogen的反转录试剂盒进行反转录。根据FST基因mRNA设计的引物:上游FST1:5'-TGAGGGAAAGTGTATCAAAGC-3';下游FST2:5'-CTCGGTGTCTTCTGAAATGG-3'。同时使用猪GAPDH基因做内参,对FST基因进行Real-time检测。
收集各组细胞,制备裂解液,离心提取蛋白,BCA试剂盒对提取的蛋白定量,上样、转膜、封闭、抗体孵育、压片。对FST基因的干扰效率进行鉴定。
1.2.5 实时荧光定量(Real-time)PCR 检测相关基因的表达 收集试验组、阴性对照组和空白组细胞,提取细胞的总RNA,反转录,对各个基因的表达进行Real-time PCR鉴定。Real-time PCR的反应体系为:反转录得到的cDNA模板0.8 μL,10 μL SYBR Green荧光染料MIX,ddH2O 7.6 μL,上、下游引物各0.8 μL。Real-time PCR程序为:95℃ 10 min;95℃ 30 s,60℃ 1 min,40个循环;95℃ 1 min,55℃ 30 s,95℃ 30 s。自动生成Ct值,以GAPDH为内参,2-ΔΔCt法对结果进行校正,各基因的相对表达量重复3次,取平均值。相关引物序列及参数见表1。
1.2.6 数据分析 不同分组试验数据用SPSS 16.0软件进行分析,每个试验组至少3次重复,结果用x±s表示。
2 结果
2.1 重组质粒的序列鉴定
重组质粒构建完成后,送至Invitrogen进行测序,结果表明所有质粒序列均正确无误,分别命名为FR1-shRNA、FR2-shRNA和FR3-shRNA。
2.2 FST基因干扰效率检测
将筛选得到的稳定转染的试验组、阴性对照组和空白组细胞分别提取总RNA和蛋白,进行比较分析,实时荧光定量PCR(图1)和Western blot(图2)的结果表明,FR1-shRNA组中,FST基因的表达
水平显著低于其他各组,提示FR1-shRNA稳定转染的猪胎儿成纤维细胞中,FST基因的表达受到抑制。

表1 引物序列及参数
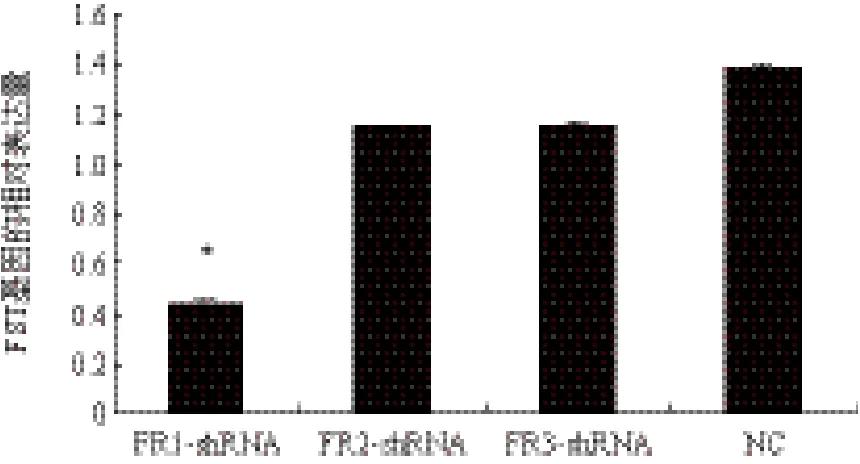
图1 各RNA干扰组和阴性对照组中FST基因Real-time鉴定结果

图2 FST基因干扰后的Western blot鉴定结果
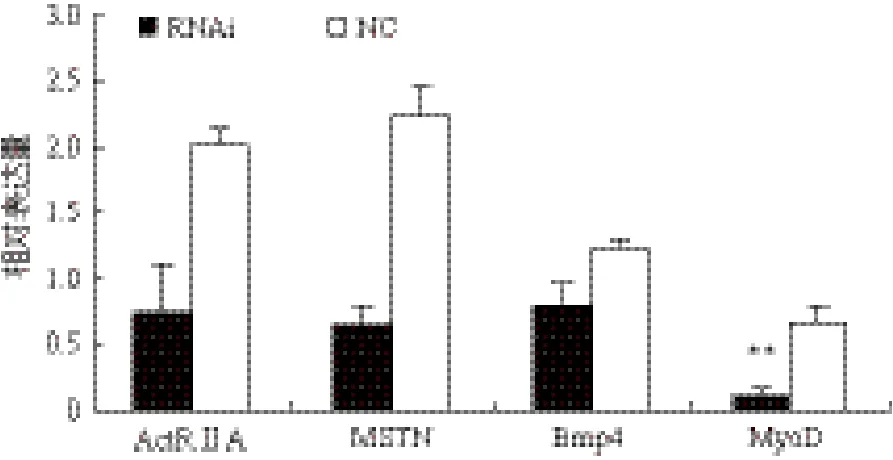
图3 Real-time检测转染前后各基因相对表达量的变化
2.3 转染前后ActRⅡA、MSTN、Bmp4和MyoD基因表达的变化
用Real-time方法检测稳定抑制FST基因表达的成纤维细胞中ActRⅡA、MSTN、Bmp4和MyoD四个基因表达量的变化,结果(图3)显示,与阴性对照组和空白组细胞相比,FST基因表达的干扰使MyoD基因的表达产生了极显著的下调(P<0.01),同时其他3个基因的表达也产生了一定的下调趋势,但差异不显著(P>0.05)。
3 讨论
激活素(activin,ACT)是一种调节组织细胞功能的基本介质,它可以通过借助特异性的受体系统,发挥广泛的生物学作用[9]。激活素若要进入细胞核发挥作用,首先要与Ⅱ型受体(ActivinRⅡA或ActivinRⅡB)结合,在猪胎儿成纤维细胞中,FST的过表达能够使ActivinRⅡA基因的表达量上调[10],而本研究中FST基因的抑制导致了ActivinRⅡA基因表达呈现下调趋势,揭示了二者之间的表达存在正相关的关系。
TGF-β超家族由一类结构和功能相似的多肽生长因子亚家族组成,大量试验结果表明,Follistatin能够通过与TGF-β超家族共有β亚单位与之结合,从而拮抗其生物活性。Myostatin(MSTN)是已知的最强的骨骼肌生长抑制物,骨形态发生蛋白(Bmp4)不仅能诱导骨的形成,同时还对动物生殖系统的生殖发育有重要的调节作用[11]。MSTN和Bmp4都是TGF-β超家族的成员,FST基因的过表达能够引起二者表达量的下调[10],而FST基因抑制表达也同样引起二者表达量出现下调趋势。其具体的相互作用机制还需进一步的研究。
生肌决定因子(MyoD)是脊椎动物成肌过程的主要调控基因,对骨骼肌和肌细胞的形成和分化起重要的调控作用[12]。Matzuk等[13]发现,敲除了FST基因的小鼠出生时肌肉重量减少,这一结果与本研究的结果相符,FST基因的表达抑制使得MyoD的表达出现了极显著的下调,说明除了通过竞争性地结合MSTN 以外,FST对骨骼肌发育的促进作用
还存在更为复杂的调控途径。
在本研究中,FR2-shRNA和FR3-shRNA干扰质粒不仅没有抑制FST基因的表达,还使得FST基因的表达出现了上调趋势。在前人的研究中也出现过这种现象,Myostatin基因沉默导致的双肌牛的肌肉组织中,Myostatin基因表达量高于正常的牛。这种现象被认为机体为了维持该基因的正常表达,反馈性的提高基因表达量导致,具体机制还有待进一步研究。
4 结论
本研究通过RNA干扰技术成功获得了稳定抑制FST基因表达的猪胎儿成纤维细胞株,FST基因表达显著下调,并且导致了ActivinRⅡA、Myostatin、Bmp4和MyoD四个基因表达的变化,并极显著地降低MyoD基因的表达。
[1]Shimasaki S, Koga M, Esch F, et al. Primary structure of the human follistatin precursor and its genomic organization[J]. Proc Natl Acad Sci USA, 1988, 85:4218-4222.
[2]Shimasaki S, Koga M, Esch F, et al. Porcine follistatin gene structure supports two forms of mature follistatin produced by alternative splicing[J]. Biochem Biophys Res Commun, 1988, 152:717-723.
[3]Patel K. Follistatin[J]. Int J Biochem Cell Biol, 1998, 30:1087-1093.
[4]Kondo S, Hashimoto M, Murata EY, et al. Identification of the two types of specific receptor for activin/EDF expressed in Friend Ieukemia and embryonal carcinoma cells[J]. Biochem Biophys Res Commun, 1989, 161:1267-1272.
[5]Shiozaki M, Sakai R, Tabuchi M, et al. Evidence f or the particip ation of endogenous activin-A/erythroid differemtiation factor in the regulation of erythropoiesis[J]. Proc Acad Sci USA, 1992, 82:1553-1556.
[6]Hashimoto M, Nakamura T, lnoue S, et al. Follistatinis developmentally regulated cytokine in neural different iation[J]. Biol Chem, 1992, 267:7203-7206.
[7]Lee SJ, Lee YS, Zimmers TA, et al. Regulation of muscle mass by follistatin and activins[J]. Mol Endocrinol, 2010, 24(10):1998-2008.
[8]Fire A, Xu S, Montgomeny MK, et al. Potent and specific genetic interference by double-stranded RNA inCaenorhabditis elegans[J]. Nature, 1998, 391(6669):806-811.
[9]张超, 罗艳梅, 张家骅, 等.激活素、抑制素及其受体与动物生殖作用的研究进展[J].中国畜牧兽医, 2011, 38(2):115-118.
[10]孙亚蒙, 张冬杰, 张旭, 等.卵泡抑素基因过表达对其通路上相关基因表达的影响[J].中国畜牧兽医, 2013, 40(5):35-40.
[11]Shimasaki S, Moore RK, Erickson GF, et al. The role of bone morphogenetic proteins in ovarian function[J]. Reprod Suppl, 2003, 61:323-337.
[12]Lee H, Habas R, Abate-Shen C. MSX1 cooperates with histone H1b for inhibition of transcription and myogenesis[J]. Science, 2004, 304(5677):1675-1678.
[13]Matzuk MM, Lu N, Vogel H. Multiple defects and perinatal death in mice deficient in follistatin[J]. Nature, 1995, 374:360-363.
(责任编辑 马鑫)
FST-related Genes Expression in FST Gene Knock-down Pig Fetal Fibroblast Cells
Sun Yameng1Zhang Dongjie2Wang Liang2Zhang Xu1Yin Xue1Liu Di1,2
(1. College of Animal Sciences and Technology,Northeast Agricultural University,Harbin 150030;2. Research Institute of Heilongjiang Academy of Agricultural Sciences,Harbin 150086)
In order to obtain FST gene knock-down pig fetal fibroblast cells and investigate the effects of related gene’s expression, the short hairpin RNA eukaryotic expression vectors for FST was constructed and transfected into pig fetal fibroblast cells. After screened with G418, transfected stable cell clones were obtained, and Real-time PCR was used to detect FST-related genes change in gene’s expression. The results showed that in stably transfected cell lines, FST gene expression was significantly inhibited, then resulting in the expression of ActivinRⅡA, Myostatin and Bmp4 downward trend, and the expression of MyoD gene very significantly reduced.
Follistatin(FST) RNA interference Porcine fetal fibroblast cells Related gene
2013-12-02
国家生猪产业体系岗位科学家项目(CARS-36)
孙亚蒙,男,博士研究生,研究方向:动物遗传育种与繁殖;E-mail:symbuster_1986@163.com
刘娣,女,教授,博士生导师,研究方向:动物遗传育种与繁殖;E-mail:liudi1963@163.com

