环介导等温扩增联合横向流动试纸条快速检测创伤弧菌检测方法的建立
王耀焕 王瑞娜 周前进 陈炯
(宁波大学生物化学与分子生物学实验室,宁波 315211)
环介导等温扩增联合横向流动试纸条快速检测创伤弧菌检测方法的建立
王耀焕 王瑞娜 周前进 陈炯
(宁波大学生物化学与分子生物学实验室,宁波 315211)
环介导等温扩增技术(LAMP)与横向流动试纸条(LFD)检测联合应用,建立了一种新的快速、便捷的创伤弧菌检测方法。针对创伤弧菌的外膜蛋白TolC基因设计6条特异性引物和1条异硫氰酸荧光素(FITC)标记的探针。生物素标记的LAMP扩增产物能够特异性地与FITC标记的探针杂交,杂交产物经LFD检测。优化后的扩增温度和时间为63℃反应35 min,加上细菌基因组DNA提取步骤,完成检测仅需要80 min。LAMP-LFD方法可特异性地检出创伤弧菌,对哈维氏弧菌等9种水产品常见病原菌的检测均呈阴性;对纯细菌培养物的检测灵敏度为3.7×102CFU/mL或7.4 CFU/反应,是利用外引物建立的常规PCR检测的100倍。结果表明,该方法能够准确、快速、灵敏地检出创伤弧菌,可应用于创伤弧菌污染的水产品的检测。
创伤弧菌 外膜蛋白TolC基因 环介导等温扩增技术 横向流动试纸条检测
创伤弧菌(Vibrio vulnificus)为革兰氏阴性嗜盐弧菌,普遍存在于江河口和沿海水域环境,鱼类、虾类,以及贝母类等为主要易感水生动物[1]。该菌是人兽共患病的重要病原,人通常因生食受污染的海产品,或皮肤伤口接触受污染的海水或海洋动物而感染。感染该菌可导致患者出现原发性败血症、创伤感染、急性胃肠炎和蜂窝织炎等临床症状[2,3]。每年美国与海产品相关的死亡事件中95%是由于感染了创伤弧菌[4,5],众多水产品中,牡蛎是创伤弧菌最重要的传染源,为防治该病,加利福尼亚州特
地于2003年颁布法令禁止生牡蛎销售,取得明显防治效果[6]。在我国,创伤弧菌感染多发生于沿海地区,被列为食品污染源八大高危微生物之一[7-9]。因此,建立一种快速、准确而又适用于临床的检测方法对于有效诊断创伤弧菌感染,监测水产品污染具有重要的实际应用价值。
传统的创伤弧菌诊断主要通过病原分离与生化鉴定完成,但其存在细菌培养繁琐,检测周期长,不易鉴别相近物种或亚型等缺点[10]。随着分子生物学检测技术的发展,以溶血素基因(Hemolysin)[11]、DNA回旋酶B亚基(gyrB)[12,13]、toxR基因[14]、RNA聚合酶σ亚基因子S(rpoS)[15]等为靶标建立的常规PCR或实时荧光定量PCR(RT-qPCR)技术已成功应用于创伤弧菌的实验室诊断,具有灵敏度高,检测时间短等优点,但该方法必须配备昂贵的仪器设备,需专门的操作人员。
环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)是由日本学者Notomi发明的一种新式恒温核酸扩增技术[16],相对于PCR相关检测技术,具有检测时间更短,仪器依赖性小等优点,具有应用于现场疫源地检测的巨大潜力。LAMP反应产物可通过琼脂糖凝胶的方法进行判定,但该方法存在操作过程易污染,易出现假阳性的缺点。LAMP与横向流试纸(Lateral flow dipstick,LFD)技术联用(LAMP-LFD),使FITC标记的探针与生物素标记的LAMP扩增产物进行特异性杂交,不仅可避免非特异性扩增引起的假阳性,大幅提高检测灵敏度,还能避免因琼脂糖凝胶电泳等检测手段引起的体系污染问题[17,18]。该方法亦无需特殊设备,不需与EB等有毒试剂接触,操作更加便捷和安全。
本研究根据创伤弧菌外膜蛋白TolC基因的保守性区域设计特异性引物和探针,优化反应条件,建立LAMP-LFD技术,旨在将该方法应用于水产品中创伤弧菌的检测。
1 材料与方法
1.1 材料
创伤弧菌(Vibrio vulnificusATCC 27562)、哈维氏弧菌(Vibrio harveyiATCC 33866)、河流弧菌(Vibrio fluvialisATCC 33809)购自中科院水生生物研究所;副溶血弧菌(Vibrio parahaemolyticusATCC 33847)由浙江省疾控中心惠赠;轮虫弧菌(Vibrio rotiferianusDSM 17186T)由宁波大学海洋学院张德民教授惠赠;溶藻弧菌(Vibrio alginolyticusATCC 17749)、鳗弧菌香鱼分离株(Vibrio anguillarumayu-H080701)[19]、嗜水气单胞菌(Aeromonas hydrophilaAh0201)由本实验室保存;金黄色葡萄球菌(Staphylococcus aureusATCC 6538)、单增李斯特菌(Listeria monocytogenesATCC 19115)购自广东省微生物菌种保藏中心。
1.2 方法
1.2.1 细菌培养和基因组DNA提取 试验中使用的弧菌划线接种于TCBS固体培养基上,28℃过夜培养后,挑取单菌落于碱性蛋白胨水中震荡培养至所需浓度;嗜水气单胞菌、金黄色葡萄球菌,以及单增李斯特菌划线接种于BHI固体培养基上,37℃过夜培养后,挑取单菌落于LB或BHI培养基中震荡培养至所需浓度。
细菌基因组DNA的提取采用水煮法完成,主要步骤为:取1 mL细菌的液体培养悬液于1.5 mL离心管中,12 000 r/min离心2 min,弃上清;使用100 μL细菌裂解液(Tris-HCl 0.1 mol/L,蛋白酶K 0.2 μg/μL,Triton X-100 2.0%)充分悬浮细菌,沸水浴10 min,立即冰浴7 min;重复上一步操作1次;12 000 r/min离心2 min,取上清用作LAMP和PCR扩增的模板,-30℃贮存备用。
1.2.2 引物设计 根据NCBI上公布的创伤弧菌外膜蛋白TolC基因(登录号:DQ296643),设计用于LAMP扩增的外引物TolC-F3、TolC-B3,内引物TolC-FIP、TolC-BIP,以及环引物TolC-LF、TolCLB等6条特异性引物,同时合成TolC-HP探针1条,用于LFD的杂交试验(表1,图1)。在内引物TolC-FIP的5'端标记生物素,在TolC-HP的5'端标记异硫氰酸荧光素。以上引物和探针由英潍捷基(上海)贸易有限公司合成。其中,外引物TolC-F3、TolC-B3同时用作PCR扩增的特异性引物,扩增的预期片段大小约为308 bp。
1.2.3 LAMP扩增条件的确立 选用创伤弧菌基因组DNA的2个浓度(经平板计数法测定,较高模板
浓度相当于3.7×107CFU/mL,较低模板浓度相当于3.7×104CFU/mL)作为模板优化扩增条件。LAMP反应体系为25 μL,包括Tris-HCl 20 mmol/L(pH 8.8),MgSO46.5 mmol/L,KCl 10 mmol/L,(NH4)2SO410 mmol/L,Triton X-100 0.1%,甜菜碱 1.6 mol/L,dNTPs 1.4 mmol/L,外引物TolC-F3和TolC-B3各0.2 μmol/L,内引物TolC-FIP和TolC-BIP各1.6 μmol/L,环引物TolC-LF和TolC-LB各0.4 μmol/L,Bst DNA聚合酶(New England BioLabs,美国)8 U,创伤弧菌基因组DNA模板 2 μL。阴性对照不加任何模板DNA。反应混合物在一定温度下温育后,经80℃热激5 min终止反应,利用1.5%的琼脂糖凝胶电泳检测产物。分别以上述较高浓度和较低浓度的基因组DNA为模板,选择10、20、35、50和65 min作为扩增反应时间65℃恒温下进行扩增,根据扩增效果确定最佳反应时间;分别在61、62、63、64 和65℃下进行温育至筛选的最佳反应时间,根据扩增效果确定适宜的反应温度。

表1 根据创伤弧菌外膜蛋白TolC基因序列设计的LAMP-LFD扩增引物序列和探针

图1 创伤弧菌外膜蛋白TolC基因的LAMP-LFD引物序列和探针设计示意图
1.2.4 利用横向流动试纸条(LFD)检测 检测所用试纸条购自Milennia Biotec GmbH(Milenia GenLine HybriDetect by Milenia Biotec GmbH,Germany,http://www.milenia-biotec.de/),可通过其检测线上标记的生物素抗体与生物素标记的LAMP扩增产物特异性结合完成检测。利用优化后的LAMP反应体系,使用经生物素标记的内引物TolC-FIP-biotin进行LAMP扩增反应;反应结束时不经过终止反应,而将20 pmol的FITC标记的DNA探针TolC-HP加入到反应液中,63℃杂交5 min;取5 μL杂交液加入到100 μL buffer中混匀;将LFD试纸条浸入buffer溶液中3-5 min,肉眼判断结果。
1.2.5 LAMP-LFD的特异性试验 选择水产品中的常见病原菌用于LAMP-LFD的特异性试验,除创伤弧菌外,还包括哈维氏弧菌、河流弧菌、副溶血弧菌、轮虫弧菌、溶藻弧菌、鳗弧菌、嗜水气单胞菌、金黄色葡萄球菌及单增李斯特菌等9种。分别利用1.5%的琼脂糖凝胶电泳和LFD检测扩增结果。
1.2.6 LAMP-LFD的灵敏度测定 将创伤弧菌的原始菌液(相当于3.7×109CFU/mL)进行连续10倍浓度梯度稀释,按水煮法提取基因组DNA,并以此为模板,利用优化的LAMP反应体系进行扩增。分
别利用1.5%琼脂糖凝胶电泳和LFD检测扩增结果。同时,在相同模板浓度下,以外引物TolC-F3和TolC-B3为特异性引物,进行PCR扩增。PCR反应体系为25 μL,包括:10×PCR buffer 2.5 μL,TaqDNA 聚合酶(5 U/μL)(TaKaRa,日本)0.15 μL,dNTPs(2.5 mmol/μL)2 μL,TolC-F3(10 pmol/μL)1 μL,TolC-B3(10 pmol/μL)1 μL,基因组DNA模板 2 μL。PCR反应程序:94℃ 3 min;94℃ 30 s,54℃ 30 s,72℃ 30 s,30个循环;72℃ 10 min。扩增产物利用2%琼脂糖凝胶电泳检测。
1.2.7 LAMP-LFD的重复性试验 重新挑取创伤弧菌的单菌落,培养后获取新鲜创伤弧菌原始菌液,经平板计数后,连续10倍浓度梯度稀释至LAMPLFD检测的最低浓度,平行制备3个样品,按水煮法提取基因组DNA,并以此为模板,利用优化的LAMP反应体系进行扩增,验证该方法的可重复性。
2 结果
2.1 LAMP扩增条件的确立
以较高浓度基因组DNA(3.7×107CFU/mL)为模板65℃恒温扩增时,反应10 min即可检测到明显扩增;反应20 min,扩增产物浓度几乎达到最高值,延长反应时间,扩增产物浓度不再出现明显提高(图2-A)。以较低浓度基因组DNA(3.7×104CFU/mL)为模板65℃恒温扩增时,反应10 min未能检测到明显扩增;反应20 min,可检测到明显扩增;反应35 min,扩增产物浓度几乎达到最高值,延长反应时间,扩增产物浓度不再出现明显提高(图2-B)。为保证样品检测时,在较低模板浓度下仍尽可能地检出病原,选择LAMP扩增的最佳反应时间为35 min。
为确定最适反应温度,以较低浓度基因组DNA(3.7×104CFU/mL)为模板,分别使用61、62、63、64和65℃ 5个不同温度进行恒温扩增35 min。5个反应温度下均检测到明显的特异性扩增,而不添加任何DNA模板的反应管中未检测到扩增,反应温度为63℃时,特异性扩增中出现的梯形条带最为清晰(图3),因此选定63℃为最适反应温度。最终确定63℃反应35 min为最适反应条件。
2.2 LAMP-LFD检测与特异性试验结果
按优化的LAMP反应体系,换用生物素标记的内引物TolC-FIP-biotin进行LAMP扩增反应。反应产物经1.5%琼脂糖凝胶电泳检测发现,以创伤弧菌基因组DNA为模板的反应管可出现特征性的梯形条带,其他9株病原菌的反应管中未见明显扩增(图4-A)。反应产物经LFD检测发现,以创伤弧菌基因组DNA为模板的反应产物可使试纸条的检测线位置出现明显的阳性条带,其他9株病原菌的反应产物在试纸条的检测线位置未出现条带(图4-B)。
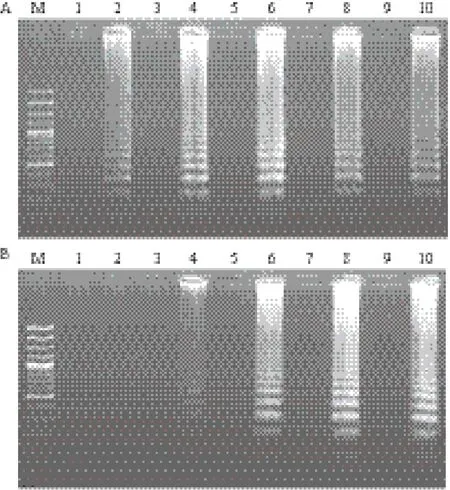
图2 LAMP反应时间的确立

图3 LAMP反应温度的确立

图4 LAMP(A)和LAMP-LFD(B)特异性分析
2.3 LAMP-LFD的灵敏度测定
创伤弧菌原始菌液(相当于3.7×109CFU/mL)进行连续的10倍浓度梯度稀释后,分别采用水煮方法提取其基因组DNA。以不同浓度的基因组DNA为模板进行的LAMP-LFD结果显示,反应产物经1.5%琼脂糖凝胶电泳检测的最低模板浓度为原始浓度的10-7倍,即3.7×102CFU/mL或7.4 CFU/反应(图5-A);反应产物经试纸条(LFD)检测的最低模板浓度与电泳检测结果一致,即3.7×102CFU/mL或7.4 CFU/反应(图5-B)。而以同批次的基因组DNA为模板进行PCR扩增,可检测的最低模板浓度为原始浓度的10-5,即3.7×104CFU/mL或740 CFU/反应(图5-C)。因此,LAMP-LFD方法的灵敏度是利用外引物TolC-F3、TolC-B3建立的常规PCR方法的100倍。
2.4 LAMP-LFD的重复性分析
获取3个新鲜的创伤弧菌原始菌液样品,经平板计数后,连续的10倍梯度稀释至最低检测浓度(约为3.7×102CFU/mL),利用水煮方法提取基因组DNA,以此为模板进行LAMP-LFD扩增,反应产物经1.5%琼脂糖凝胶电泳和LFD检测均可获得明显的阳性结果(图6),说明该方法可重复,稳定性好。

图5 LAMP(A)、LAMP-LFD(B)和PCR(C)检测的灵敏度比较
3 讨论
创伤弧菌属于沿海海洋环境中的自然菌群之一,海水、海洋沉积物和各种水产品中均可分离获得,尤以牡蛎感染率最高,由于该病原可感染人,导致患者出现严重的原发性败血症和坏死性创伤感染,因此建立快速、准确的检测技术,有效检测海产品中创伤弧菌的污染具有重要的公共卫生学意义。本研究选择创伤弧菌外膜蛋白TolC基因作为检测靶标,成功建立了LAMP-LFD技术。从提取细菌基因组DNA到结果判读,整个检测过程仅需80 min,包括扩增反应35 min,扩增产物LFD显色10 min。
基于分子生物学的检测手段中,常规PCR技
术最早应用于创伤弧菌检测[11];依赖于TaqMan 探针的RT-qPCR技术亦应用于创伤弧菌的实验室诊断[14,15]。这些技术均需以较为昂贵的仪器设备为依托,尤其RT-qPCR技术对仪器设备、试剂,甚至操作环境要求较高,必须由专业人员操作,难以在多数基层检测机构或现场疫源地推广。LAMP检测技术具有设备依赖性小、特异性和灵敏度高等优点,已广泛应用于水产疾病检测[20-23]。在此基础上发展起来的LAMP-LFD技术,可有效避免因LAMP非特异性扩增引起的假阳性问题,使得检测结果更加准确可信,已得到越来越多科技工作者的青睐[17,18,24,25]。本研究建立的LAMP-LFD技术可检出的创伤弧菌最低浓度为3.7×102CFU/mL,即7.4 CFU/反应,检测灵敏度是利用外引物TolC-F3、TolC-B3建立的常规PCR方法的100倍。Han等[26]以创伤弧菌的溶血素vvhA基因作为检测靶标,建立了可特异性检测创伤弧菌的LAMP方法,灵敏度达到了20 CFU/mL;Hossain等[27]针对groEL基因建立了可同时检测创伤弧菌和霍乱弧菌的双重PCR技术,针对创伤弧菌的检测灵敏度达到了50 CFU/反应。本研究利用LFD法的检测灵敏度与琼脂糖凝胶电泳分析的结果一致,但LAMP-LFD法可在扩增反应结果后的10 min内完成结果判断,简化了检测流程,而且能够避免因电泳检测引起的体系污染问题。特异性试验表明,该方法能特异性地检测创伤弧菌,而对哈维氏弧菌等其他常见水产病原菌的检测呈阴性。

图6 LAMP(A)和LAMP-LFD(B)的重复性试验
4 结论
以创伤弧菌外膜蛋白TolC基因为靶标建立的LAMP-LFD技术,能够快速、准确地检测创伤弧菌,检测灵敏度达到7.4 CFU/反应,仪器需求简单,可满足基层检测机构和现场疫源地检测的需要。
[1] Jones MK, Oliver JD.Vibrio vulnificus:disease and pathogenesis[J]. Infection and Immunity, 2009, 77:1723-1733.
[2] Daniels NA.Vibrio vulnificusoysters:pearls and perils[J]. Clin Infect Dis, 2011, 52:788-792.
[3] Dechet AM, Yu PA, Koram N, Painter J. NonfoodborneVibrio infections:an important cause of morbidity and mortality in the United States, 1997-2006[J]. Clin Infect Dis, 2008, 46:970-976.
[4] CDC.Vibrio vulnificus. National center for emerging and zoonotic infectious diseases, 2009.(Retrieved on 20 of May from http:// www.cdc.gov/nczved/ divisions/dfbmd/diseases/vibriov/).
[5] Mead PS, Slutsker L, Griffin PM, Tauxe RV. Food-related illness and death in the united states reply to dr. hedberg[J]. Emerg Infect Dis, 1999, 5:841-842.
[6] Vugia DJ, Tabnak F, Newton AE, et al. Impact of 2003 state regulation on raw oyster-associatedVibrio vulnificusillnesses and deaths, California, USA[J]. Emerg Infect Dis, 2013, 19:1276-1280.
[7] 马骢, 郭建巍, 郝秀红, 等. 中国海域分离的创伤弧菌的致病性及其对抗生素的敏感性研究[J]. 第四军医大学学报, 2009, 30(6):493-496.
[8] 孙智夫, 翁永夫, 耿晓冬, 谢优凤. 舟山市市售生食海产品中创伤弧菌污染现状研究[J]. 中国预防医学杂志, 2013, 14(3):179-182.
[9] 朱海明, 严纪文, 宋曼丹, 等. 广东省部分海产品中创伤弧菌的污染监测[J]. 华南预防医学, 2011, 37(4):78-80.
[10] O’Hara CM, Sowers EG, Bopp CA, et al. Accuracy of six
commercially available systems for identification of members of the family vibrionaceae[J]. J Clin Microbiol, 2003, 41:5654-5659.
[11] Brauns LA, Hudson MC, Oliver JD. Use of the polymerase chain reaction in detection of culturable and nonculturableVibrio vulnificuscells[J]. Appl Environ Microbiol, 1991, 57:2651-2655.
[12] Kumar HS, Parvathi A, Karunasagar I. A gyrB-based PCR for the detection ofVibrio vulnificusand its application for direct detection of this pathogen in oyster enrichment broths[J]. Int J Food Microbiol, 2006, 111:216-220.
[13] Parvathi A, Kumar HS, Karunasagar I. Study of the occurrence ofVibrio vulnificusin oysters in India by polymerase chain reaction(PCR)and heterogeneity amongV. vulnificusby randomly amplified polymorphic DNA PCR and gyrB sequence analysis[J]. Environ Microbiol, 2005, 7:995-1002.
[14] Takahashi H, Hara-Kudo Y, Miyasaka J, et al. Development of a quantitative real-time polymerase chain reaction targeted to the toxR for detection ofVibrio vulnificus[J]. J Microbiol Methods, 2005, 61:77-85.
[15] Kim DG, Ahn SH, Kim LH, et al. Application of the rpoS gene for species-specific detection ofVibrio vulnificusby real-time PCR[J]. J Microbiol Biotechnol, 2008, 18:1841-1847.
[16] Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Res, 2000, 28:E63.
[17] Ding WC, Chen J, Shi YH, et al. Rapid and sensitive detection of infectious spleen and kidney necrosis virus by loop-mediated isothermal amplification combined with a lateral flow dipstick[J]. Arch Virol, 2010, 155:385-389.
[18] 董培培, 李长红, 丁文超, 等. 环介导等温扩增技术与横向流动试纸条法快速检测鳗利斯顿氏菌的研究[J]. 水产科学, 2011, 30(2):63-68.
[19] 李长红, 陈炯, 史雨红, 李明云. 宁海地区香鱼弧菌病病原菌鉴定[J]. 微生物学报, 2009, 49(7):931-937.
[20] 丁文超, 胡健饶, 史雨红, 等. 环介导恒温扩增技术快速检测溶藻弧菌[J]. 分子细胞生物学报, 2009, 42(1):70-76.
[21] 李明云, 丁文超, 陈炯, 史雨红. 环介导恒温扩增技术快速检测对虾白斑综合征病毒方法的建立[J]. 农业生物技术学报, 2011, 19(1):186-190.
[22] 彭帅, 石磊. 环介导恒温扩增法快速检测海产品中的副溶血弧菌[J]. 生物技术通报, 2011(2):184-186.
[23] 张金凤, 曾令兵, 张辉, 等. 草鱼呼肠孤病毒逆转录环介导等温扩增(RT-LAMP)检测方法的建立[J]. 中国水产科学, 2013, 20(1):129-136.
[24] Kaewphinit T, Arunrut N, Kiatpathomchai W, et al. Detection ofMycobacterium tuberculosisby using loop-mediated isothermal amplification combined with a lateral flow dipstick in clinical samples[J]. Biomed Res Int, 2013, 2013:926230. doi:10.1155/2013/926230.
[25] Khunthong S, Jaroenram W, Arunrut N, et al. Rapid and sensitive detection ofshrimp yellow head virusby loop-mediated isothermal amplification combined with a lateral flow dipstick[J]. J Virol Methods, 2013, 188:51-56.
[26] Han FF, Ge BL. Evaluation of a loop-mediated isothermal amplification assay for detectingVibrio vulnificusin Raw Oysters. Foodborne Pathog Dis, 2008, 5(3):311-320.
[27] Hossain MT, Kim YR, Kim EY, et al. Detection ofVibrio choleraeandVibrio vulnificusby duplex PCR specific to the groEL gene[J]. Fish Sci, 2013, 79:335-340.
(责任编辑 狄艳红)
Rapid Detection of Vibrio vulnificus by Loop-mediated Isothermal Amplification Combined with Lateral Flow Dipstick Assay
Wang Yaohuan Wang Ruina Zhou Qianjin Chen Jiong
(Laboratory of Biochemistry and Molecular Biology,Ningbo University,Ningbo 315211)
A novel and rapid loop-mediated isothermal amplification(LAMP)combined with chromatographic lateral flow dipstick(LFD)assay was developed to detect Vibrio vulnificus. A set of six primers and a fluorescein isothiocyanate(FITC)-labeled probe that recognized V. vulnificus outer membrane protein TolC gene were designed. Biotinylated LAMP amplicons were hybridized exclusively with the FITC-labeled probe and detected by LFD assay. The assay was optimized and could detect V. vulnificus by incubation at 63℃ for only 35 min, and the whole detection procedure from extraction of bacterial genomic DNA to the visualization of the amplicons by LFD last 80 min. V. vulnificus could be accurately detected by LAMP-LFD, and no amplification could be observed when another 9 bacterial genomic DNA were used. The sensitivity for V. vulnificus detection in pure culture was 3.7×102CFU/mL or equivalent to 7.4 CFU per reaction, which is 100 times higher than that of PCR assay. The results indicate that LAMP-LFD is an accurate, rapid and sensitive tool for V. vulnificus detection and can be used for detection of V. vulnificus in contaminated aquatic foods.
Vibrio vulnificus Outer membrane protein TolC gene Loop-mediated isothermal amplification Lateral flow dipstick assay detection
2013-10-23
国家高技术研究发展计划(“863”计划)(2012AA020101,2012AA092001),宁波大学学科项目(xk11341)
王耀焕,男,研究方向:生物技术;E-mail:wangyaohuan5949@163.com
周前进,男,博士,讲师,研究方向:动物疫病诊断技术;E-mail:mumu2325@163.com

