白花败酱单宁的提取工艺研究
范小曼,金文静,龙薇运,叶 璐,朱加进,*
(1.浙江大学食品科学与营养系,浙江杭州310058;2.浙江海洋学院杭州校区,浙江杭州311231;3.浙江大学馥莉食品研究院,浙江杭州310058)
白花败酱单宁的提取工艺研究
范小曼1,3,金文静2,龙薇运1,3,叶 璐1,3,朱加进1,3,*
(1.浙江大学食品科学与营养系,浙江杭州310058;2.浙江海洋学院杭州校区,浙江杭州311231;3.浙江大学馥莉食品研究院,浙江杭州310058)
采用有机溶剂浸提法与超声波提取法对白花败酱中单宁的提取工艺进行了比较研究,通过单因素及正交实验优化了提取工艺条件。结果表明:超声波提取法提取率较高,且耗时少。当超声功率为80W、料液比为1∶60(w/v)、提取时间为60min时具有最大提取率4.648%。
白花败酱,单宁,提取
单宁,又称鞣质,是植物界一类结构复杂的多元酚类化合物。根据化学结构和性质,可以分为三大类,即水解单宁、缩合单宁和新型单宁[1]。约超过75%以上的中草药中含有单宁类化合物,所以大多数中药复方汤剂和中成药中都含有单宁。过去人们常把单宁作为无效成分去除。由于分离技术的不断提高,对单宁单体的提纯、分离和结构鉴定有了很大的进展,为研究其生物活性提供了可能性。王立峰等[2]对采用有机溶剂提取法和响应曲面法对菜籽壳中的单宁进行了提取工艺的研究,在最优条件下,其提取量最大可达9.15mg/g。侯万伟等[3]对蚕豆种皮中单宁进行了有机溶剂提取实验,确定其最佳提取工艺条件,在最优条件下,蚕豆种皮中单宁提取量为1.960mg/g。
白花败酱为败酱科,多年生草本,高达1.5m,有臭酱气,为清热解毒类,临床上应用非常广泛。谢颖、彭金咏等[4]采用超临界流体萃取法提取白花败酱中的挥发性成分,对其化学组成和抗氧化能力进行了研究,为研究其生理功能提供理论基础。朱加进等[5]研究发现,采用有机溶剂浸提法,以纯丙酮为提取剂,白花败酱中单宁的提取率(相对于被提取的白花败酱质量)可达3.60%,但目前对于其单宁含量还无明确结果。
本文以丙酮水溶液作为提取剂,采用有机溶剂浸提法与超声波提取法研究白花败酱单宁的最佳提取工艺条件,以提高其提取率,为后续研究其组成及活性成分提供条件。
1 材料与方法
1.1 材料与仪器
新鲜白花败酱 采摘自杭州郊县;没食子酸AR 江苏洪声化工厂;磷钼酸AR 国药集团化学试剂有限公司;钨酸钠AR 中国医药(集团)上海化学试剂公司;饱和碳酸钠溶液 称取100g Na2CO3,加250mL水到500mL容量瓶中,充分摇动促其溶解,然后定容,储于带橡皮塞的瓶中备用;Folin-Denis试剂 称取钨酸钠25g,磷钼酸5g,置于500mL锥形瓶中,加375mL水溶解,再加85%磷酸25mL,连接冷凝管,在沸水浴中加热回流2h,冷却后用水稀释至500mL。
752紫外光栅分光光度计 上海第三分析仪器厂;数显恒温水浴锅 上海博迅实业有限公司医疗设备厂;超声波清洗器 上海之信仪器有限公司。
1.2 实验方法
1.2.1 白花败酱单宁含量的测定[6]
1.2.1.1 标准曲线的制作 称取1.0g没食子酸,溶于水中,于500mL容量瓶中稀释至刻度,摇匀。吸取含没食子酸2mg/mL的标准溶液0、1.0、3.0、5.0、10.0、15.0mL,分别放入100mL比色管中,用水稀释至50mL,然后加入2mL Folin-Denis试剂,摇匀,5min后,加10mL饱和碳酸钠溶液,摇匀,溶液即显蓝。放置30min后,用分光光度计于760nm(1cm比色皿)处测定其吸光度。同时以蒸馏水做空白调零。以吸光值为横坐标,比色皿中没食子酸的浓度为纵坐标,绘制标准曲线。
1.2.1.2 提取液中单宁含量的测定 称取试样1.0g(平行3份),放入100mL容量瓶中,加入溶剂,按实验设计进行提取,冷却后定容至刻度,摇匀,过滤。若滤液不清亮,再过滤一次。精确吸取滤液1mL于100mL的锥形瓶中,加水49mL,然后加入2mL Folin-Denis试剂,摇匀,5min后加10mL饱和碳酸钠溶液,摇匀,溶液即显蓝。放置30min,用分光光度计于760nm处测定其吸光值。根据回归方程计算提取液单宁的浓度,按下式计算出白花败酱单宁的提取率:
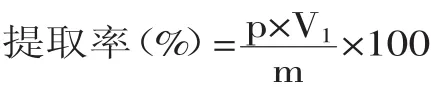
式中,p为从标准曲线查得的提取液单宁含量,mg/mL;V1为提取液总体积,mL;m为称取的白花败酱干粉质量,mg。
1.2.2 有机溶剂浸提法单因素实验 新鲜白花败酱,除去杂质,洗净,在100℃烘箱中烘干,粉碎,备用。
1.2.2.1 丙酮浓度对提取率的影响 称取预先粉碎的白花败酱粉1.0g 5份,放入100mL容量瓶中,按1∶60料液比,分别加入30%、40%、50%、60%、70%丙酮水溶液,并同时每份做3个平行,置于60℃水浴中,浸提2h,冷却后定容,过滤后取滤液进行Folin-Denis比色实验,确定滤液中单宁浓度,计算出白花败酱单宁的提取率。
1.2.2.2 料液比对提取率的影响 以50%丙酮水溶液为提取剂,置于60℃水浴中浸提2h,考察不同料液比1∶40、1∶50、1∶60、1∶70、1∶80的提取率。
1.2.2.3 提取温度对提取率的影响 以50%丙酮水溶液为提取剂,料液比1∶60,浸提2h,考察不同提取温度40、50、60、70、80℃的提取率。
1.2.2.4 提取时间对提取率的影响 以50%丙酮水溶液为提取剂,料液比1∶60加入,置于60℃水浴中,考察不同提取时间0.5、1、1.5、2、2.5h的提取率。
1.2.3 正交实验 根据单因素实验确定的范围,料液比、提取温度和提取时间作为考察的3因素,每因素3水平,以白花败酱单宁提取率为指标,用L9(34)正交表安排实验,因素水平表见表1。
1.2.4 超声波提取法单因素实验
1.2.4.1 丙酮浓度对提取率的影响 称取预先粉碎的白花败酱粉1.0g 5份,放入100mL容量瓶中,按1∶60料液比,分别加入30%、40%、50%、60%、70%丙酮水溶液,并同时每份做3个平行,置于超声波清洗器中,调节功率至80W,浸提50min,冷却后定容,过滤后取滤液进行Folin-Denis比色实验,确定滤液中单宁浓度,计算出白花败酱单宁的提取率。

表1 有机溶剂浸提法正交实验因素水平表Table 1 Orthogonal factors table of organic solvent extraction
1.2.4.2 料液比对提取率的影响 以50%丙酮水溶液为提取剂,以功率80W提取50min,考察不同料液比1∶40、1∶50、1∶60、1∶70、1∶80对提取率的影响。
1.2.4.3 提取时间对提取率的影响 以50%丙酮水溶液为提取剂,料液比1∶60,功率为80W考察不同提取时间30、40、50、60、70min对提取率的影响。
1.2.4.4 超声功率对提取率的影响 以50%丙酮水溶液为提取剂,按料液比1∶60超声提取50min,考察不同超声功率20、40、60、80、100W对提取率的影响。
1.2.5 超声波提取法正交实验 根据单因素实验确定的范围,料液比、提取时间和超声功率作为考察的3因素,每因素3水平,以白花败酱单宁提取率为指标,用L9(34)正交表安排实验(见表2),得出最佳提取条件。
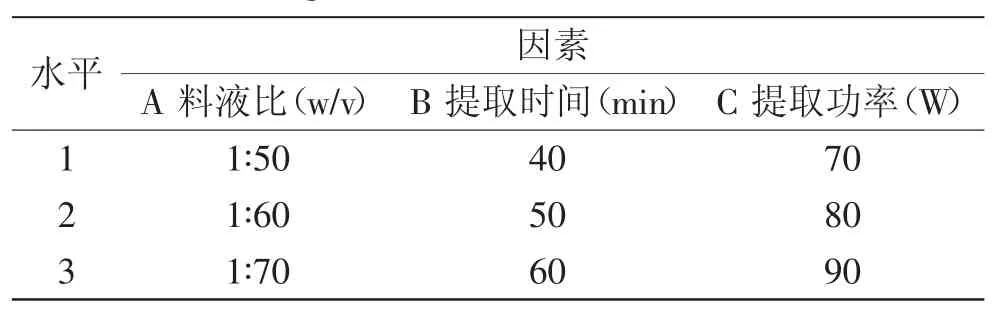
表2 超声波提取法正交实验因素水平表Table 2 Orthogonal factors table of ultrasonic extraction
2 结果与分析
2.1 白花败酱中单宁含量的测定
标准曲线见图1。y=1.2609x-0.0009,R2=0.9971。
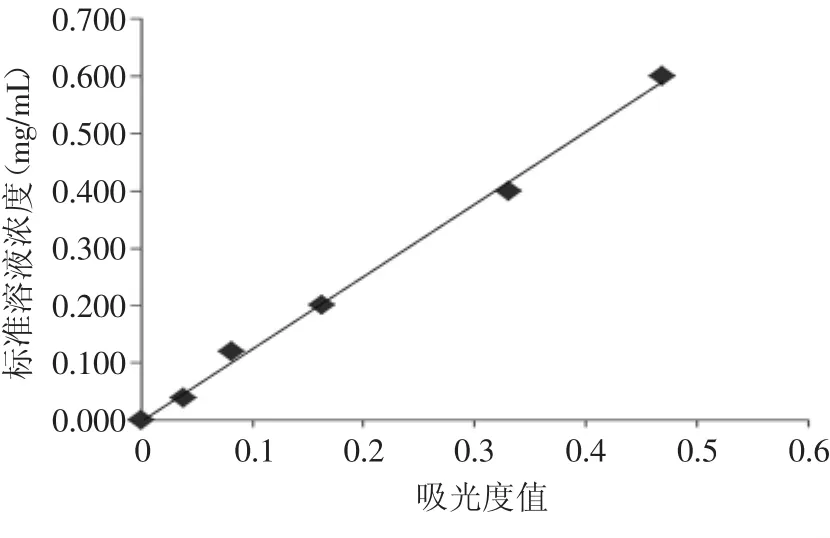
图1 单宁含量标准曲线Fig.1 The standard curve of tannin content
2.2 有机溶剂提取法工艺条件的研究
2.2.1 单因素实验
2.2.1.1 丙酮浓度对提取率的影响 不同丙酮浓度对白花败酱单宁提取率的影响见图2。
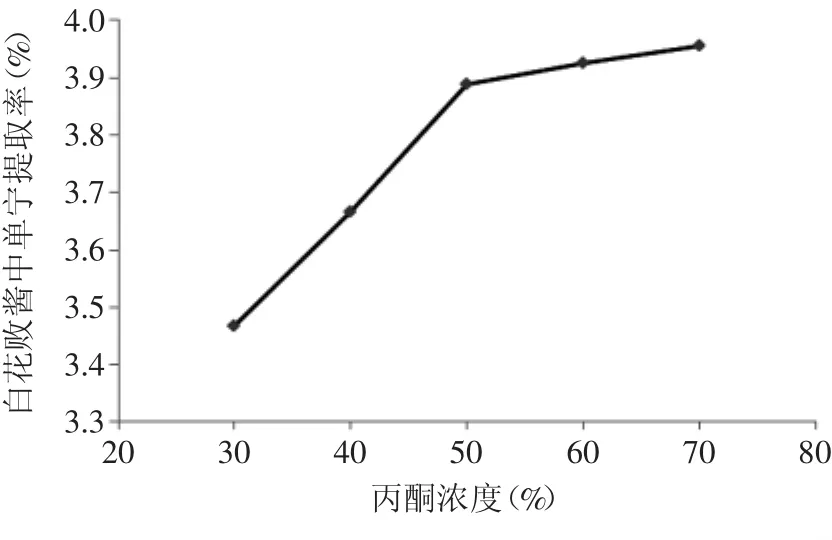
图2 丙酮浓度对单宁提取率的影响Fig.2 Effect of acetone concentration on tannin extraction rate
由图2可以看出,白花败酱中单宁的提取率随丙酮浓度的升高而增大,当丙酮浓度为50%时,再增大其浓度,单宁的提取率只略有上升,其可能原因是50%丙酮浓度已能溶解白花败酱中的大部分单宁,考虑到经济原因和成本问题,再提高丙酮浓度意义不大。因此,以50%丙酮为提取剂较为合适。
2.2.1.2 料液比对提取率的影响 不同料液比对白花败酱中单宁的提取率的影响见图3。
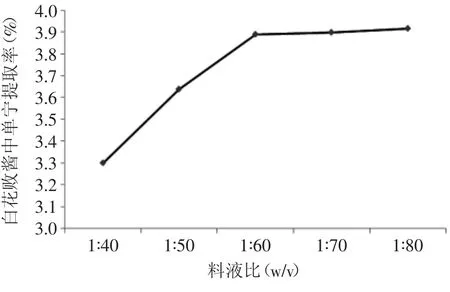
图3 料液比对单宁提取率的影响Fig.3 Effect of material-solution ratio on tannin extraction rate
由图3可以看出,料液比为1∶40时,随料液比的增大,提取率显著提高,当料液比为1∶60时,再增大料液比,白花败酱中单宁的提取率没有明显上升,综合考虑提取剂用量以及单宁的提取率和消耗能量,认为,料液比为1∶60较为合适。
2.2.1.3 提取温度对提取率的影响 不同提取温度对白花败酱中单宁的提取率的影响见图4。
由图4可以看出,白花败酱中单宁的提取率随着提取温度的升高而增大,当温度达到60℃时,随着温度升高,提取率略有上升,再升高温度,单宁的提取率下降。这是由于温度过高破坏了单宁的结构从而影响了提取率。因此,白花败酱中单宁的提取温度60℃左右较为合适。
2.2.1.4 提取时间对提取率的影响 不同提取时间对白花败酱中单宁的提取率的影响见图5。
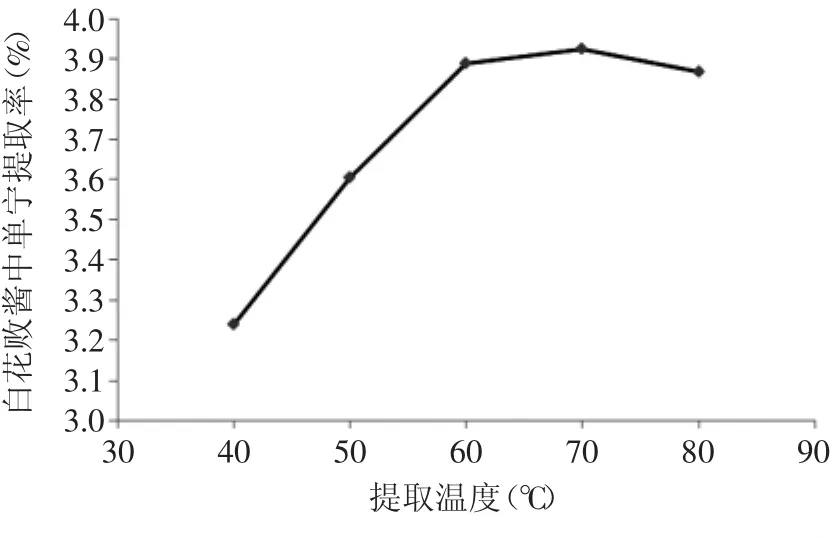
图4 提取温度对单宁提取率的影响Fig.4 Effect of extraction temperature on tannin extraction rate
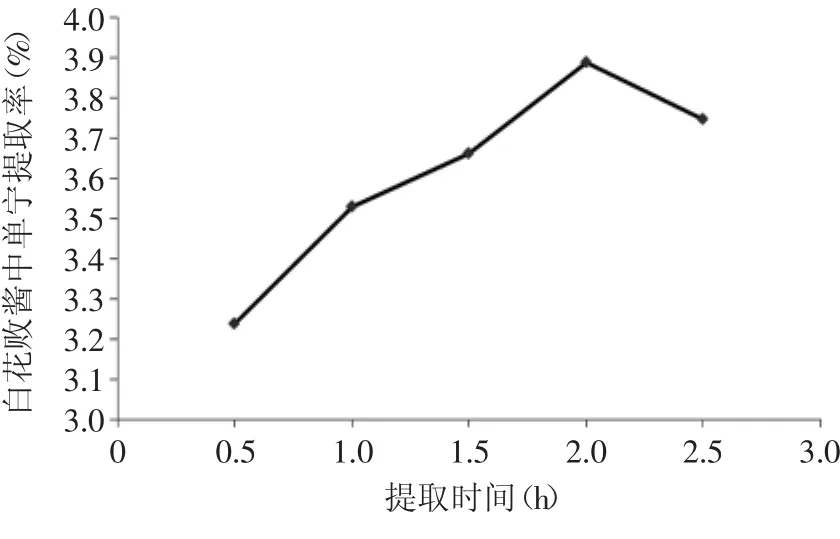
图5 提取时间对单宁提取率的影响Fig.5 Effect of extraction time on tannin extraction rate
由图5可以看出,在2.0h的白花败酱中单宁的提取率达到最高。这是因为随着提取时间的加长可以使单宁充分溶解于溶剂中,但时间过长会因为温度的影响而破坏单宁的分子结构。因此提取时间以2.0h较为适宜。
2.2.2 有机溶剂提取法正交实验结果分析 根据表3可以看出,提取时间(A)、提取温度(B)、料液比(C)三个因素中,料液比对提取率的影响最大,提取时间的影响最小。最优水平为A2B2C3,即当料液比为1∶70、提取温度为60℃、提取时间为120min时,白花败酱单宁有最大提取率3.897%。
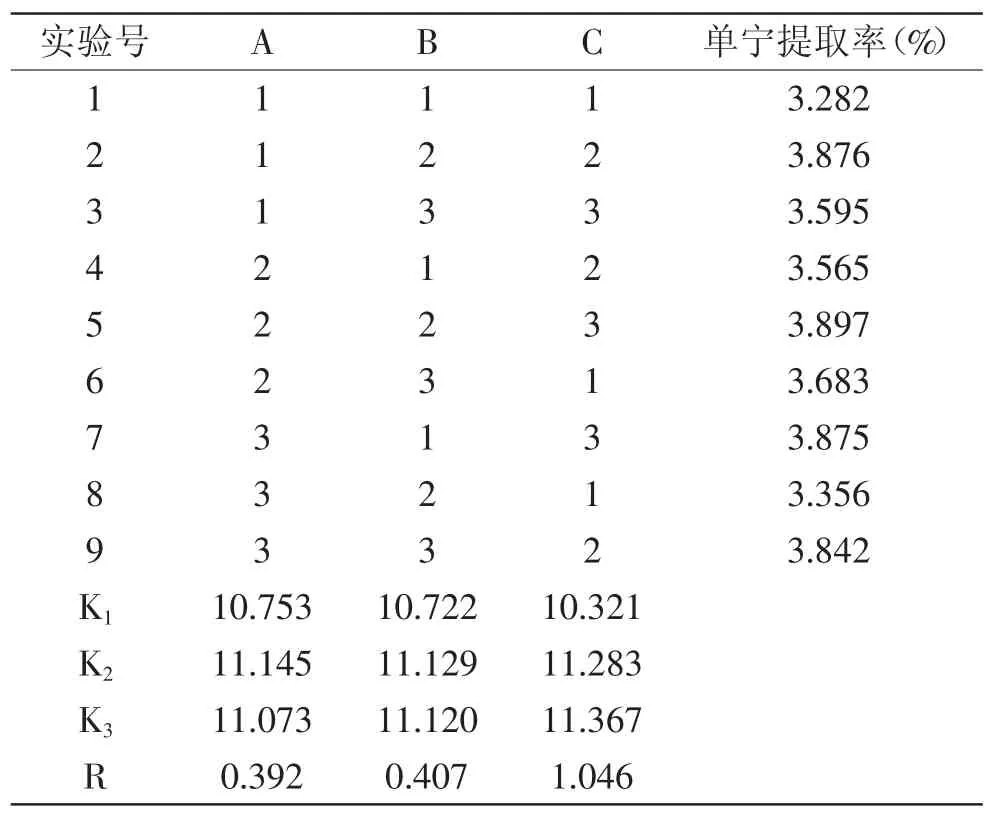
表3 有机溶剂浸提法正交实验结果Table 3 Orthogonal test result of organic solvent extraction
2.3 超声波提取法工艺条件的研究
2.3.1 超声波提取法单因素实验
2.3.1.1 丙酮浓度对提取率的影响 丙酮浓度对白花败酱中单宁的提取率的影响见图6。
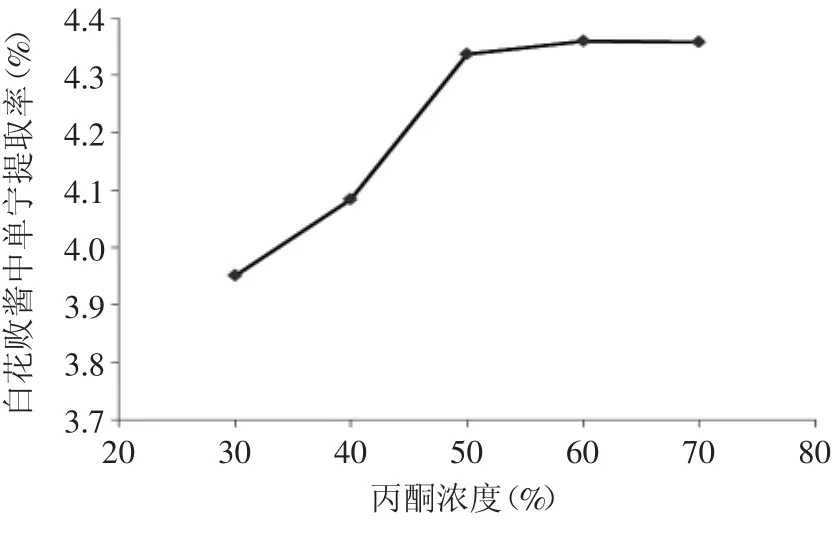
图6 丙酮浓度对单宁提取率的影响Fig.6 Effect of acetone concentration on tannin extraction rate
由图6可以看出,随着丙酮浓度的升高,白花败酱中单宁的提取率也不断增大,当丙酮浓度为50%时,再增大丙酮浓度,提取率只略有上升,因此,考虑到提取成本和提取效果,50%的丙酮浓度较合适。
2.3.1.2 料液比对提取率的影响 料液比对白花败酱中单宁的提取率的影响见图7。
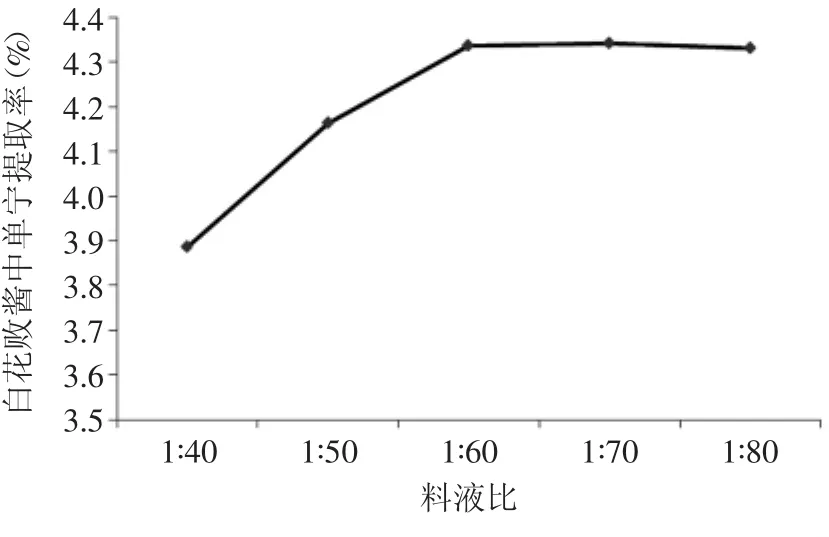
图7 料液比对单宁提取率的影响Fig.7 Effect of material-solution ratio on tannin extraction rate
从图7可以看出,随着提取剂料液比的增大,白花败酱中单宁的提取率逐渐增大,在料液比达到1∶60时,单宁的提取率较高,此后再增大料液比,单宁的提取率没有变化。因此,以料液比1∶60提取较为合适。
2.3.1.3 超声波提取时间对提取率的影响 超声波提取时间对白花败酱中单宁的提取率的影响见图8。由图8可以看出,随着超声波处理时间的延长,单宁的提取率逐渐增大,在超声时间达到50min时,单宁的提取率最高,此后再延长超声波处理时间,提取率有所下降。可能是因为随着超声波处理时间的延长,白花败酱的细胞结构逐渐被破坏,有利于细胞中单宁的溶出,但随着超声时间太长,溶剂的温度也逐渐升高,造成单宁被氧化而损失。因此,确定超声时间为50min。
2.3.1.4 超声波功率对提取率的影响 超声波功率对白花败酱中单宁提取率的影响见图9。
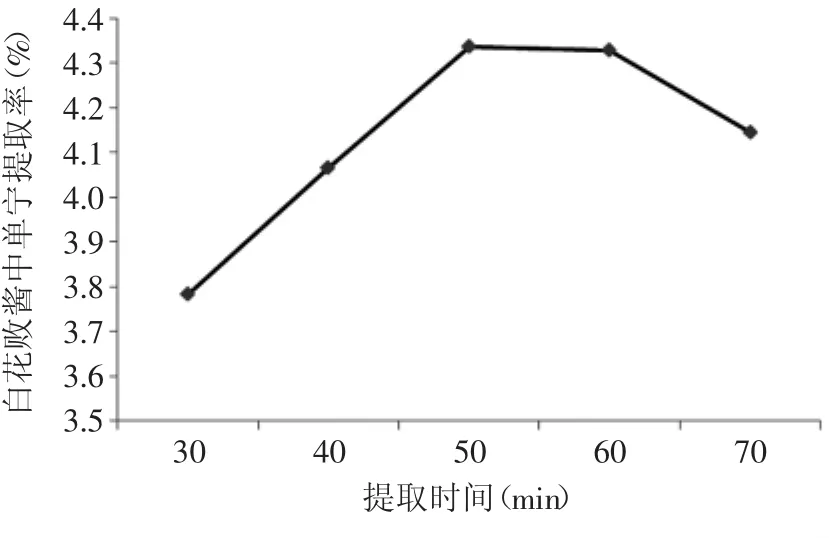
图8 超声时间对提取率的影响Fig.8 Effect of ultrasonic time on tannin extraction rate
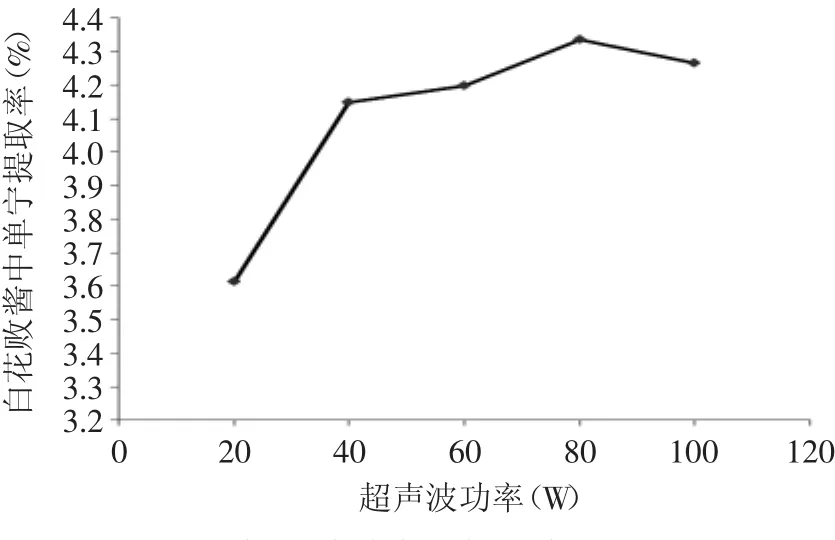
图9 超声波功率对提取率的影响Fig.9 Effect of ultrasonic power on tannin extraction rate
由图9可以看出,随着超声波功率的增大,单宁的提取率逐渐升高,在超声波功率为80W时,单宁的提取率达到最大值,之后再升高超声波的功率,提取率略有下降。可能原因是随着功率的增大,超声波的空化效应增强,加速了白花败酱细胞中单宁的溶出,但功率过大,会使溶剂温度快速升高,同时强烈的超声波空化效应会破坏单宁分子的结构,使提取率降低。因此,合适的超声波功率应为80W。
2.3.2 超声波提取法正交实验结果分析 根据表4可以看出,料液比(A)、提取时间(B)、提取功率(C)三个因素中,提取功率对提取率的影响最大,料液比的影响最小。最优水平为A2B3C2,即当料液比为1∶60、提取时间为60min、提取功率为80W为最优,在此条件下进行验证实验,白花败酱单宁有最大提取率4.648%。
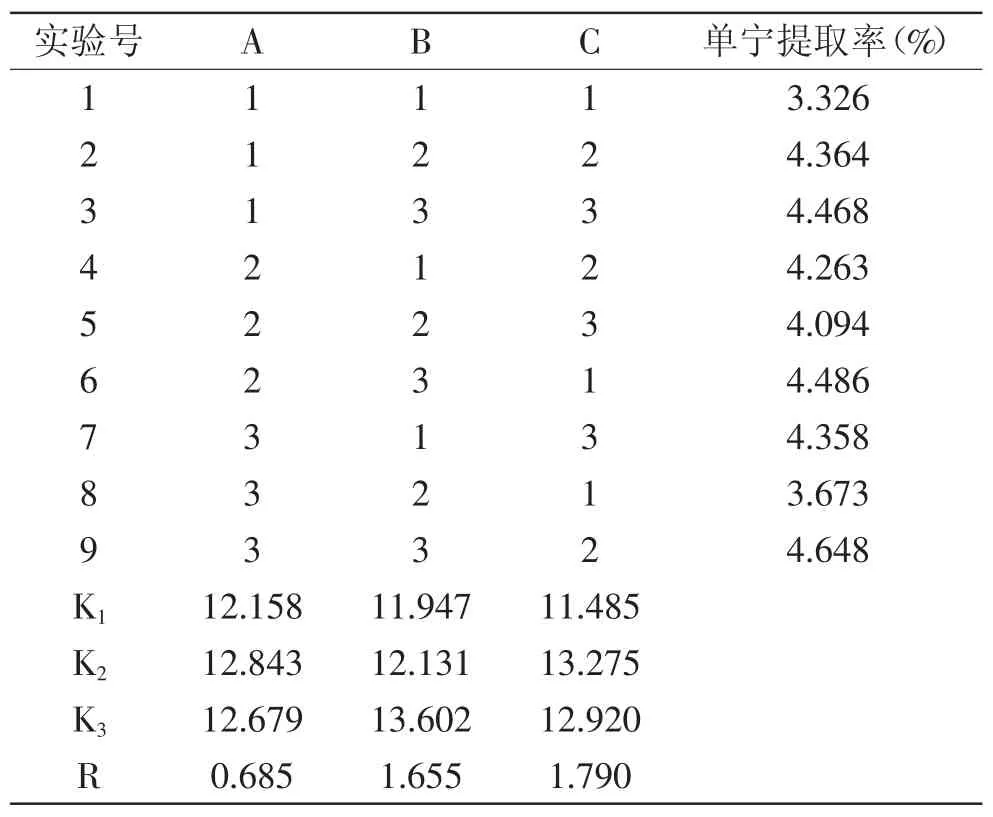
表4 超声波提取法正交实验结果Table 4 Orthogonal test result of ultrasonic extraction
3 结论
植物单宁的提取方法很多,本文比较了超声波提取法与有机溶剂提取法对白花败酱中单宁的提取效果,结果显示,超声波提取法的白花败酱单宁得率较高,以50%丙酮水溶液为提取剂,料液比为1∶60、提取时间为60min、提取功率为80W时,白花败酱单宁有最大提取率4.648%。与有机溶剂提取法相比,所需时间较短,耗能较小,提取效率较高,较适宜于工业化生产。设计出适合工业化白花败酱中单宁的超声波提取工艺以及超声波设备是今后的研究中有待解决的主要问题。
[1]姚新生.天然药物化学[M].北京:人民卫生出版社,1996: 241.
[2]王立峰,鞠兴荣,袁建,等.菜籽壳中单宁提取技术研究[J].食品科学,2006,27(12):364-370.
[3]侯万伟,李萍,张小田,等.蚕豆种皮中单宁提取工艺优化[J].湖北农业科学,2011,50(8):1653-1655.
[4]Ying Xie,Jinyong Peng,Guorong Fan,et al.Chemical copposition and antioxidant activity of volatiles from Patrinia Villosa Juss obtained by optimized supercritical fluid extraction [J].Journal of Pharmaceutical and Biomedical Analysis,2008,48:796-801.
[5]朱加进,何国庆.白花败酱中防便秘抗腹泻功能因子研究[J].食品科学,2002,23(2):113-115.
[6]杨秀平,尉芹,辛转霞,等.单宁提取与测定实验的改进[J].科教文汇,2007(2):100.
Study on extraction of tannin of Patrinia villosa Juss
FAN Xiao-man1,3,JIN Wen-jing2,LONG Wei-yun1,3,YE Lu1,3,ZHU Jia-jin1,3,*
(1.Department of Food Science&Nutrition,Zhejiang University,Hangzhou 310058,China;2.Hangzhou Campus of Zhejiang Ocean University,Hangzhou 311231,China;3.Fuli Institute of Food Science,Zhejiang University,Hangzhou 310058,China)
The extraction process of tannin from Patrinia villosa Juss was studied through methods of organic solvent extraction and ultrasonic extraction.Extraction technology was optimized by single factor and orthogonal tests.Results showed that the ultrasonic extraction had higher extraction rate,and consumed less time.When the ultrasonic power was 80W,the ratio of material to solution was 1∶60(w/v)and the extraction time was 60mins,the maximum extraction ratio was 4.684%.
Patrinia villosa Juss;tannin;extraction
TS201.2
B
1002-0306(2014)08-0218-05
10.13386/j.issn1002-0306.2014.08.041
2013-07-08 *通讯联系人
范小曼(1990-),女,硕士研究生,研究方向:食品营养。
国家高技术研究发展计划863项目(2011AA100804);浙江省自然科学基金(Y3100322)。
——“单宁”

