MF-H2SO4催化4-甲基-7-羟基香豆素-3-脂肪酸酯的合成
雷英杰,毕 野,李 昊
(1.天津理工大学化学化工学院,天津300384;2.天津生物工程职业技术学院,天津300462)
4-甲基-7-羟基香豆素是一类重要的杂环化合物,具有抗菌、抗病毒、杀虫等生物活性[1-2],还可作为添加剂和染料广泛应用于食品、化妆品和荧光材料等领域[3-4]。近年研究表明:在C3位引入脂肪酸结构有可能改变香豆素的一些分子特性,例如将4-甲基-7-氨基香豆素-3-乙酸用N-羟基丁二酰亚胺修饰,与蛋白质偶联能够产生很大的Stokes位移,可作为蛋白荧光标记物[5];4-三氟甲基-7-羟基香豆素-3-乙酸对CYP2C9酶抑制剂的高通量筛选速率显著提高[6];另外,羧基结构对香豆素的解旋酶抑制效应也有很大影响,有利于细菌解旋酶的靶向作用[7]。因此,脂肪酸类取代基的引入为研究和开发新型香豆素杂芳类衍生物提供了可能[8]。但目前对于该类化合物的合成研究相对较少,以Pechmann缩合反应为主[9],需要使用过量的硫酸或磷酸等催化剂,存在反应时间长,反应条件剧烈,后处理复杂以及环境污染等问题。鉴于微波反应加热速度快、反应收率高等优势,笔者以蜜胺甲醛树脂负载硫酸为催化剂,研究了微波辐射下间苯二酚和地衣酚分别与β-酮酸酯作用生成4-甲基-7-羟基香豆素-3-脂肪酸乙酯的反应,合成路线见图1。
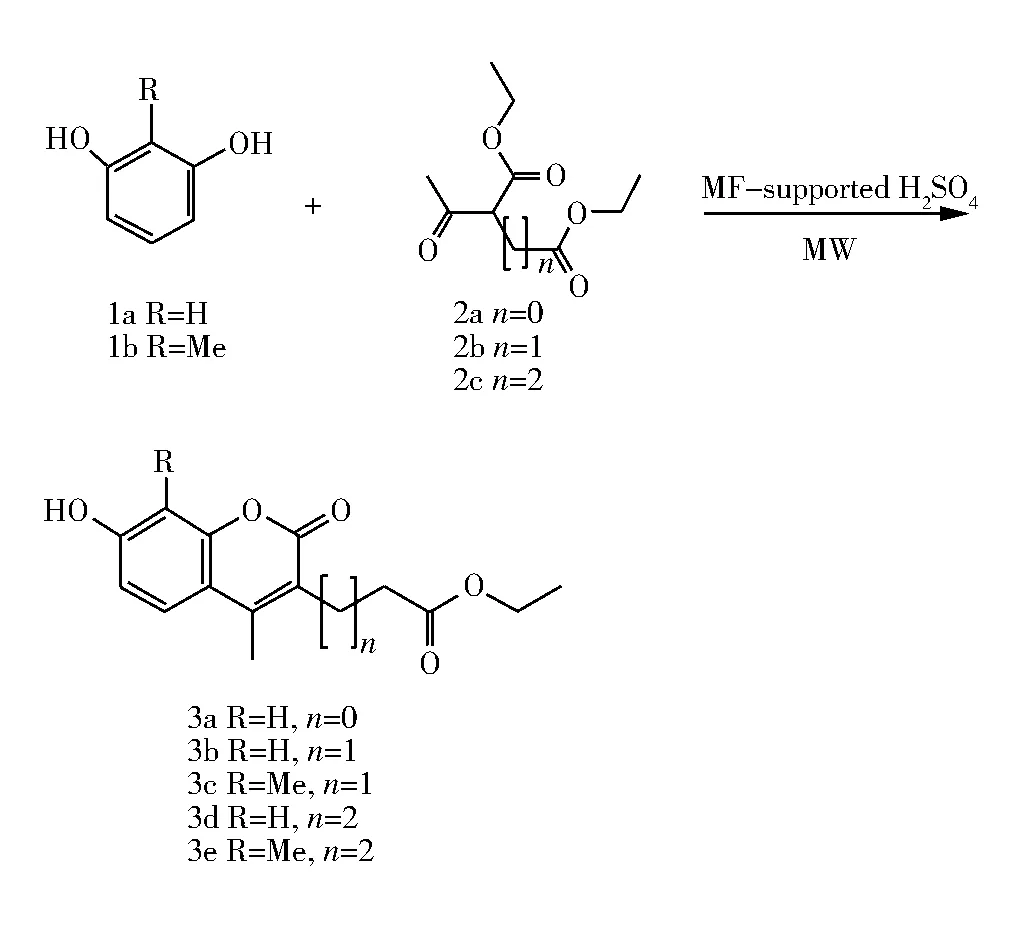
图1 标题化合物的合成路线
1 实验部分
1.1 原料和仪器
多聚甲醛、三聚氰胺、间苯二酚、地衣酚均为化学纯,天津市江天统一科技有限公司;乙酰丙二酸二乙酯、2-乙酰丁二酸二乙酯和2-乙酰戊二酸二乙酯均为化学纯,Sigma公司;TLC薄层板采用青岛海洋化工厂GF254硅胶。
Galanz WD900G型家用微波炉,格兰仕集团;X-5型显微熔点测定仪,上海予正仪器公司,温度计未校正;Nicolet 60SXR-FTIR型红外光谱仪,美国Nicolet公司,KBr压片;INOVA 400 MHz核磁共振仪,美国Varian公司,TMS为内标,DMSO作溶剂。
1.2 MF负载硫酸催化剂的制备
将三聚氰胺和多聚甲醛按1∶0.76(质量比)混合,用氢氧化钠溶液调节pH值至8.5,在85 ℃反应形成蜜胺甲醛树脂,按照1 g树脂吸附10 mmol硫酸比例,制备MF-H2SO4催化剂[10]。
1.3 4-甲基-7-羟基香豆素-3-脂肪酸乙酯的合成(3a-3e)
称取适量取代苯酚(1a-1b,1 mmol)和β-酮酸酯 (2a-2c, 1 mmol)与一定量的催化剂(1.2 mmol) 混合,研磨均匀后放入微波炉中,设置微波功率800 W,辐射时间5~8 min,TLC跟踪反应进程;反应结束加入乙醇30 mL,静置后抽滤;滤液经减压浓缩后硅胶色谱柱分离,得到目标化合物(3a-3e);固体物分别用热水和乙醚洗涤数次,干燥后得到回收的树脂。
2 结果与讨论
2.1 目标化合物的理化常数
4-甲基-7-羟基香豆素-3-甲酸乙酯(3a): 白色粉末,m.p. 130~132 ℃。IR(KBr),σ/cm-1:3 400,2 940,1 721,1 670,1 530,1 480,1 080。1H NMR(DMSO-d6),δ: 1.18(t,J=9.0 Hz,3H,CH3),2.36(s,3H, CH3),4.05(q,J=7.2Hz,2H,CH2),6.65(d,J=1.8 Hz,1H,Ar-H), 6.76(m,1H,Ar-H),7.52(d,J=9.0 Hz, 1H,Ar-H),10.29(s,1H,OH)。元素分析C13H12O5:计算值C, 62.90; H,4.87%; 实测值C,62.78; H, 4.75%。
4-甲基-7-羟基香豆素-3-乙酸乙酯(3b): 白色粉末,m.p. 165~167 ℃。IR(KBr),σ/cm-1:3 450,3 010,1 721,1 665,1 256,764。1H NMR(DMSO-d6),δ:1.17(t,J=6.6Hz,3H,CH3),2.36(s,3H, CH3),3.64(s,2H,CH2),4.06(q,J=6.9 Hz,2H,CH2),6.68(d,J=1.8 Hz,1H,Ar-H),6.79(m,1H,Ar-H),7.59(d,J=9.0 Hz,1H,Ar-H),10.41(s,1H,OH)。元素分析 C14H14O5: C,64.12; H,5.38%; 实测值C,63.78; H,5.22%。
7-羟基-4,8-二甲基香豆素-3-乙酸乙酯(3c): 白色粉末,m.p. 197~199 ℃。IR(KBr),σ/cm-1:3 430,2 980,1 720,1 670,1 245, 780。1H NMR(DMSO-d6),δ:1.18(t,J=6.7Hz,3H,CH3),2.15(s,3H, CH3),2.34(s,3H,CH3),3.64(s,2H,CH2),4.08(q,J=7.1 Hz,2H,CH2),6.88(d,J=8.8 Hz,1H,Ar-H),7.51(d,J=9.0 Hz,1H,Ar-H),10.38(s,1H,OH)。元素分析C15H16O5: C,65.21; H,5.84%; 实测值C, 64.92; H,5.56%。
4-甲基-7-羟基香豆素-3-丙酸乙酯(3d): 白色粉末,m.p. 165~167 ℃。IR(KBr),σ/cm-1:3 420,2 980,1 723,1 670,1 528,1 494,1 080。1H NMR(DMSO-d6),δ:1.17(t,J=6.7Hz,3H,CH3),2.35(s,3H,CH3),2.46(t,J=7.5 Hz,2H,CH2),2.80(t,J=7.2 Hz,2H,CH2),4.06(q,J=7.0 Hz,2H,CH2),6.68(d,J=1.8 Hz, 1H, Ar-H),6.78(m,1H,Ar-H),7.59(d,J=9.0 Hz,1H,Ar-H),10.41(s,1H,OH)。元素分析C15H16O5: C,65.21; H,5.84%; 实测值C,65.02; H,5.90%。
7-羟基-4,8-二甲基香豆素-3-丙酸乙酯(3e): 白色粉末,m.p. 166~168 ℃。IR(KBr),σ/cm-1:3 428,3 010,1 722,1 675,1 280, 790。1H NMR(DMSO-d6),δ:1.16(t,J=6.7 Hz,3H,CH3), 2.15(s,3H, CH3),2.36(s,3H,CH3),2.46(t,J=7.2 Hz,2H,CH2),2.80(t,J=7.5 Hz,2H,CH2),4.05(q,J=7.1 Hz,2H, CH2),6.85(d,J=8.7 Hz,1H,Ar-H),7.46(d,J=8.8Hz,1H,Ar-H),10.28(s,1H,OH)。元素分析C16H18O5: C,66.19; H,6.25%; 实测值C,65.85; H,6.12%。
2.2 MF-H2SO4催化Pechmann缩合反应
作为一种热固性材料,蜜胺甲醛树脂耐水和耐热性能良好,负载无机酸等催化剂具有明显优势,诸如从底物和产品的混合物中容易分离,可回收并重复使用,本课题组曾利用MF-H2SO4催化剂快速高效合成了1,3,4-口恶二唑类化合物[11]。
本实验采用等量的取代酚和β-酮酸酯以及过量的MFR负载硫酸催化剂,设定微波辐射功率为800 W,通过Pechmann缩合反应制备4-甲基香豆素-3-脂肪酸乙酯的合成工艺进行探讨,结果如表1所示。
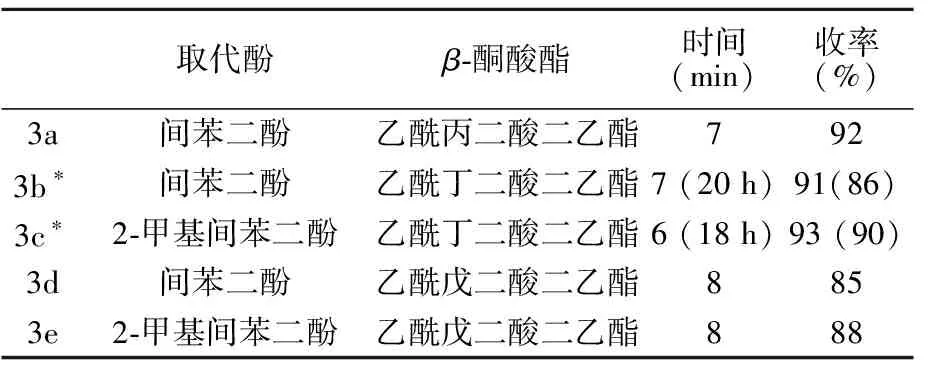
表1 MF-H2SO4催化Pechmann缩合反应制备标题化合物
从表1可以看出:在微波辅助下MF-H2SO4能够有效催化Pechmann反应,反应不超过8 min,合成收率为85%~93%。与常规室温反应相比,本实验条件下微波辅助催化的优势明显,而且没有副产物生成。
2. 3 MF-H2SO4催化剂用量对Pechmann缩合反应收率的影响
以间苯二酚和乙酰丙二酸二乙酯的反应为例,n(酚)∶n(β-酮酸酯)=1∶1, 微波输出功率为800 W, 微波辐射时间7 min,改变催化剂的用量, 考察催化剂的量对4-甲基-7-羟基香豆素-3-乙酸乙酯(3a)合成收率的影响, 结果见表2。
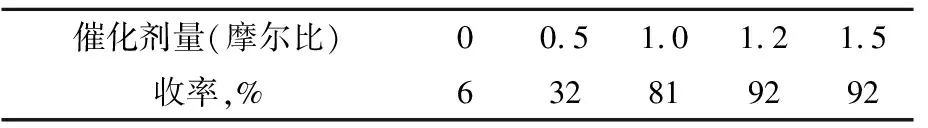
表2 催化剂用量对化合物3a合成收率的影响
由表2可以看出:Pechmann缩合反应的合成收率随催化剂用量增加而增加,加入1.0倍摩尔量MF-H2SO4时,化合物3a合成收率为81%,若在此体系中加入1.2倍摩尔量,其合成收率则可以提高到92%,进一步增加催化剂用量则收率无明显变化,因此选择催化剂用量以1.2倍摩尔量为宜。
2.4 MF-H2SO4催化剂重复利用次数的影响
以间苯二酚和乙酰丙二酸二乙酯的反应为例,即设定微波输出功率800 W辐射时间7 min,加入1.2倍的新树脂负载硫酸催化剂或回收处理活化后的树脂负载催化剂,进行相同的反应,考察MF-H2SO4催化剂的回收再利用效果,结果见表3。

表3 重复使用硅胶负载催化剂对化合物3a合成收率的影响
由表3可以看出:随着重复使用次数的增加,目标化合物的合成收率有所下降。但重复使用3次的合成收率仍然较高,说明MF-H2SO4催化剂在Pechmann反应中具有潜在的应用前景。
3 结 论
以蜜胺甲醛树脂负载硫酸为催化剂,利用微波辐射技术,能够显著加快取代酚和β-酮酸酯之间的缩合反应,合成收率达到85%~93%,而且该催化剂能够多次使用,因此在Pechmann反应中具有潜在的应用前景。
参 考 文 献
[1] Bhat M A, Siddiqui N, Khan S A, et al. Synthesis of triazolothiazolidinone derivatives of coumarin with antimicrobial activity[J]. Acta Pol Pharm, 2009, 66(6):625-632.
[2] Cacic M, Trkovnek M, Cacic F, et al. Synthesis and antimicrobial activity of some derivatives of (7-hydroxy- 2-oxo-2H-chromen-4-yl)-acetic acid hydrazide[J]. Molecules, 2006, 11:134-147.
[3] Augustinea JK, Bombrunb A, Ramappa B, et al. An efficient one-pot synthesis of coumarins mediated by propylphosphonic anhydride (T3P) via the Perkin condensation[J]. Tetrahedron Lett, 2012, 53(33): 4422-4425.
[4] Chan J, Dodani S C, Chang C J. Reaction-based small-molecule fluorescent probes for chemoselective bioimaging[J].Nature Chemistry, 2012, 4: 973-984.
[5] Egan D, O'kennedy R, Moran E, et al.The pharmacology, metabolism, analysis, and applications of coumarin and coumarin-related compounds[J].Drug Metab Rev, 1990, 22(5): 503-529.
[6] Bambal R B, Elliott R L. 7-Alkoxycoumarins as CYP2C9 substrates and activity assay: U S, 6756209 [P]. 2004-6-29.
[7] Li B, Pai R, Di M, et al.Coumarin-based inhibitors of bacillus anthracis and staphylococcus aureus replicative DNA helicase: chemical optimization, biological evaluation, and antibacterial activities[J]. J Med Chem, 2012, 55(24): 10896-10908.
[8] Chodankar N K, Seshadri S. Studies in the vilsmeier-haack reaction. part ⅩⅩⅤ:synthesis of 3-hetaryl coumarins by the application of the vilsmeier-haack reaction[J]. Dyes and pigments, 1985, 6(5): 313-319.
[9] Garazd M M, Garazd Y L, Khilya V P. Neoflavones 2. methods for synthesizing and modifying 4-arylcoumarins [J]. Chem Nat Compd, 2005, 41(3): 245-271.
[10] Rezaei R, Karami M. Microwave promoted rapid dehydration of aldoximes to nitriles using melamine- formaldehyde resin supported sulphuric acid in dry media[J]. Chin Chem Lett, 2011, 22(7):815-818.
[11] Lei Y J, Liu S Y, Li H, et al.Microwave promoted synthesis of 2,5-diaryl-1,3,4-oxadiazoles using melamine formaldehyde resin supported sulfuric acid[J]. Asian J of Chem, 2013, 25(18): 10454-10456.

