单层组织工程纤维环取向纳米纤维支架的构建和初步验证
杨成伟,邓国英,杨 洋,莫秀梅,叶晓健
椎间盘的纤维环由15~25层同心胶原纤维板层构成,每个板层胶原纤维具有高度的取向性,而且每个板层之间胶原纤维方向相反[1-3]。组成纤维环细胞外基质的胶原纤维和蛋白聚糖所形成的特殊三维结构对于承担并分解椎间盘所承担的巨大轴向压力具有重要作用[4]。退变、外伤等原因都可以引起的纤维环的退变、撕裂、破损,均可引起髓核突出导致局部炎症和神经根机械压迫进而导致肢体疼痛和功能障碍。尽管目前主流的腰椎间盘切除手术可获得很好的临床疗效[5],但该手术仅能解除压迫因素并不能修复纤维环。如能对破损的纤维环进行有效的生物学修复不但可提高手术疗效,还能延缓椎间盘进一步退变。通过组织工程方法构建功能性纤维环修复材料为椎间盘疾病的治疗提供了新的方向,而构建满足力学和生物学要求的组织工程支架是制备组织工程纤维环的关键。
组织工程纤维环支架的构建应当尽量模拟纤维环的细胞外基质的结构特点,通过选用适当的制备方法和原料,构建兼具力学强度和良好组织相容性的生物材料。本实验采用静电纺丝的方法,使用力学性能和组织相容性较好的聚左旋乳酸聚己内酯[poly(lactic acid-co-caprolactone, P(LLA-CL)]模拟单层纤维环组织的结构特点,构建了取向纳米纤维支架,并以无规纳米纤维支架为对照,进行力学和生物学评估,探讨其作为组织工程纤维环支架材料的可行性。
1 材料和方法
1.1 原料
P(LLA-CL)(聚乳酸∶聚己内酯=75∶25,分子量:3.4×105)购自日本GUNZE公司。六氟异丙醇(HFIP)购自上海达瑞精细化学品有限公司。以上原料使用时均不再需要纯化。
1.2 支架制备
将P(LLA-CL)按照质量分数为9%溶解于HFIP溶剂中,密封后置于磁力搅拌器上,在室温下搅拌至成为完全透明的溶液。将配制好的P(LLA-CL)溶液注入注射器中,注射器针头通过导线与直流电高压发生器相连,电压设定为12 KV。P(LLA-CL)溶液的推进速度由微量注射泵控制,流速为1.5 mL/h。制备无规则纳米纤维支架时,使用固定的平板接地铝箔收集纳米纤维,针头距铝箔15 cm。制备取向纳米纤维支架时,使用直径为5 cm的接地金属滚筒收集纳米纤维,针头距滚筒上表面15 cm,滚筒转速为8.3 m/s。制备好的电纺纳米纤维支架置于真空干燥箱内保存,备用。
1.3 支架的形貌观测
支架的表面形态使用扫面电镜(JSM-5600,日本JEOL公司)进行观察。将制备的纳米纤维支架喷金后,使用扫面电镜观察支架表面的纳米纤维形态。使用图像分析软件Image J分析纤维的直径、角度分布以及支架孔径。随机选取扫描电镜图片上的100根纳米纤维,测量其直径和角度。随机选取扫描电镜图片上的100个孔,测量孔径。
1.4 支架的拉伸力学测试
将制备好的纳米纤维支架裁剪成5 mm×20 mm的长条形,测量支架的厚度。将裁剪好的样品固定于材料力学测试机上,使用材料力学性能显微测试系统[6],根据Nerurkar等[7]介绍的测试方法进行测试。通过测量结果计算支架的断裂强度、弹性模量和断裂伸长率3个力学指标。
1.5 在支架上种植并培养骨髓间充质干细胞(mesenchymal stem cells, MSCs)
参考Tan等[8]描述的方法,提取原代SD大鼠MSCs。将2种支架分别裁剪成1.2 cm×1.2 cm大小的方形。裁剪后的支架材料通过紫外线照射2 h进行消毒,并将支架浸没于70%的酒精溶液4 h中增加支架的亲水性。消毒处理后的支架置于24孔板中使用干细胞专用培养基(美国Sciencell公司)孵育过夜。每个支架表面种植MSCs的数目为5×104,置于37℃,5%二氧化碳细胞培养箱中培养7 d,培养基隔天换液。
1.6 细胞增殖实验
使用细胞计数试剂盒(cell counting kit-8, CCK-8,日本Dojindo研究所)对MSCs在2种支架上的增殖情况进行评估。细胞增殖测试选择接种细胞的第1天和第7天进行。分别提取24孔板中的细胞培养液,并加入含有10%的CCK-8试剂,避光孵育2 h后,使用Model 550型酶标仪(美国Bio-Rad公司)于450 nm进行度数。根据前期绘制的标准曲线推算出每个支架上的细胞量。
1.7 细胞形态观察
细胞种植培养后7 d,取出种有细胞的纳米纤维支架,使用PBS冲洗3次,使用4%多聚甲醛固定30 min,以Triton X通透5 min后,使用4’,6-二脒基-2-苯基吲哚(DAPI,美国Invitrogen公司)和鬼笔环肽(美国Invitrogen公司)分别对细胞核和细胞骨架进行染色。使用共聚焦显微镜(TCS SP5,德国Leica公司)对支架表面的细胞形态进行观察。
1.8 统计学分析
2 结 果
2.1 静电纺丝纳米纤维支架的表面形态
无规纳米纤维支架和取向纳米纤维支架表面形态、纤维直径分布和角度分布见图1。无规纳米纤维支架中的纳米纤维无序分布,而取向纳米纤维支架的大部分纳米纤维分布于0°~30°的角度区间内。无规纳米纤维支架的纳米纤维直径(996.14 nm±137.76 nm)略大于取向纳米纤维支架(963.32 nm±158.13 nm),但两者无统计学差别。无规纳米纤维支架的孔径(72.8 μm2±52.6 μm2)明显大于取向纳米纤维支架(16.7 μm2±11.9 μm2),两者有统计学差异(P<0.05),这一结果和Koepsell等[9]的研究结果一致。

a: 无规纳米纤维支架的电镜扫描 b: 无规纳米纤维支架纤维角度分布 c: 取向纳米纤维支架的电镜扫描 d: 取向纳米纤维支架纤维角度分布
a: Scanning electron microscopy image of electrospun P(LLA-CL) random nanofibrous scaffold b: Angular distributions of nanofibers in random nanofibrous scaffold c: Scanning electron microscopy image of aligned nanofibrous scaffold d: Angular distributions of nanofibers in aligned nanofibrous scaffold
图12种支架的表面形态
Fig.1Surfaces of 2 kinds of nanofibrous scaffolds
2.2 纳米纤维支架的拉伸力学结果
纳米纤维排列的方向性对支架的力学性能影响很大(见图2)。取向纳米纤维支架的3个主要力学指标(断裂强度、弹性模量和断裂伸长率)在平行和垂直于纤维方向的2种情况下差异明显,表明取向纳米纤维支架具有各向异性的力学特点。无规纳米纤维支架的力学特点为各项同性,其断裂强度和弹性模量分别为(6.30±0.42)Mpa和(110.73±11.11)MPa均低于取向纳米纤维支架在平行于纤维方向上所测得的结果;而无规纳米纤维支架的断裂伸长率(111.23±16.51)%要高于取向纳米纤维支架在取向方向上的结果(75.70±5.43)%。与Bosworth等[10]的研究结果相似,取向纳米纤维支架在取向方向的断裂强度(21.90±2.01)MPa和弹性模量(385.85±17.46)MPa大约为无规纳米纤维支架的4倍。可见在平行于纳米纤维的方向上,取向纳米纤维支架的力学强度得到了明显的增强。
2.3 细胞增殖情况
CCK-8试剂盒检测细胞增殖情况的结果(见图3)显示,在第1和7天,2种支架表面的MSCs均快速增殖,2种支架上第7天的细胞数目均较第1天时明显增加,但是2种支架上的细胞数目在每个时间点上差异均无统计学意义。
2.4 纳米纤维支架表面的细胞形态
MSCs种植于2种纳米纤维支架培养7 d后的共聚焦显微镜观察结果如图4所示。MSCs在无规纳米纤维支架上无序分布,细胞骨架也呈无序状态。而细胞在取向纳米纤维支架上的排列却具有明显的方向性,所有细胞均平行于纳米纤维方向定向排列,细胞伸展并呈纺锤形,细胞内骨架蛋白的排列和细胞排列方向相一致。可见支架中纳米纤维的排列方向对支架表面细胞的排列和形态具有明显的诱导作用。
3 讨 论
3.1 取向纳米纤维支架的制备
近10年来,静电纺丝技术[11]作为一种通过电场力制造纳米至微米级极细纤维丝的方法,因其相对简单的技术流程和相对广泛的原材料选择,在组织工程支架构建方面得到了广泛关注并取得了长足的发展。静电纺丝纤维具有极高的表面体积比、可调节的孔隙率及延展性,且静电纺丝纤维直径数量级和细胞外基质纤维相似,因此静电纺丝组织工程支架能够模拟细胞外基质,促进细胞和基质及细胞间的相互作用。经典的静电纺丝技术通过平板来收集纳米纤维,所得到的支架中纳米纤维丝随机排列,因而该支架具有各项同性的结构和力学特点。但是纤维环组织具有复杂的板层结构,每个板层中所含的胶原纤维又具有高度的取向性,因此如模拟纤维环细胞外基质结构特点,就需要获得纤维排列方向一致的纳米纤维支架,最常用办法是通过高速滚轴来收集电纺纤维。Koepsell等[9]和Nerurkar等[12]研究了不同速度滚轴收集的纳米纤维制备取向纳米纤维支架的特点,其使用聚己内酯构建取向纳米纤维支架,发现滚轴转速越快,所构建支架中的纳米纤维取向性越强,平行于纤维方向的力学强度也越高。本研究以P(LLA-CL)为原料,使用高速滚轴(8.3 m/s)制备取向纳米纤维支架,获得的支架取向性较高,有87%的纳米纤维的角度分布于0°~30°;使用平板接收纳米纤维的无规纳米纤维支架纤维方向在各个角度范围内均匀分布。本研究中发现取向纳米纤维支架的纤维直径略小于无规纳米纤维支架,尽管这一结果无统计学意义,但是这一现在也在国外报道中[9]出现过。导致这一结果的原因可能是滚轴在高速旋转的情况下表面的离心力较大,可能将静电黏附于滚轴表面的纳米纤维拉伸,纤维直径就会减小。同时本研究还发现取向纳米纤维支架的孔径较无规纳米纤维支架明显缩小,这一结果和Koepsell等[9]的研究结果相一致,取向度越高则孔径越小。由于支架的孔径对于细胞的黏附和增殖具有重要的作用,大孔径更有利于细胞获得更充足的养分,因此取向支架的小孔径可能是后期进一步研究所面临的主要困难。

a: 拉伸强度 b: 杨氏模量 c: 断裂伸长率 ‖: 平行于取向纳米纤维的纤维方向 ⊥: 垂直于取向纳米纤维的纤维方向
a: Tensile strength b: Young’s modulus c: Elongation at break ‖: Parallel presumed fiber direction ⊥: Perpendicular presumed fiber direction
图22种支架的力学性能
Fig.2Mechanical properties of 2 kinds of nanofibrous scaffolds

图32种支架的细胞增殖情况
Fig.3Cell proliferation on 2 kinds of nanofibrous scaffolds
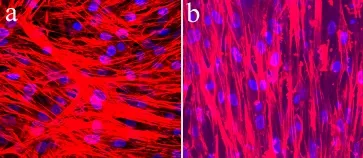
a: 无规纳米纤维支架 b: 取向纳米纤维支架 蓝色:细胞核 红色:细胞骨架蛋白
a: Random nanofibrous scaffold b: Aligned nanofibous scaffold Blue: Nuclei Red: Cytoskeletal protein
图42种支架表面MSCs的生长情况(共焦显微镜,×400)
Fig.4MSCs on 2 kinds of nanofibrous scaffolds(confocal microscopy,×400)
3.2 取向纳米纤维支架的力学分析
无规纳米纤维支架在力学上表现为各项同性,各个方向上的力学指标差异无统计学意义。单层纤维环具有明显的各向异性力学特点,拉伸力学测试结果提示,取向纳米纤维支架正好能模拟这一特点。对于纤维环组织工程而言,较强的强度和刚度是对支架材料极为重要的要求。研究已经证实,单层人体纤维环在纤维方向上的拉伸弹性模量为80~120 MPa[3]。国外的研究者[9, 12-13]多使用聚己内酯进行支架构建,聚己内酯虽然具有良好的组织相融性和延展性,但其强度和刚度较差,国外研究者构建的聚己内酯纳米纤维支架弹性模量为50 MPa,尚不能达到纤维环的力学要求。本研究使用P(LLA-CL)作为原料构建纳米纤维支架,该材料的强度和刚度都比聚己内酯强很多,拉伸力学结果提示P(LLA-CL)构建的取向纳米纤维支架平行于纤维方向的弹性模量为240 MPa,完全满足纤维环组织工程的力学要求。
3.3 取向纳米纤维支架对细胞形态的影响
人体纤维环组织中胶原蛋白均呈束状分布并具有高度的取向性,同时纤维环细胞也是沿着胶原束的方向拉伸并定向分布。本研究所制备的取向纳米纤维支架具有高度的取向性,细胞能够在取向纳米纤维的影响下沿着纳米纤维的方向拉伸并按照纤维方向进行排列。纳米纤维对于细胞形态和细胞骨架的作用已经在许多研究中[10, 14]得到了证实。纳米纤维通过控制细胞黏附点面积,调节细胞黏附斑构型从而对张力丝的结构进行调节。与Li等[15]的研究结果相似,本实验共聚焦显微镜可观察到MSCs在取向纳米纤维支架上取向排列且明显伸长,细胞骨架也具有明显的取向性,和无规纳米纤维支架上MSCs的形态具有明显的差异。细胞形态改变和对细胞外基质的分泌具有重要的影响,在取向纳米纤维支架上,细胞分泌的细胞外基质同样具有取向性,而无规纳米纤维支架上的细胞分泌的细胞外基质则是无序的。本研究中取向纳米纤维支架对细胞形态和分布的序列化作用进一步提示其作为纤维环组织工程支架的可能性。
综上所述,使用静电纺丝技术构建的P(LLA-CL)取向纳米纤维支架能够模拟单层纤维环细胞外基质的结构特点,满足纤维环组织工程对支架的力学要求,促进细胞定向拉伸排列,可用于进一步的纤维环组织工程研究。
参考文献
[1] Marchand F, Ahmed AM. Investigation of the laminate structure of lumbar disc anulus fibrosus[J]. Spine (Phila Pa 1976), 1990, 15(5):402-410.
[2] Cassidy JJ, Hiltner A, Baer E. Hierarchical structure of the intervertebral disc[J]. Connect Tissue Res, 1989, 23(1):75-88.
[3] Holzapfel GA, Schulze-Bauer CA, Feigl G, et al. Single lamellar mechanics of the human lumbar anulus fibrosus[J]. Biomech Model Mechanobiol, 2005, 3(3):125-140.
[4] Guterl CC, See EY, Blanquer SB, et al. Challenges and strategies in the repair of ruptured annulus fibrosus[J]. Eur Cell Mater, 2013, 25:1-21.
[5] 马学晓, 岳彬, 陈伯华, 等. 单纯髓核摘除术治疗腰椎椎间盘突出症的长期疗效观察[J]. 脊柱外科杂志, 2012, 10(5):293-295.
[6] 张东升, 罗淼, 韩永胜. 材料力学性能显微测试系统[J]. 实验力学, 2006, 21(5):651-654.
[7] Nerurkar NL, Elliott DM, Mauck RL. Mechanics of oriented electrospun nanofibrous scaffolds for annulus fibrosus tissue engineering[J]. J Orthop Res, 2007, 25(8):1018-1028.
[8] Tan Q, Lui PP, Rui YF, et al. Comparison of potentials of stem cells isolated from tendon and bone marrow for musculoskeletal tissue engineering[J]. Tissue Eng Part A, 2012, 18(7-8):840-851.
[9] Koepsell L, Remund T, Bao J, et al. Tissue engineering of annulus fibrosus using electrospun fibrous scaffolds with aligned polycaprolactone fibers[J]. J Biomed Mater Res A, 2011, 99(4):564-575.
[10] Bosworth LA, Alam N, Wong JK, et al. Investigation of 2D and 3D electrospun scaffolds intended for tendon repair[J]. J Mater Sci Mater Med, 2013, 24(6):1605-1614.
[11] Liu W, Thomopoulos S, Xia Y. Electrospun nanofibers for regenerative medicine[J]. Adv Healthc Mater, 2012, 1(1):10-25.
[12] Nerurkar NL, Mauck RL, Elliott DM. ISSLS prize winner: integrating theoretical and experimental methods for functional tissue engineering of the annulus fibrosus[J]. Spine (Phila Pa 1976), 2008, 33(25):2691-2701.
[13] Han WM, Nerurkar NL, Smith LJ, et al. Multi-scale structural and tensile mechanical response of annulus fibrosus to osmotic loading[J]. Ann Biomed Eng, 2012, 40(7):1610-1621.
[14] Baker BM, Handorf AM, Ionescu LC, et al. New directions in nanofibrous scaffolds for soft tissue engineering and regeneration[J]. Expert Rev Med Devices, 2009, 6(5):515-532.
[15] Li WJ, Mauck RL, Cooper JA, et al. Engineering controllable anisotropy in electrospun biodegradable nanofibrous scaffolds for musculoskeletal tissue engineering[J]. J Biomech, 2007, 40(8):1686-1693.