药物诱导性肝损伤生物标志物研究进展
于乐成,何长伦,侯金林
·专家论坛·
药物诱导性肝损伤生物标志物研究进展
于乐成,何长伦,侯金林
药物诱导性肝损伤;生物标志物;基因组学;代谢组学;转录组学;蛋白组学
药物诱导性肝损伤(drug-induced liver injury,DILI)在全球的发病率呈迅速上升趋势[1,2],在临床上越来越受到重视。长期以来,DILI的诊断主要依靠排除法,导致其诊断的可靠性、及时性和随后的处理均面临着诸多困惑。因此,寻找新的DILI生物标志物,特别是具有药物特异性的生物标志物,已成为近年来有关DILI临床和实验诊断研究的一大热点。相关研究主要围绕与DILI发病机制密切相关的基因组学(genomics)、代谢组学(metabolomics)、转录组学(transcriptomics)、蛋白组学(proteomics)及免疫学等方面展开[1,3],取得了不少有价值的发现,同时依然面临着巨大的挑战。本文特对DILI生物标志物的研究现状作一述评。
1 诊断DILI面临的困惑
目前,DILI临床诊断面临的困惑主要有:(1)缺乏特异的生物学诊断标志物,迄今仍主要依靠询问用药史和排除其他肝损伤病因而进行诊断;(2)多数可导致DILI的药物仅在小部分患者引起DILI,在发生DILI之前鉴别出哪些患者对DILI易感几乎是不可能的;(3)同时应用多种药物,或应用成分复杂的复方制剂时,很难确定DILI究竟是由哪种药物或成分引起,从而可能导致错误停用相关药物,并将患者置于原有疾病得不到适当治疗的风险之中;(4)由于需要尽可能排除其他肝损伤原因,可能导致延迟停用引起肝损伤的药物;(5)难以准确评估初次发现的无症状性血清ALT升高究竟是适应性反应还是严重DILI的前奏。
上述问题表明,临床上需要新的生物标志物来及时建立可靠的DILI诊断,帮助鉴别究竟是何种药物引起DILI,并预测药物诱导的无症状性血清ALT升高的趋势。相对于具有剂量依赖性和可预测性的固有性DILI(intrinsic DILI)而言,不具有剂量依赖性、难以预测的特异质性DILI(idiosyncratic DILI),特别是特异质性肝细胞损伤型DILI往往进展迅速,因而对其相关生物标志物的探索更为迫切[1,4]。
2 对DILI生物标志物的探索有赖于对DILI发病机制的深入了解
DILI发病机制和过程所涉及的各种“组学(-omics)”、免疫学乃至组织病理学等的改变,是探索新的DILI生物标志物的重要来源。DILI发病机制复杂,尚未充分阐明。目前对其认识可概括为三种假说,它们在不同药物引起的DILI可能先后或同时存在。
2.1 蓄积毒性假说该假说认为,开始应用药物后,药物对肝细胞的损伤迅速启动,并且超过了肝细胞的修复能力,肝细胞损伤将随时间增加而蓄积。在损伤蓄积达到某个关键阈值之前,损伤将保持在亚临床状态。然后,由于固有免疫活化,和/或代谢负荷转移至数量减少的已受损的肝细胞,导致肝损伤临床发作和迅速进展。线粒体是最常受累的细胞器[5]。肝脏Ⅰ相和Ⅱ相酶药物代谢酶及Ⅲ相转运蛋白的遗传多态性可能是相应药物在不同患者蓄积程度不一、肝损伤严重程度存在差异的重要机制之一。
2.2 二次打击假说(炎症假说)该假说认为,药物以非蓄积性方式危害肝细胞,但肝脏尚能保持健康表型,直至叠加脂多糖(LPS)等炎症启动因子的额外应激[1]。肝细胞的这种受损状态可导致肝脏释放的特定内源性物质(例如线粒体代谢产物)发生特征性改变,并在血液或尿液中得以反映。
2.3 获得性免疫攻击假说该假说认为,“蓄积性肝损伤”和/或“二次打击”引起肝细胞坏死和释放新抗原,继而启动获得性免疫应答。据此推测,药物引起的ALT升高可能首先反映的是非免疫学损伤,继而在具有特定人类白细胞抗原系统(HLA)表型的患者诱发获得性免疫应答。但温和性血清ALT升高亦可能是由于获得性免疫应答对肝脏的攻击,且机体的适应性可能也包括对这种免疫应答的抑制。不论肝损伤是发生于获得性免疫应答之前或之后,肝脏均可能释放“损伤相关分子模式(DAMPs)”分子。这些信号在血液中可能先于明显的肝损伤而存在,因而成为潜在的有价值的DILI生物标志物[1,6]。
3 DILI生物标志物应具备的条件
美国食品和药品管理局(FDA)药物评价与研究中心指出,判断一项指标是否适合作为DILI诊断标志物,应具备以下5个条件:①有助于区分适应性血清ALT升高和进展性DILI;②在临床表现出现前即能预先判断潜在的DILI;③对已发生的DILI,能提高其诊断率;④有助于区分DILI的严重程度;⑤有助于对DILI的预后进行判断。目前在临床实践中尚无一种生物标志物能满足上述所有条件,但多项指标的组合可最大限度地达到这5项要求。
4 传统的DILI生物标志物
4.1 肝脏生化指标评价DILI常用的肝脏生化指标主要包括血清总胆红素(TBIL)、直接胆红素(DBIL)、丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、γ谷氨酰转肽酶(GGT)、胆酸等。其中ALT对反映肝细胞损伤最为敏感,ALP是最常用的反映胆汁淤积的指标。胆酸的升高先于血清TBIL和凝血酶原时间国际标准化比率(INR)的升高。INR也是反映肝功能受损的重要参数,当INR>1.5时,提示肝功能损害较重。
上述肝脏生化指标不具有病因和药物特异性,但对于已确诊的DILI则有助于判断病情严重程度及预后。ALT和ALP还是Roussel-Uclaf因果关系评估量表(RUCAM)的重要组成参数[7],有助于区别DILI的类型。DILI的分型可通过计算R值来大致判断,即R=[ALT/ULN]/[ALP/ULN],其中ULN为正常上限值。当R≥5时,为肝细胞损伤型,R≤2为胆汁淤积型,2≤R≤5为混合型。在判断预后方面,最著名的是Hy's法则,其核心内容是:若一种药物在临床3期试验中有患者出现ALT>3 ULN和TBIL>2 ULN的肝细胞性黄疸,则每10例患者中约有1例可发展为急性肝衰竭(ALF)[7]。
应注意区分ALT的升高是否真正与肝细胞损伤相关。在啮齿类动物中发现,血清ALT升高可能是因为巨噬细胞功能异常,导致ALT从血液中清除减少[8]。在细胞培养中发现,过氧化物酶体增生物激活受体(PPAR)拮抗剂可导致ALT基因的转录活性增高[9]。临床上常可见到血清ALT升高在继续用药过程中会自然降低,这可能反映的是一种适应性进程(adaptation)而不是肝毒性;另一方面,某些药物(如对乙酰氨基酚、他克林、肝素等)在推荐剂量下可能频繁引起血清ALT升高,但对肝脏安全性的危害在多数情况下甚微。这使得对临床试验中肝脏生化指标的解释变得复杂化。故此,2009年美国FDA[10]建议对在临床试验中出现血清ALT≥3 ULN的患者可继续治疗,但若ALT≥8 ULN则应停药。这一规定有助于减少不必要的停药,但也将受试对象置于某种严重肝损伤的风险之中。可见,寻找能准确和安全地评估新药对肝脏影响的新的DILI生物标志物是非常必要和迫切的[1,4]。
4.2 肝组织损伤病理学评分既往认为DILI的肝组织病理学变化缺乏特异性,很难据此对DILI做出肯定或否定诊断。因此,临床上对疑似DILI患者通常并无太大必要进行肝活检。这种观念可能需要修正。上海华山医院病理科胡锡琪教授报告,以肝细胞脂肪变性(小泡性2分,大泡性1分)、肝细胞性胆汁淤积(1分)、肝细胞凋亡小体(1分)、嗜酸细胞浸润(2分)、上皮肉芽肿(1分)和铁沉着(1分)等7种参数组成的DILI组织病理学评分系统可将药物与肝损伤的因果关系分为5个阶段。8~9分为“明确(definite)”,7分为“极可能(highly likely)”,5~6分为“很可能(probable)”,3~4分为“可能(possible)”,1~2分为“不可能(unlikely)”[11]。这种分阶与美国药物性肝损伤网(DILI network,DILIN)所设计的“结构性专家观点程序(structured expert opinion process,SEOP)”分级是完全一致的[12]。与RUCAM评分系统(+15~-3分)的因果相关程度分级也大体一致。RUCAM因果相关性分级为:>8分为“极可能(highly probable)”,8~6分为“很可能(probable)”,5~3分为“可能(possible)”,2~1分为“不可能(unlikely)”,<1分为“排除(excluded)”[12]。
5 新的DILI生物标志物
5.1 基因组学来源的标志物这类生物标志物不仅包括单个核苷酸多态性(singlenucleotide polymorphism,SNP),也包括基因组或线粒体DNA受损后的产物。从现有资料看,SNP对于DILI诊断的主要价值是预测特定个体对某种药物肝毒性的易感性,但对DILI诊断和预后判断的价值尚待研究。
5.1.1 HLA基因多态性基于SNP的全基因组关联研究(genome-wide association studies,GWAS)显示,HLA基因多态性与特定人群对某些药物肝毒性易感性的增加相关(表1)。例如,HLA-DRB1*1501-DRB5*0101-DQB1*0602与阿莫西林-克拉维酸肝损伤强相关,HLA-DRB1*1501与胆汁淤积型肝损伤强相关,HLA-B*5701可使患者服用氟氯西林后发生肝损伤的风险增加80倍以上。

表1 HLA与药物性肝损伤的相关性[2]
5.1.2 药物代谢酶和转运蛋白基因多态性GWAS研究还显示,药物代谢Ⅰ相酶(如CYP)、Ⅱ相酶(如GSTs、UGT、NAT2),以及药物转运蛋白(如BSEP、MRP、MDR、NTCP、OATPs)的基因多态性与特定人群对某些药物肝毒性易感性的增加明显相关[2]。
5.1.3 线粒体DNA(mtDNA)及其降解片段线粒体DNA(mtDNA)及其降解片段可作为判断线粒体损伤和肝细胞坏死的重要指标。
5.2 代谢组学来源的标志物损伤应激可改变肝脏持续释放入血的代谢体(metabolome)的特征。血清、尿液甚至唾液中代谢体的典型改变往往在进展性线粒体损伤之前即可出现。某些代谢性改变对各种严重DILI而言可能是共性的,也有一些代谢改变可能具有药物种类特异性,从而可以用于DILI的诊断和鉴别诊断[1,13]。
早期干预药物代谢组学(early intervention pharmaco-metabonomics)有望用于鉴别将发生肝损伤的患者。例如,N-乙酰-对-苯醌亚胺(N-acetylpbenzoquinone imine,NAPQI)是具有肝毒性的APAP代谢产物,可能为DILI易感性的一种重要预测因子。NAPQI产生越多,发生DILI的风险也越高。此外,有助于DILI诊治的代谢组学生物标志物也可能来源于细菌。新近研究提示,肠道菌群的差异可显著改变宿主对APAP等药物的应答,包括对DILI的易感性。
5.3 转录组学来源的标志物药物刺激可导致肝脏转录组(transcriptome)发生改变,甚至是特征性的改变。这种改变既有助于鉴别DILI和其他类型的肝损伤,也有助于从多种药物中识别引起DILI的药物,还可预测患者的肝损伤进程,准确评估在新药研发过程中真正的肝脏风险。
准确获取肝脏转录组信息需要进行肝活检,而肝活检在DILI的临床诊断和处理方面并非常规手段。全血转录组的改变可在一定程度上反映肝脏转录组的改变,但不应主观假定肝脏和全血中的转录组事件具有完全可靠的关联[1]。新近研究显示,在APAP中毒的大鼠,仅小部分肝脏转录组的改变可在全血中得到类似反映。
在发生DILI时,在血浆中可检测到肝脏来源的微小RNA(miRNAs)和全长mRNAs[13~15]。miRNAs是一种18~24nt的小分子RNAs,包括miR-122、miR-192、miR-802、miR-193、miR-144、miR-200a、miR-21、miR-29c和miR-802等。其中,miR-122具有肝脏特异性,敏感性高,这两种特点明显优于ALT,可用于对APAP所致DILI的早期诊断,且其半寿期短,可更好地反映肝损伤的消退[13,15,16]。但敏感性过高则有可能引起对轻微和暂时性肝损伤的过度关注。
在大鼠血清中还可测及肝脏来源的全长mRNA,以微泡和外泌体的形式从肝细胞主动分泌。在健康状态下,肝脏是循环mRNA池的大量供应者。在肝损伤时,循环肝脏mRNAs水平升高。大鼠在APAP肝损伤和氨基半乳糖肝损伤期间的循环转录物模式是不同的,支持血液中的mRNA特点可能有助于DILI的鉴别诊断。
5.4 蛋白组学来源的标志物目前提出的DILI生物标志物大多数属于蛋白质(表2)。Ⅱ型细胞骨架18(CK-18)、角蛋白(keratin)、细胞色素C、谷氨酸脱氢酶(GDH)、高迁移率组B1蛋白(HMGB1)、苹果酸脱氢酶(MDH)、嘌呤核苷磷酸化酶(PNP)、血清对氧磷酶/芳基酯酶1(PON1)以及山梨醇脱氢酶(SDH)等通常呈组成性表达,并在肝细胞死亡时被动释放至血液循环。这些蛋白如果在血清中的水平很高,则支持肝细胞坏死是肝细胞死亡的主要机制。仅凭其中任何一种生物标志物均不足以对DILI进行诊断或预后判断。
炎性细胞因子也是潜在的DILI生物标志物。若循环细胞因子水平的升高导致患者感到不适,则出现肝损伤进展的风险将加大。血清特定细胞因子水平的升高有可能显著早于临床症状的出现,因而可作为新的DILI生物标志物。
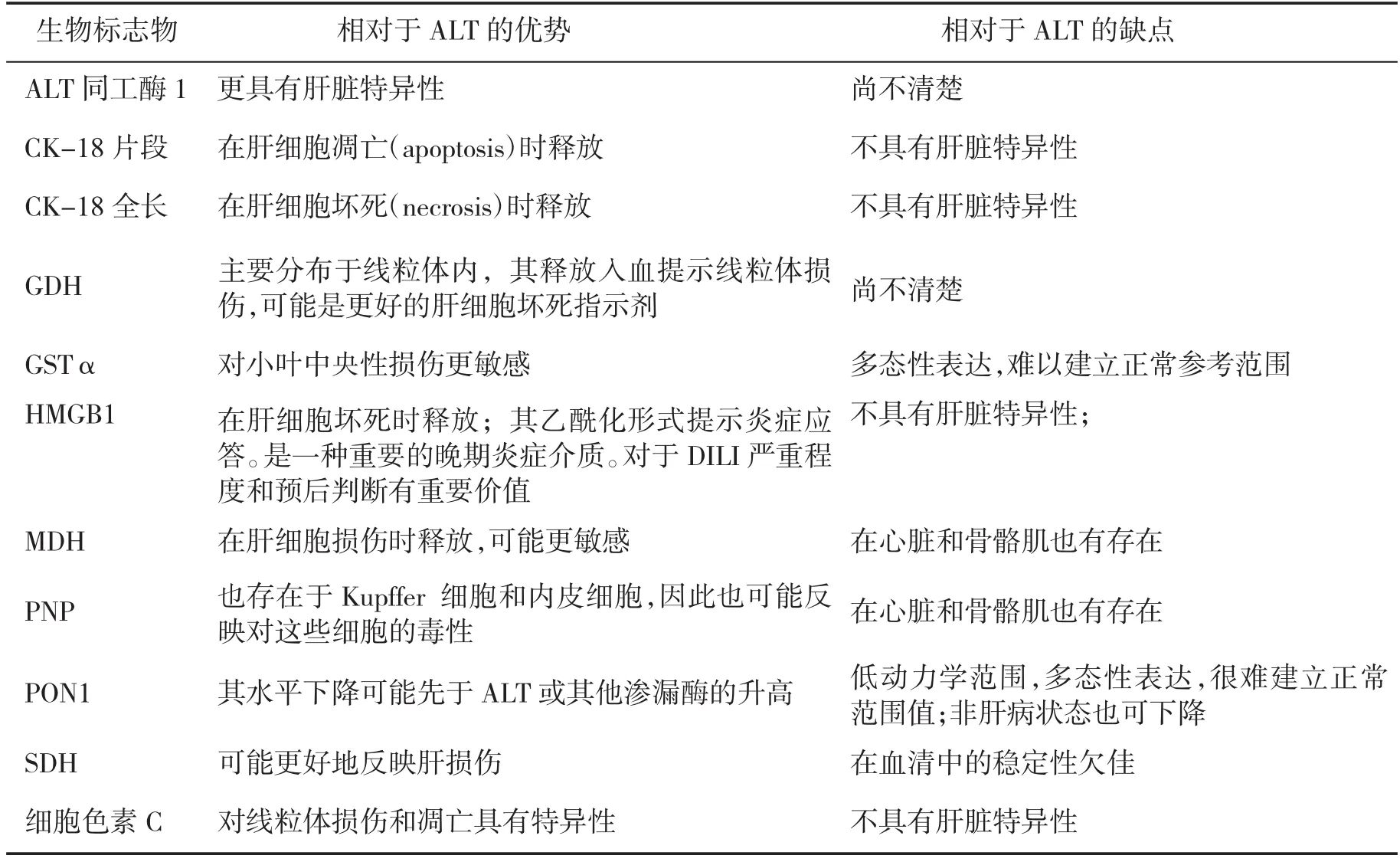
表2 潜在的肝细胞性DILI血清生物标志物及其相对于血清ALT的特点[1,16]
5.5 血清蛋白加合物有些药物可与特异性肝细胞内蛋白质共价结合,形成“药物-蛋白质加合物(drug-protein adducts)”,进而引起DILI[1]。在肝细胞死亡时,加合物随同其他肝细胞蛋白进入到血液循环。迄今为止,唯一令人鼓舞的例证是在血清中可测及APAP-蛋白质加合物,并鉴别出APAP是DILI的病因。血清APAP-蛋白质加合物有较长的t1/2,在其他APAP来源的产物不能继续被检出时仍具有诊断价值。服用治疗剂量APAP的个体,如果经受与APAP无关的肝损伤,也有可能出现高水平循环加合物。因此,尚需更多研究去限制APAP加合物含量分析的意义。
5.6 抗肝抗体替尼酸、双肼屈嗪和氟烷等引起的肝损伤,常特征性含有针对肝脏蛋白的循环自身抗体。抗原蛋白通常是细胞色素P450s(CYPs),也可能是其他药物代谢酶。抗体的产生很可能发生在伴有这些细胞内酶优势释放的肝损伤之后。因此,这些抗体可能是与肝损伤机制无关的伴随现象[1]。尽管如此,分析其特征仍可能获得有用的诊断DILI的生物标志物。
5.7 淋巴细胞转化试验越来越多的证据显示,DILI的产生可能源自获得性免疫对肝脏的攻击。这种攻击有可能是由药物或其代谢产物创造的新抗原所活化的细胞毒性T细胞(CTL)介导的。淋巴细胞转化试验(lymphocyte transformation test,LTT)可用于检测患者外周血淋巴细胞在再次暴露于可疑药物时的活化和增殖情况。阳性应答多见于DILI伴发热、皮疹和/或嗜酸细胞增多症的患者,提示药物与肝损伤之间存在因果关系。有报告显示,日本在1977~2006年间应用LTT对1676例DILI患者中的60%进行了检测,阳性率达33%。但该试验在其他国家很少应用[1]。
6 组合型DILI生物标志物
由于依靠单一的生物标志物很难对DILI的诊断、鉴别诊断、病情严重程度及预后作出准确的判断,因此组合应用≥2种生物标志物对DILI进行评估,价值更大。
在FDA开发的“药物诱导性严重肝损伤评估(eDISH)”安全数据处理工具[17],选择的参数主要就是临床试验中每例患者血清ALT峰值相对于血清TBil峰值的可视化数据。
有资料显示,90%应用肝素制剂的患者可出现无症状性血清ALT或AST升高,且血清CK-18全长、GDH、HMGB1、miR-122和SDH也升高,证明ALT或AST的升高来源于肝脏,而CK-18片段是凋亡标志物,未在血液中测及,提示肝素导致的是肝细胞坏死而非凋亡。miR-122和HMGB1在血清中呈双峰增高。HMGB1在初始峰值未发现乙酰化,但在第2个峰值平均约30%发生乙酰化,提示肝素可直接导致自限性温和性肝细胞坏死,继发坏死则可能是由于固有免疫应答的激活。考虑到肝素的肝脏安全性已得到确认,这些研究结果非常令人惊讶,不仅表明DILI的本质非常复杂,也提示一种新的生物标志物的确认需要在多种形式的DILI中得到广泛验证。
7 总结与展望
探索新的DILI生物标志物的意义不仅在于弥补临床排除诊断法的不足,也包括对DILI易感性和发生风险的预测、临床病情轻重的评估及预后的判断等,不仅是临床诊断和防治DILI的需要,也是新药研发过程中预测、检验和预防药物肝毒性的需要。目前发现的多种DILI生物标志物基本上均处于实验研究阶段,加之药物品种繁多和个体差异的复杂性,这些标志物的优化组合和临床意义有待于深入评估。
当前,限制新的DILI生物标志物探索的主要因素已不再是研究技术的缺乏,而是背景信息全面的生物标本库,特别是涵盖药物治疗开始前、治疗过程中(包括临床明显的DILI发生前后)及停药后的生物标本库的建立。大型前瞻性临床试验有助于建立这样的标本库。采用标准化的肝脏安全数据库和标准化的生物标本收集及贮存方案,应成为当前制药工业、药物监管部门及临床医师共同优先考虑的最重要的问题之一[1]。
[1]Watkins PB.Biomarkers for drug-induced liver injury.In: Kaplowitz N,Deleve LD.Drug-induced liver disease,3rd ed. San Diego:Academic Press,2013:275-286.
[2]WatkinsPB,Seligman PJ,Pears JS,et al.Using controlled clinicaltrials to learn more about acute drug-induced liver injury.Hepatology,2008,48(5):1680-1689.
[3]DalyAK,DayCP.Genetic factors in the pathogenesis of drug-induced liver injury.In:Kaplowitz N,Deleve LD.Drug-induced liver disease,3rd ed.San Diego:Academic Press,2013: 215-225.
[4]Olson S,Robinson S,Giffin R.Accelerating the development of biomarkers for drug safety:Workshop summary.http://wwwiomedu/ Reports/2009/BiomarkersDrugSafetyaspx.
[5]Jones DP,Lemasters JJ,Han D,et al.Mechanisms of pathogenesis in drug hepatotoxicity putting thestress on mitochondria. Mol Interv,2010,10(2):98-111.
[6]Daly AK,Day CP.Genetic association studies in drug-induced liver injury.Drug Metab Rev,2012,44(1):116-126.
[7]Chalasani NP,Hayashi PH,Bonkovsky HL,et al.ACG clinical guideline:The diagnosis and management of idiosyncratic drug-induced liver injury.Am J Gastroenterol,2014,109(7):950-966.
[8]Radi ZA,Koza-Taylor PH,Bell RR,et al.Increased serumenzyme levels associated with Kupffer cell reduction with nosigns of hepatic or skeletal muscle injury.Am J Pathol,2011,179(1):240-247.
[9] Thulin P,Rafter I,Stockling K,et al. PPARalpha regulates thehepatotoxic biomarker alanine aminotransferase(ALT1) geneexpression in human hepatocytes. Toxicol Appl Pharmacol,2008,231(1):1-9.
[10]Guidance for Industry:Drug-induced liver injury:Premarketing-Clinical Evaluation.2009.(http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM174090.pdf).
[11]胡锡祺.药物性肝损伤组织病理学评分探讨.中华肝脏病杂志,2012,20(3):176-177.
[12] Rockey DC,Seeff LB,Rochon J,et al. Causality assessment in drug-induced liver injury usinga structured expert opinion process: Comparison to the Roussel-Uclaf causality assessment method. Hepatology,2010,51(6):2117-2126.
[13] Fannin RD,Russo M,O'Connell TM,et al. Acetaminophen dosing of humans results in blood transcriptome and metabolomechanges consistent with impaired oxidative phosphorylation. Hepatology,2010,51(1):227-236.
[14] Su YW,Chen X,Jiang ZZ,et al. A panel of serum microRNAs as specificbiomarkers for diagnosis of compound-and herb-induced liver injury in rats. PLoS One,2012,7(5):e37395.
[15] Bala S,Petrasek J,Mundkur S,et al. Circulating microRNAs in exosomes indicate hepatocyte injury and inflammation in alcoholic, drug-induced,and inflammatory liver diseases. Hepatology, 2012,56(5):1946-1957.
[16] Antoine DJ,Dear JW,Lewis PS,et al. Mechanistic biomarkers provide early and sensitive detection of acetaminophen-induced acute liver injury at first presentation to hospital.Hepatology, 2013,58(2):777-787.
[17] Watkins PB,Desai M,Berkowitz SD,et al. Evaluation of druginducedserious hepatotoxicity (eDISH):application of this dataorganization approach to phase III clinical trials of rivaroxabanafter total hip or knee replacement surgery. Drug Saf, 2011,34(3):243-252.
(收稿:2014-08-12)
(校对:陈从新)
Biomarkers in drug-induced liver injuries
Yu Yuecheng,He Changlun,Hou Jinlin.Liver Diseases Center of PLA,Jingdu Hospital,Nanjing 210002,China
Drug-induced liver injury;Biomarkers;Genomics;Metabolomics;Transcriptomics;Proteomics
10.3969/j.issn.1672-5069.2014.06.002
210002南京市解放军第81医院全军肝病中心(于乐成,何长伦);南方医科大学南方医院感染内科(侯金林)
于乐成,男,44岁,医学博士,博士后,主任医师,教授。E-mail:gslsycy@163.com

