金线吊乌龟的组织培养与快速繁殖技术研究
苗 爽, 袁卓婷,王长春,胡海涛
(浙江师范大学化学与生命科学学院,浙江 金华 321004)
金线吊乌龟(Stephania cepharanthaHayata)为防己科千金藤属多年生草质落叶藤本植物,其块根为民间常用草药,称白药、白药子或白大药,味苦性寒,有清热解毒、消肿止痛之功效,常用于治疗痈疽肿毒、腮腺炎、毒蛇咬伤等[1-2]。现代药理学试验表明,金线吊乌龟块根中含有多种生物碱[3-4],具有多种临床药理活性,如增强免疫调节、促进血管舒张、抗HIV-1、抗癌、抑制过敏性休克等功效[5-7]。随着药理学研究的深入,金线吊乌龟的开发应用和物种资源保护的矛盾将日益突出,开展金线吊乌龟的组培快繁非常必要。研究以种质快繁为目的,对金线吊乌龟组培快繁关键技术开展研究,以期为其种质资源的保护,以及其开发利用提供技术支撑。
1 材料与方法
1.1 材料及处理
金线吊乌龟的植株采自湖南衡山,种植在浙江师范大学生物园内。取其幼嫩的带腋芽茎段,去除叶片,先用清洁剂清洗,再用流水冲洗1 h,在超净工作台上用75 %乙醇处理1 min,0.1% HgCl2溶液处理10 min,再用无菌水清洗5次,将茎段切成长约2.0 cm的带腋芽茎段,接种到腋芽诱导培养基上。
1.2 培养基及培养条件
腋芽诱导培养基:1/2 MS+5 μmol/L KT+0.5 μmol/L NAA。继代增殖培养基:1/2 MS+(1.0、5.0、10.0、20.0)μmol/L KT +0.5 μmol/L NAA;1/2 MS+(1.0、5.0、10.0、20.0)μmol/L 6-BA+0.5 μmol/L NAA。生根培养基:1/4 MS+(1.0、5.0、10.0、20.0) μmol/L NAA+1.0 g/L活性炭。附加蔗糖30 g/L、琼脂粉6 g/L,pH值5.8,配制分装后,121℃灭菌20 min。培养温度为(26±2)℃,光照强度1 500 lx,光照时间16 h/d。
1.3 芽的增殖培养
取健壮、无菌的试管苗,剪成2.0 cm的带节小段,接种到增殖培养基中,每个处理接种6瓶,每瓶接种6个芽,定期观察记录,30 d统计丛生芽增殖系数。增殖系数的计算采用平均从一个芽上产生的新芽数。根据增殖系数分析各因素、各水平差异显著性,并对效果显著的因子做多重比较。
1.4 生根培养
选用苗高5 cm左右的小苗进行生根培养,每种处理6瓶,每瓶接种6株,3次重复,30 d统计生根情况。
1.5 生根苗的炼苗与移栽
生根培养基中培养30 d后,苗高5~8 cm、根系发达的生根苗,预先室内开盖炼苗3 d,小苗从培养瓶中取出后,用清水洗去根部残留的培养基,栽植于下列基质中,种后浇透水,适当保湿遮阴,30 d后统计成活率。
2 结果与分析
2.1 不同激素浓度配比对金线吊乌龟丛生芽增殖的影响
从表1中可以看出,在金线吊乌龟的组培快繁试验中, 6-BA对金线吊乌龟离体培养可能有毒害作用,即便在低浓度下也影响芽的诱导和增殖。KT为适宜的细胞分裂素,在添加KT的培养基上,丛生苗长势比较好,而且随着KT浓度的增加芽增殖倍数也相应提高,但KT浓度达20.0 μmol/L以上时诱导出的芽出现玻璃化现象。因此综合考虑,10 μmol/L KT,0.5 μmol/L NAA为适宜金线吊乌龟增殖培养的激素组合。
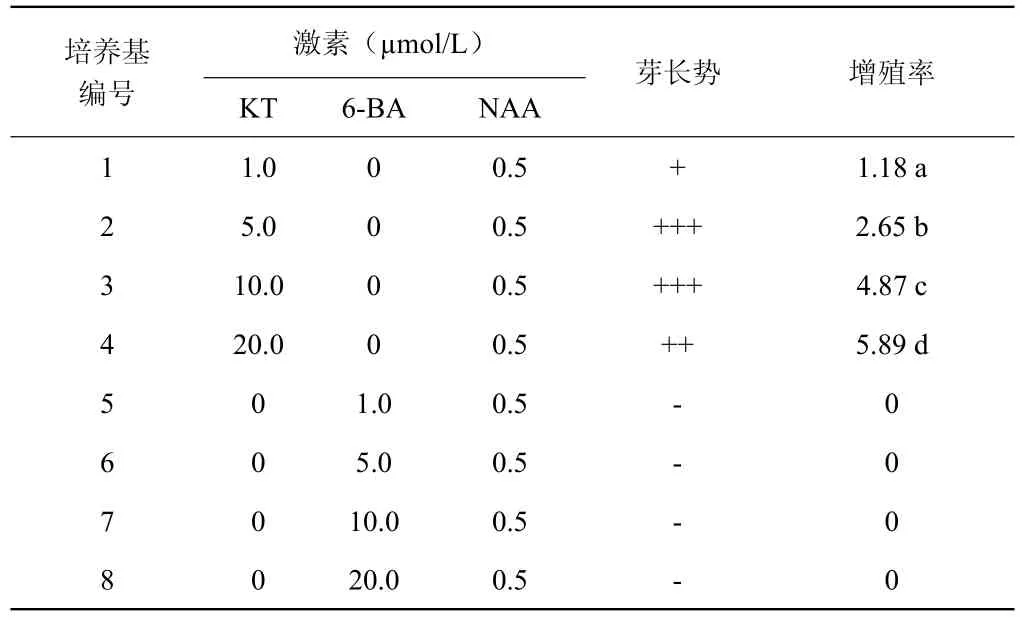
表1 不同激素浓度配比对金线吊乌龟丛生芽的增殖效果Table 1 Multiplication effects of different concentrations of hormones on cluster shoots of Stephania cepharantha Hayata
2.2 不同浓度的CCC对金线吊乌龟壮苗的影响
在离体培养中,生长抑制剂类物质可以使苗木矮化健壮,抑制过高生长,对培育壮苗、提高试管苗质量具有较好的效果。在1/2 MS+10 μmol/L KT+0.5 μmol/L NAA为基本培养基,附加不同浓度的CCC,培养30 d后,观察到不同浓度CCC处理均对试管苗的生长有抑制作用,且抑制作用随浓度增加而增强,植株明显变矮,叶色逐渐加深,苗木逐渐变粗,使用浓度以20.0 μmol/L CCC效果最好(见表2)。

表2 不同浓度CCC对金线吊乌龟壮苗的效果Table 2 Effects of different concentrations of CCC on strong shoots of Stephania cepharantha Hayata
2.3 不同浓度的NAA对金线吊乌龟生根的影响
表3显示,培养基中不同浓度的NAA对金线吊乌龟不定根诱导影响比较明显,生根率及根数随NAA浓度增高而升高,其中不加激素的培养基不能诱导生根,在15号培养基中的芽生根率为100%,平均根数为4.3条。虽然在16号培养基上接种的芽生根率比在15号培养基接种的芽生根率平均根数高,但诱导出来的根有部分表现出生长不正常,因此选择15号培养基作为金线吊乌龟的生根培养基。

表3 不同浓度NAA对金线吊乌龟生根的影响Table 3 Effects of different concentrations of NAA on plantlet rooting of Stephania cepharantha Hayata
3 小结与讨论
在建立经济植物组培快繁体系的研究中,为了达到快速繁殖的目的,通常需要在培养基中添加一定质量浓度的植物激素,培养基中添加的植物激素种类和浓度是决定组培快繁体系成功的关键。6-BA是经济植物组培快繁体系中常用的细胞分裂素,广泛应用于大多数植物组培快繁殖研究中,无论是诱导腋芽的萌动成苗,还是试管苗的增殖。然而在金线吊乌龟组培快繁中,发现6-BA的生物学效应与其在其他植物材料上的有明显区别。在添加了不同浓度6-BA的丛生芽增殖培养基上都不能诱导出丛生芽,即便是在较低浓度下,也出现新芽萎缩、难以伸长、难以长高等症状,严重影响金线吊乌龟植株的生长。黄宁珍等[8]在金线吊乌龟的同属植物广西地不容的组培快繁殖中也发现了类似的现象。一系列筛选试验表明,在金线吊乌龟的继代增殖过程中KT的效果明显优于6-BA,诱导出的丛生芽长势良好。在培养基中适当添加CCC能显著改善金线吊乌龟试管苗的品质,经适量质量浓度CCC处理,有利于金线吊乌龟形成壮苗及有效嫩茎的比例,可以提高金线吊乌龟的生根数量和移栽成活率。
试验以金线吊乌龟茎段作为外植体,获得了较高的增殖系数、生根率和移栽成活率,筛选出了金线吊乌龟快繁过程中各个阶段所需的适宜培养基,最佳丛生芽增殖培养基为1/2 MS+ 10 μmol/L KT + 0.5 μmol/L NAA+ 20 μmol/L CCC,芽苗生根的最适培养基为1/4 MS+ 10 μmol/L NAA 。该组织培养与快繁技术体系为金线吊乌龟快速育苗提供了技术支持。
[1] 中国科学院中国植物志编辑委员会. 中国植物志[M]. 北京:科学出版社,1996.
[2] 玉艳珍,邓业成,张 明,等. 中药植物金线吊乌龟对植物病原真菌的抗菌活性[J]. 植物保护,2010,36(2):123-126.
[3] 何 丽,张援虎,唐丽佳,等. 金线吊乌龟茎叶中生物碱的研究[J]. 中国中药杂志,2010,35(10):1272-1275.
[4] 何 丽,张援虎, 唐丽佳,等. 金线吊乌龟茎叶中生物碱的研究(Ⅱ)[J]. 中药材,2010, (10):1568-1570.
[5] Ryuji Ikeda,Xiao-Fang Che,Tatsuya Yamaguchi,et al.Cepharanthine potently enhances the sensitivity of anticancer agents in K562 cells. Cancer science,2005,96(6):372-376.
[6] Hailong Huang,Guixue Hu,Chunfeng Wang,et al.Cepharanthine,an Alkaloid from Stephania cepharantha Hayata,Inhibits the Inflammatory Response in the RAW264.7 Cell and Mouse Models. Infl ammation,2013,18:1-12.
[7] Moshe Rogosnitzky,Rachel Danks. Therapeutic potential of the biscoclaurine alkaloid, cepharanthine,for a range of clinical conditions. Pharma cological reports,2011,63:337-347.
[8] 黄宁珍,唐凤鸾,付传明,等. 广西地不容组培快繁研究[J]. 中草药,2007,38(3):445-449.

