胎盘蛋白13检测在子痫前期患者妊娠中晚期血清中的变化分析
汪琼华 颜瑜
子痫前期在妇产科临床上一种较为多见的妊娠并发病症,一般出现在孕妇妊娠20周以后,主要的临床表现为患者出血蛋白尿、高血压以及水肿等,同时伴有全身不同程度的损伤,严重患者甚至可能出现心力衰竭,抽搐,弥漫性血管内凝血以及胎盘早剥等严重并发症。随着医学的快速发展,已经有越来越多的研究表明,胎盘血管重铸发生障碍以及滋养细胞浸润不足是子痫前期病情发展的关键环节[1]。而近年的医学研究表明,胎盘蛋白13(placental protein 13,PP13)对于胎盘内血管的重铸形成以及滋养细胞的浸润起到重要的调节作用[2]。因此,本研究对本院收治的44例子痫前期患者的临床资料进行回顾性分析,探讨妊娠子痫前期患者血清中的胎盘蛋白13含量与孕妇妊娠孕周长短的变化关系,为进一步认识子痫前期的发病规律提供实验参考。现将结果报道如下。
1 资料与方法
1.1 一般资料 选取2010年12月-2012年12月本院收治的44例子痫前期患者,其中轻度子痫前期患者16例,重度子痫前期患者28例,同时选取30例正常健康孕妇进行对照。患者年龄22.3~36.8岁,平均(27.65±4.17)岁。其中29例患者为首次妊娠患者,15例患者为二次妊娠患者。三组研究对象的年龄、孕周等一般资料比较差异无统计学意义(P>0.05),具有可比性。所有研究对象均无慢性高血压、近期感染、心脏病、糖尿病以及肾脏病史[3]。
1.2 方法 对所有孕妇在不同孕周采用ELISA检测方法测定孕妇血清中的胎盘蛋白13(PP13)的含量,比较不同孕周的子痫前期患者以及正常妊娠孕妇的胎盘蛋白含量的变化。
1.3 研究对象血清胎盘蛋白13样品的收集与测定分别于试验设计的时间点(妊娠中晚期)对患者进行静脉采血3 mL,血液收集于管中,放置3 h后于3000转/min的条件下离心15 min,取上清液。血清样品在-80 ℃下保存。采用ELISA试剂盒测定,酶标仪在450 nm条件下测定吸光度[4]。具体测定方法:首先将ELISA试剂盒在室温中(22~25 ℃)放置半个小时,让其平衡。打开试剂盒从中取出固相载体反应板。将上述实验所需各种工作液在规定时间内配制好。在相对应的固相载体反应板的孔中加入100 μL标准品以及100 μL待测样品溶液。将酶标板封闭上盖,在37 ℃的环境中孵育90 min。待抗原抗体特异性结合反应完毕后,使用自动洗板机将酶标板中的液体吸收出去。
在反应板的每个孔中加入100 μL事先配制好的已被生物素标记的胎盘蛋白13抗体工作液。封闭酶标板,在37 ℃的环境中孵育1 h。使用实现配制好的PBS洗涤液对酶标板各个孔洗涤3次,每次加入PBS洗涤液需浸泡30 s。在反应板的每个孔中加入100 μL事先配制好的已和过氧化物酶结合的亲和素溶液。封闭酶标板,在37 ℃的环境中孵育半个小时。使用实现配制好的PBS洗涤液对酶标板各个孔洗涤5次,每次加入PBS洗涤液需浸泡1 min。
将显色剂四甲基联苯胺(TMB)加入酶标板的各个孔中,每孔90 μL,让反应体系在37 ℃的环境中反应15 min。显色剂四甲基联苯胺(TMB)加入之前要在37 ℃的环境中实现平衡半个小时。最后加入100 μL显色剂四甲基联苯胺(TMB)终止液。
按照上述步骤测定标准曲线上各个浓度的标准品的OD值,用以绘制标准曲线。标准品的浓度为纵坐标,各个浓度的标准品的OD值为横坐标。再在450 nm处测定待测样品的OD值,然后根据标准曲线得出相应的待测样品MMP-3的浓度。
1.4 统计学处理 采用SPSS 17.0统计学软件对数据进行处理,计量资料以(±s)表示,比较采用t检验,计数资料采用 字2检验进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 三组妊娠期胎盘蛋白13含量的比较 正常孕妇组血清中胎盘蛋白13的含量为(62.24±16.81)pg/mL,轻度子痫前期组(137.92±23.46)pg/mL,重度子痫前期组为(186.74±29.82)pg/mL。轻、重度子痫前期组血清中胎盘蛋白13的含量显著高于正常孕妇组,差异有统计学意义(P<0.05);且重度子痫前期组高于轻度子痫前期组,差异有统计学意义(P<0.05)。2.2 同组内妊娠中晚期血清中胎盘蛋白13含量的比较 同组内妊娠晚期血清中胎盘蛋白13的含量显著高于妊娠中期,差异有统计学意义(P<0.05);相对于妊娠中期,子痫前期组妊娠晚期孕妇血清中胎盘蛋白13含量的增加值显著高于正常孕妇组(P<0.05),见表1。
表1 同组内妊娠中晚期血清中胎盘蛋白13含量的比较(±s) pg/mL
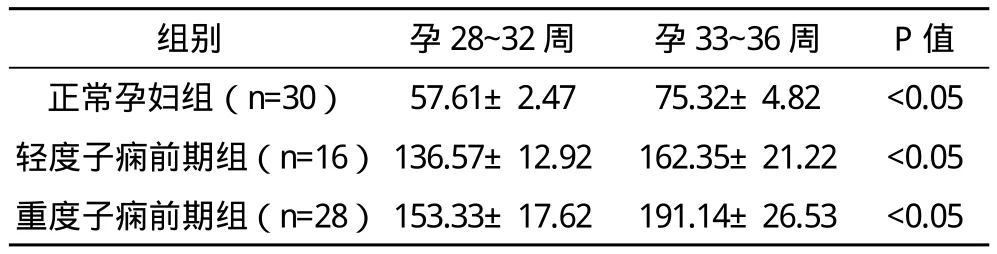
表1 同组内妊娠中晚期血清中胎盘蛋白13含量的比较(±s) pg/mL
组别 孕28~32周 孕33~36周 P值正常孕妇组(n=30) 57.61±2.47 75.32±4.82 <0.05轻度子痫前期组(n=16) 136.57±12.92 162.35±21.22 <0.05重度子痫前期组(n=28) 153.33±17.62 191.14±26.53 <0.05
3 讨论
近年来,子痫前期成为了导致围产儿死亡,孕妇不良预后的临床高危因素之一[5]。因此,子痫前期是妇产科病理学研究的重点研究内容[6-7]。目前,医学研究人员还无法完全清楚的阐释子痫前期的发病机制与确切的病因,关于子痫前期发病机制目前学术界比较认同的几种观点有,遗传学说、免疫机制、异常滋养细胞侵入肌肉层、血管内皮细胞受到损伤等等[8-9]。
胎盘蛋白13的主要生物学功能包括以下几点:(1)糖结合活性:有研究表明胎盘蛋白13和多种糖类的结合性较好,因此胎盘蛋白可以较为有力的凝集血红细胞。(2)磷酸化:胎盘蛋白13可以磷酸化,其磷酸化生物学过程可能与酪氨酸激酶有关。(3)溶血磷脂酶活性,胎盘蛋白13的该性质的具体生物学作用尚未明确,可能参与了种植,维持孕妇妊娠。(4)与β/γ肌动蛋白以及膜联蛋白相结合:目前认为膜联蛋白在成熟微绒毛以及胎盘分化的过程中起到了一定的作用[10]。
对于胎盘蛋白13在子痫前期患者血清中含量的变化,可能是由于子痫前期患者孕中期胎盘蛋白13的mRNA水平的下降,以及子痫前期中滋养层的细胞坏死,刷状缘膜显著减少。目前医学研究工作者普遍认为,胎盘蛋白13在胎儿发育过程中的几个方面都发挥了作用。有研究表明,胎盘蛋白13可以诱发钙离子介导的去极化过程,从而引起滋养层膜释放花生四烯酸以及亚油酸,以此作为底物加速前列环素以及血栓素的合成。子痫前期患者血清中的胎盘蛋白13提取物对于脂肪酸、促凝血素以及前列腺素的促进释放作用并不明显,从而引起胎盘中舒血管因子和缩血管因子的比例改变,最终导致胎盘病理的出现[11-12]。
本研究结果表明,重度子痫前期孕妇血清中的胎盘蛋白13的含量高于轻度子痫前期孕妇,子痫前期患者血清中的胎盘蛋白13的含量高于正常孕妇血清中蛋白13含量,随着妊娠时间的延长,孕妇血清内胎盘蛋白13的含量有所增高。
综上所述,孕妇血清中胎盘蛋白13的含量是随着孕周的增加而上升的,这与国外的研究结果保持一致。这也从另一个角度说明随着胎盘面积的不断增大,滋养细胞的凋亡数量也随着孕妇孕周时长增加而不断上升,滋养细胞由于不断的增殖和凋亡,周而复始,使得组织结构得以重铸,功能得到完善,妊娠可以正常的继续进行。同时本研究结果也说明了,胎盘蛋白13的异常表达,是造成孕妇子痫前期的重要关键因素。其在促进血管生成以及滋养细胞浸润的进程起着关键的作用。
[1]王瑜,张曦,程国梅,等.子痫前期患者胎盘组织中转化生长因子β1,血管细胞黏附分子1及E选择素表达的研究[J].中华妇产科杂志,2006,41(8):514-517.
[2] Than N,Abdul Rahman O,Magenheim R,et al.Plaeental protein 13 (galeetin-13) has deereased plaeental expression but inereased shedding and maternal serum concentrations in Patients presenting with preterm preeclampsia and HELLP syndrome[J].Virehows Arch,2008,453(4):387-400.
[3]张超,尹璐瑶,梁梅英,等.妊娠合并慢性再生障碍性贫血患者并发子痫前期的危险因素分析[J].中华妇产科杂志,2012,47(6):11-13.
[4]马向东,陈必良.筛查子痫前期的早期标志物—胎盘蛋白 13[J].国际妇产科学杂志,2009,36(3):35-37.
[5]贺同强,赵三纯.子痫前期临床发病相关因素研究进展[J].实用妇产科杂志,2012,28(10):25-28.
[6]谢恺俐.正常妊娠孕妇和子痫前期患者妊娠中晚期血清和胎盘中妊娠相关蛋白浓度的变化[J].安徽医药,2009,13(2):166-168.
[7]孙媛,陈丽君.胎盘蛋白13和glycodelin在子痫前期患者血清中的表达[J].山东大学学报:医学版,2010,48(4):130-132.
[8]徐佳,马向东.胎盘蛋白13与妊娠相关疾病[J].中国妇幼健康研究,2011,22(1):105-107.
[9]曾小燕,颜建英.胎盘蛋白13与子痫前期发病的研究进展[J].医学综述,2010,16(7):997-999.
[10]王晨虹,涂新枝,周璐,等.孕妇血清胎盘蛋白 13 水平变化对早发型重度子痫前期的预测价值[J].实用妇产科杂志,2010,26(10):781-783.
[11]吴星光,胡璇,刘增佑,等.子痫前期患者妊娠早晚期血清胎盘蛋白13变化的研究[J].血栓与止血学,2013,19(4):164-166.
[12]徐佳,马向东.胎盘蛋白13与妊娠相关疾病[J].中国妇幼健康研究,2011,22(1):105-107.

