131I全身扫描及18F-FDG PET/CT对分化型甲状腺癌术后转移诊治价值的比较
李永军 LI Yongjun
徐兆强 XU Zhaoqiang
柳 卫 LIU Wei
程 旭 CHENG Xu
包丽华 BAO Lihua
131I全身扫描及18F-FDG PET/CT对分化型甲状腺癌术后转移诊治价值的比较
李永军 LI Yongjun
徐兆强 XU Zhaoqiang
柳 卫 LIU Wei
程 旭 CHENG Xu
包丽华 BAO Lihua
目的探讨131I全身扫描(131I-WBS)及18F-FDG PET/CT在分化型甲状腺癌(DTC)术后转移诊治中的临床价值。资料与方法27例DTC术后需行131I初治或复治的患者,检测其131I治疗前1 d的血清甲状腺球蛋白(Tg),在131I治疗后3~5 d进行131I-WBS。根据Tg与131I-WBS阴性或阳性的情况,将患者分成4种类型:I型:Tg(+),131I-WBS(-);II型:Tg(+),131I-WBS(+);III型:Tg(-),131I-WBS(+);IV型:Tg(-),131I-WBS(-)。在131I-WBS后1周内行18F-FDG PET/CT。以术后组织病理学或至少6个月的临床和影像学随访结果为诊断病灶性质标准。分析131I-WBS及18F-FDG PET/CT对DTC术后患者转移的检出情况。结果检查后发现有22例52处病灶发生了转移。131I-WBS检出其中的8例(36.4%)24处(46.2%)转移灶,与18F-FDG PET/CT检出的15例(68.2%)35处(67.3%)转移灶比较,差异均有统计学意义(χ2=4.46、4.74, P<0.05)。I型13例(100.0%)、II型5例(100.0%)、III型3例(100.0%)、IV型1例(16.7%)发生了转移。I型18F-FDG PET/CT的转移检出率(100.0%)与II型(20.0%)、III型(0%)比较,差异均有统计学意义(P<0.05),与IV型(100.0%)比较差异无统计学意义(P>0.05)。其中对13例I型和1例IV型转移患者调整了治疗方案。结论131I-WBS和18F-FDG PET/CT在DTC术后患者转移灶探测及决定下一步的治疗方案方面具有良好的互补性,特别是18F-FDG PET/ CT在Tg(+)、131I-WBS(-)患者转移灶检出上更具有优势,有重要的临床指导意义。
甲状腺肿瘤;外科手术;肿瘤转移;碘放射性同位素;正电子发射断层显像术;体层摄影术,X线计算机;氟脱氧葡萄糖F18
目前国内外大多公认的分化型甲状腺癌(differentiated thyroid cancer, DTC)的综合治疗措施为甲状腺全切或近全切除术+术后131I内照射+甲状腺激素抑制治疗。甲状腺组织残留的多少、转移灶是否摄取131I及转移灶的多少和部位等,都关系到患者后续的治疗方案及预后,而这些大多要通过131I治疗后131I全身扫描(131I-whole body scan,131I-WBS)来实现[1]。但由于131I-WBS平面显像固有的缺陷,对病灶检出率低,尤其是在DTC的转移灶发生失分化后,其摄碘功能降低或丧失,131I-WBS已严重影响到对转移灶的诊断,给临床医师的判断和进一步治疗带来了极大困难[2,3]。近年关于18F-FDG PET/CT在甲状腺癌转移灶诊治中的临床应用逐渐增多[4,5],其联合131I-WBS检测甲状腺癌转移灶成为可能。本研究通过回顾27例DTC术后患者131I-WBS和18F-FDG PET/CT的相关检查,分析了两者在DTC转移灶诊治中各自的临床应用价值,现将结果报道如下。
1 资料与方法
1.1 研究对象 收集2010-05~2014-02南京医科大学第一附属医院核医学科收治的甲状腺全切或近全切除术、经病理证实为DTC需行131I初治或复治的27例患者,其中男11例,女16例;年龄18~71岁,平均(42.1±15.2)岁;甲状腺乳头状癌25例,滤泡状癌2例。所有患者或患者家属均于131I治疗前签署知情同意书。
1.2 仪器与方法 所有患者131I治疗前4~6周内低碘饮食,停服左旋甲状腺素,血清促甲状腺激素水平升至30 mU/L以上时在131I治疗的前1 d行甲状腺球蛋白(thyroglobulin, Tg)测定;口服131I 1.11~9.25 GBq进行治疗(甲状腺残灶清除1.11~3.70 GBq,局部复发/淋巴结转移5.55 GBq,肺转移5.55~7.40 GBq,骨转移7.40~9.25 GBq)[1]。口服131I后第3~5天行131I-WBS,而后1周内行全身18F-FDG PET/CT检查。
1.2.1 甲状腺Tg检测 所有患者在131I治疗前1 d清晨空腹采静脉血,离心取血清。采用罗氏E-601电化学发光仪,检测灵敏度为0.1~1000 μg/L,正常血清参考值为1.4~78.0 μg/L,>1000 μg/L者稀释后定量检测,血清Tg>10 μg/L即视为阳性,为131I治疗的指征[6]。
1.2.2131I-WBS 显像仪器为Siemens Medical Solutions Symbia T6,用高能平行孔准直器扫描,能峰360 keV,窗宽20%,检查床移动速度为10 cm/min,患者取仰卧位,经计算机处理获得131I-WBS前、后位图像。
1.2.318F-FDG PET/CT检查18F-FDG由GE公司的回旋加速器生产并通过自动合成模块自动合成,放化纯>95%。显像仪器为Siemens Biograph 16HR PET/ CT扫描仪。所有患者均禁食6 h以上,注药前空腹血糖≤7.0 mmol/L,按3.70~5.55 MBq/kg静脉注射18F-FDG,安静状态下药物在患者体内分布60 min后进行全身PET/CT检查。先进行CT扫描,扫描范围从颅顶到双侧股骨上段,扫描参数:管电压120 kV,管电流140 mAs,层厚5 mm,层距5 mm,矩阵512×512。再行相同范围PET显像,通常为6~8个床位,每个床位2 min,3D采集模式,应用CT数据进行衰减校正,迭代法重建,层厚5 mm,层距5 mm,最终获得横断面、矢状面、冠状面CT、PET及PET/ CT融合图像。沿浓聚灶边缘勾画感兴趣区,由工作站自动计算最大标准摄取值(maximum standardized uptake value, SUVmax)。
1.3 图像分析131I-WBS图像由2名熟知患者病情以及其他相关检查结果的核医学主任医师判读。在排除体表或体外的放射性污染和体内生理显影部位外,有放射性浓聚或增强灶高于体内本底水平者为阳性病灶;病灶部位以其所在的头部、颈部、胸部、腹盆部或上下肢大体部位判断。病灶数以部位来计算,如一侧肺弥漫性转移,或多个病灶融合则病灶数计为1。根据Tg与131I-WBS阴性或阳性情况,将患者分为以下4种类型:I型:Tg(+),131I-WBS(-);II型:Tg(+),131I-WBS(+);III型:Tg(-),131I-WBS(+);IV型:Tg(-),131I-WBS(-)。18F-FDG PET/CT图像经2名以上核医学主任医师共同阅片诊断,通过结合病灶SUVmax、解剖形态、患者原发性肿瘤侵犯包膜情况、淋巴结转移情况、颈部淋巴结清扫术和曾经131I治疗的情况等因素综合考虑得出定位、定性诊断。病灶计数同上。
1.4 诊断标准 以术后组织病理学或至少6个月的临床和影像学随访结果为诊断病灶性质的标准[7]。
1.5 统计学方法 采用SPSS 20.0软件,计数资料用相对数表示,两种方法检查结果比较采用χ2检验或Fisher确切概率法,P<0.05表示差异有统计学意义。
2 结果
2.1131I-WBS及18F-FDG PET/CT对DTC术后患者转移的检出情况 27例DTC术后行131I初治或复治的患者,通过术后组织病理学或至少6个月的临床和影像学随访结果,最终诊断发生转移22例(81.5%),52处转移灶:淋巴结43处,肺部6处,骨2处,脑组织1处。27例中有18例(66.7%)血清Tg为阳性,且全部发生了转移。因此在22例转移的患者中,Tg阳性18例(81.8%),5例未发生转移的Tg为阴性(Fisher确切概率法检验,P<0.05)。18F-FDG PET/CT检出的转移例数与转移病灶数与131I-WBS检出率比较,差异均有统计学意义(χ2=4.46、4.74, P<0.05),见表1。131I-WBS及18F-FDG PET/CT均检出的仅有1例(4.5%, 1/22)的7处转移灶(13.5%, 7/52)。

表1 两种检查方法对DTC术后患者转移检出情况比较[n(%)]
2.218F-FDG PET/CT对4种类型患者转移的检出率比较 I型13例,全部发生转移,18F-FDG PET/CT(+)13例(100.0%);Ⅱ型5例,全部发生转移,18F-FDG PET/CT(+)1例(20.0%),与I型比较差异有统计学意义(P<0.05);Ⅲ型3例,全部发生转移,18F-FDG PET/CT(+)0例,与I型比较差异有统计学意义(P<0.05);Ⅳ型6例,1例发生转移,转移患者18F-FDG PET/CT(+),与I型比较差异无统计学意义(P>0.05),见表2。根据18F-FDG PET/CT的阳性及131I-WBS的阴性检查结果,对I型的13例及Ⅳ型的1例转移患者的治疗方案进行了调整:采取了包括手术、外照射、维甲酸诱导分化、生长激素抑制素治疗、化疗或125I粒子植入等措施。

表2 各型患者18F-FDG PET/CT转移检出率比较
2.3 典型病例 患者1,男,60岁,双侧甲状腺乳头状癌术后,已行1次131I清除术后残余甲状腺治疗。本次停服左旋甲状腺素后,超敏促甲状腺激素>100 mU/L,Tg 988 μg/L,服用131I 6.66 GBq第2次治疗。服131I后第4天131I-WBS(-)(图1A),131I治疗后18F-FDG PET/CT显示左颈淋巴结肿大,放射性摄取增高,SUVmax 2.7,诊断为左颈部淋巴结转移(图1B~E),术后病理:甲状腺癌左颈部淋巴结转移(图1F)。
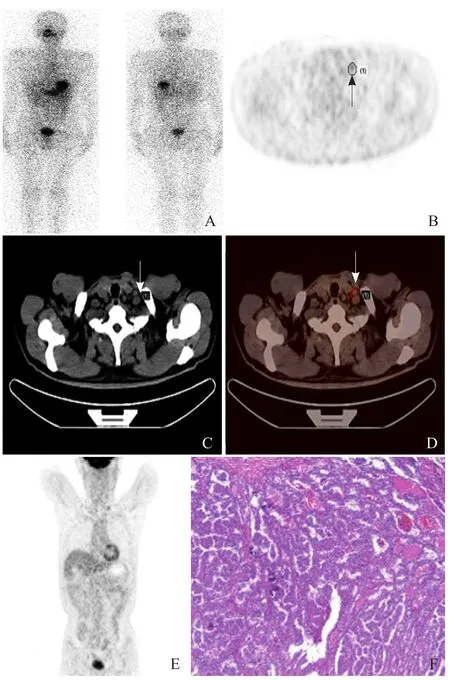
图1 男,60岁,甲状腺癌左颈部淋巴结转移。131I-WBS(-),左为前后位,右为后前位(A);18F-FDG PET/CT诊断为左颈淋巴结转移(箭,B~E);术后病理示甲状腺癌左颈淋巴结转移(HE, ×100, F)
患者2,女,30岁,甲状腺乳头状癌术后双肺转移已行2次131I治疗。本次停左旋甲状腺素后,超敏促甲状腺激素>100 mU/L,Tg 4.02 μg/L,但颈部B超高度提示右颈部淋巴结转移,服用131I 6.66 GBq第3次治疗。服131I后第4天131I-WBS(-)(图2A),131I治疗后18F-FDG PET/CT仅显示右颈部淋巴结稍大,放射性摄取不明显,SUVmax 1.4,不支持右颈部淋巴结转移的诊断(图2B~E),术后病理:右颈部淋巴结反应性增生(图2F)。
3 讨论
本次研究对DTC术后患者采用的治疗及随访方案是:以末次131I治疗时的Tg测量结果(停用甲状腺激素4~6周,超敏促甲状腺激素≥30 mU/L状态下)及131I-WBS作为主要参考指标协助诊断,并为后续治疗提供依据,直到治疗后的扫描结果阴性或131I摄取量极少[8]。血清Tg是由甲状腺组织特异性产生的,升高的血清Tg是检测甲状腺癌复发及转移的敏感指标[6,9]。DTC综合治疗后Tg升高只能说明存在DTC复发或转移灶,但不能作出定位诊断。在临床中,若患者Tg水平升高,131I治疗后行131I-WBS是寻找转移灶的首选,其诊断转移的机制是利用分化良好的甲状腺癌转移灶仍然具有像正常甲状腺对131I的摄取、有机化和代谢的生物学功能。临床上有10%~15%的DTC在转移过程中发生失分化引起细胞摄碘功能降低或消失,造成131I-WBS探测DTC转移灶时假阴性,但转移灶一般仍可分泌Tg[10,11]。文献报道,治疗量131I-WBS对DTC转移灶检出率为75.0%~89.9%[12]。本研究131I治疗后131I-WBS对DTC转移病例检出率为36.4%,病灶检出率仅为46.2%,比文献报道的明显偏低,究其原因可能与本研究中首次131I治疗的病例数较多(8/27),其残留较多的甲状腺组织摄取了大多数的131I,从而使转移灶对131I摄取相对降低,掩盖了131I-WBS发现转移灶的敏感性[10-12]。其次转移灶可能大多发生了失分化[13],也造成131I-WBS假阴性(14/22)。
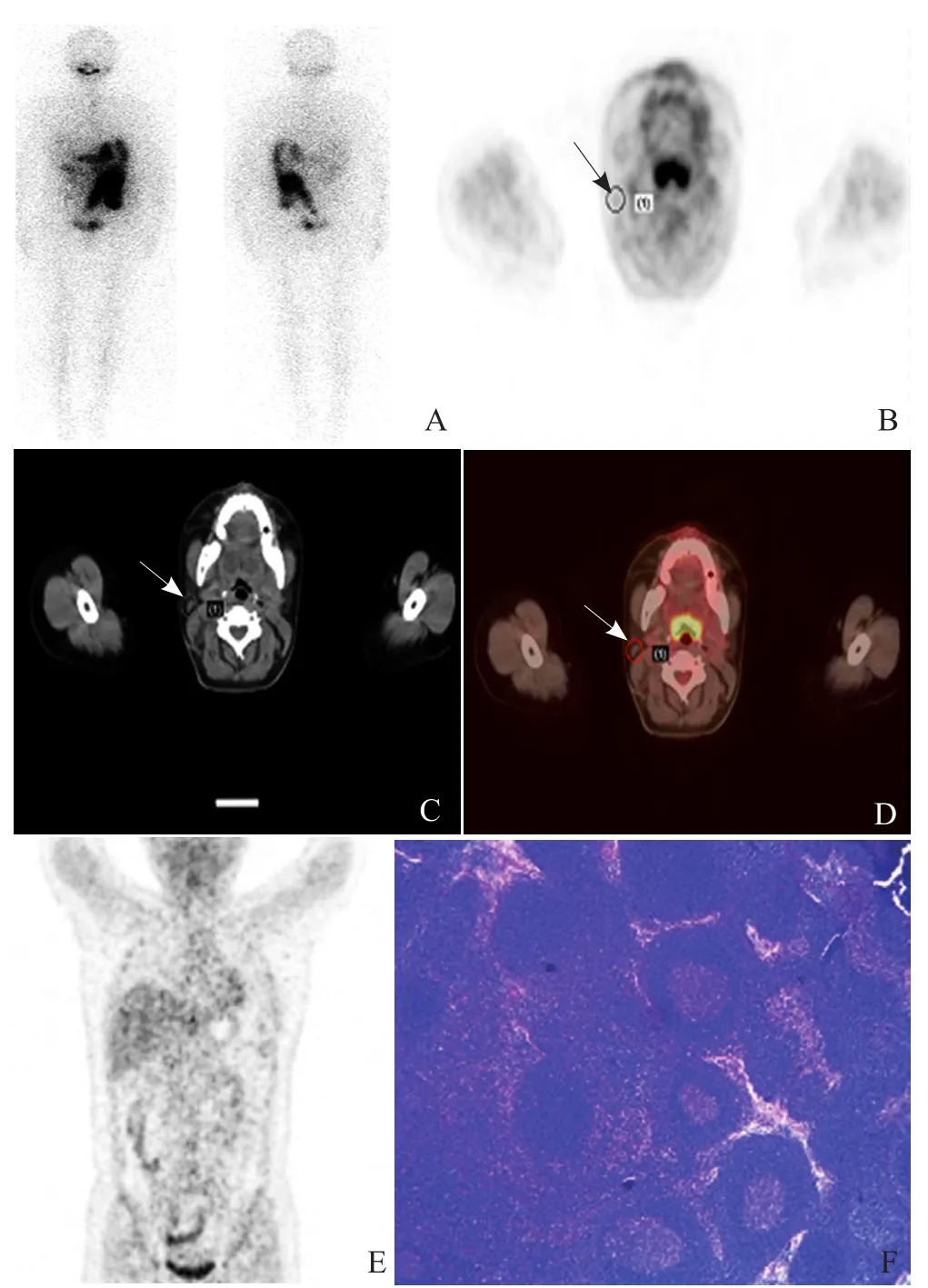
图2 女,30岁,右颈部淋巴结反应性增生。131I-WBS(-),左为前后位,右为后前位(A);18F-FDG PET/CT不支持右颈淋巴结转移,为增生淋巴结(箭,B~E);术后病理示右颈淋巴结反应性增生(HE, ×100, F)
近年18F-FDG PET/CT检测包括DTC在内的肿瘤是否复发、转移以及在对肿瘤放、化疗效果评价等方面有着独特的优势[14-16]。据报道[17]甲状腺癌病灶的131I摄取与18F-FDG的摄取存在着相反关系。甲状腺癌转移灶131I摄取的减少常伴随着18F-FDG摄取的增加,提示细胞的组织类型从分化向失分化转变[4]。因此,我们也尝试利用18F-FDG PET/CT监测失分化的转移病灶。因18F-FDG是葡萄糖类似物,静脉注射18F-FDG后,在肿瘤细胞葡萄糖转运蛋白帮助下通过细胞膜进入细胞,并在己糖基酶作用下磷酸化,生成6-磷酸18F-FDG。由于6-磷酸18F-FDG的2位碳原子上的羟基被脱掉氧,不能进一步代谢而滞留于非常活跃的恶性肿瘤细胞中。18F-FDG PET/CT不仅可以给出转移灶位置,而且能给出转移灶的恶性程度[18]。转移病灶恶性程度高是由于葡萄糖转运体表达增加,钠碘同向转运体表达减少[19]。本研究中,18F-FDG PET/CT对DTC转移病例检出率为68.2%,病灶检出率为67.3%,均高于131I-WBS,尤其在Tg升高而131I-WBS阴性的患者中有更重要的意义。有研究[20]表明当131I-WBS阴性Tg水平升高时,18F-FDG PET/CT的阳性预测值为92.0%;当131I-WBS阴性Tg水平不高时,18F-FDG PET/CT的阴性预测值为93.0%。本研究I型18F-FDG PET/CT的阳性预测值为100.0%,IV型18F-FDG PET/ CT的阴性预测值也为100.0%,基本与上述研究的结论一致。
本研究结果显示,根据Tg与131I-WBS阴性和阳性的情况,将DTC转移灶分为4种类型:当Tg水平与131I-WBS结果均为阳性,又表现为良好的匹配性时(Ⅱ型),可以据此判断转移灶的分化程度较好,能分泌Tg,具有摄碘功能,病灶以碘代谢为主,18F-FDG PET/CT不能比131I-WBS提供额外的信息,故不建议行18F-FDG PET/CT检查[14-16]。当Tg水平与131I-WBS结果均为阴性时(Ⅳ型),如临床上不支持转移的诊断,也不必进行18F-FDG PET/CT;如临床表现高度怀疑有转移,表明转移灶去分化较为明显,完全失去了分化型甲状腺癌细胞的生物学特点即同时失去Tg合成和摄碘功能,病灶转而以葡萄糖代谢为主时,行18F-FDG PET/CT对于明确诊断有很大的价值[21]。当Tg水平与131I-WBS结果不匹配时,一项为阳性,一项为阴性,即I型或Ⅲ型,预示着转移灶细胞可能发生了一定程度的失分化,尤其是当131I-WBS结果为阴性,Tg水平阳性即I型,能合成Tg但无摄碘功能,病灶以葡萄糖代谢为主,有必要进行18F-FDG PET/CT了解疾病进展程度和范围。而Ⅲ型尽管不能分泌Tg,但具有摄碘功能,病灶仍以碘代谢为主,131I-WBS阳性,这时18F-FDG PET/CT大多为阴性,故也不推荐行18F-FDG PET/CT[22]。因此从本研究可以明显看出摄131I的转移灶大多不摄取18F-FDG,所以131I-WBS和18F-FDG PET/CT在探测DTC术后转移灶诊断上各有特点,18F-FDG PET/CT并不能取代131I-WBS。因18F-FDG PET/CT价格昂贵,不适合作为检测DTC转移的常规手段,严格掌握好18F-FDG PET/CT适应证尤其必要[14-16,21,22],且临床上常根据两者显像结果决定患者下一步的治疗方案,如II型及III型转移灶可以继续采用131I治疗[23],I型及IV型转移灶由于不摄131I,131I治疗无效,可采取包括手术、外照射、维甲酸诱导分化、生长激素抑制素治疗、化疗或125I粒子植入等措施[5,18]。
总之,131I-WBS和18F-FDG PET/CT在DTC术后患者转移灶的探测及决定下一步治疗方案方面具有良好的互补性,特别是18F-FDG PET/CT在对Tg(+),131I-WBS(-)患者转移灶的检出上更具有优势,有重要的临床指导意义。但本研究同时亦存在一定的缺陷,主要是本研究的病例数只有27例,相对较少,因此下一步需扩大病例数并结合大规模临床试验进一步研究。其次18F-FDG PET/CT检查的价格昂贵,也在一定程度上限制了其在临床中的广泛应用。
[1] American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer, Cooper DS, Doherty GM, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer. Thyroid, 19(11): 1167-1214.
[2] 龙亚红, 丁勇, 方毅. SPECT/CT同机融合显像对分化型甲状腺癌转移灶诊治的增益价值. 中国医学影像学杂志, 2012, 20(10): 782-785.
[3] 栾兆生, 周雯, 唐为国, 等.131I SPECT/CT断层融合显像在分化型甲状腺癌中的临床价值. 中国医学影像学杂志, 2010, 18(1): 86-88.
[4] Dong MJ, Liu ZF, Zhao K, et al. Value of 18F-FDG-PET/ PET-CT in differentiated thyroid carcinoma with radioiodinenegative whole-body scan: a meta-analysis. Nucl Med Commun, 2009, 30(8): 639-650.
[5] Ozkan E, Aras G, Kucuk NO. Correlation of 18F-FDG PET/ CT findings with histopathological results in differentiated thyroid cancer patients who have increased thyroglobulin or antithyroglobulin antibody levels and negative 131I wholebody scan results. Clin Nucl Med, 2013, 38(5): 326-331.
[6] Chao M. Management of differentiated thyroid cancer with rising thyroglobulin and negative diagnostic radioiodine whole body scan. Clin Oncol (R Coll Radiol), 2010, 22(6): 438-447.
[7] 鹿存芝, 王跃涛, 曹苏生, 等. PET/CT诊断分化型甲状腺癌失分化患者复发及转移灶. 中国医学影像技术, 2009, 25(8): 1470-1472.
[8] 陈立波, 罗全勇, 余永利, 等. 甲状腺癌术后患者纵隔浓聚131I的临床分析. 中华核医学杂志, 2008, 28(2): 105-107.
[9] Na SJ, Yoo IR, O JH, et al. Diagnostic accuracy of (18) F-fuorodeoxyglucose positron emission tomography/computed tomography in differentiated thyroid cancer patients with elevated thyroglobulin and negative (131)I whole body scan: evaluation by thyroglobulin level. Annals of Nuclear Medicine, 2012, 26(1): 26-34.
[10] Berger F, Friedrich U, Knesewitsch P, et al. Diagnostic 131I whole-body scintigraphy 1 year after thyroablative therapy in patients with differentiated thyroid cancer: correlation of results to the individual risk profle and long-term follow-up. Eur J Nucl Med Mol Imaging, 2011, 38(3): 451-458.
[11] Maruoka Y, Abe K, Baba S, et al. Incremental diagnostic value of SPECT/CT with 131I scintigraphy after radioiodine therapy in patients with well-differentiated thyroid carcinoma. Radiology, 2012, 265(3): 902-909.
[12] Wang H, Fu HL, Li JN, et al. Comparison of whole-body 18F-FDG SPECT and posttherapeutic 131I scintigraphy in the detection of metastatic thyroid cancer. Clin Imaging, 2008, 32(1): 32-37.
[13] Ma C, Kuang A, Xie J, et al. Possible explanations for patients with discordant findings of serum thyroglobulin and 131I whole-body scanning. J Nucl Med, 2005, 46(9): 1473-1480.
[14] Miller ME, Chen Q, Elashoff D, et al. Positron emission tomography and positron emission tomography-CT evaluation for recurrent papillary thyroid carcinoma: meta-analysis and literature review. Head Neck, 2011, 33(4): 562-565.
[15] Kaneko K, Abe K, Baba S, et al. Detection of residual lymph node metastases in high-risk papillary thyroid cancer patients receiving adjuvant I-131 therapy: the usefulness of F-18 FDG PET/CT. Clin Nucl Med, 2010, 35(1): 6-11.
[16] Chatziioannou SN, Georgakopoulos AT, Pianou NK, et al. Recurrent thyroid cancer diagnosis: ROC study of the effect of a high-resolution head and neck 18F-FDG PET/CT scan. Acad Radiol, 2014, 21(1): 58-63.
[17] 张雅婧, 高再荣. PET/CT在“Tg阳性碘-131扫描阴性”分化型甲状腺癌中的临床应用进展. 中国医疗器械信息, 2011, 17(4): 8-12.
[18] Vural GU, Akkas BE, Ercakmak N, et al. Prognostic signifcance of FDG PET/CT on the follow-up of patients of differentiated thyroid carcinoma with negative 131I wholebody scan and elevated thyroglobulin levels: correlation with clinical and histopathologic characteristics and long-term follow-up data. Clin Nucl Med, 2012, 37(10): 953-959.
[19] Min JJ, Chung JK, Lee YJ, et al. Relationship betweenexpression of the sodium/iodide symporter and 131I uptake in recurrent lesions of differentiated thyroid carcinoma. Eur J Nucl Med, 2001, 28(5): 639-645.
[20] Kunawudhi A, Pak-art R, Keelawat S, et al. Detection of subcentimeter metastatic cervical lymph node by 18F-FDG PET/CT in patients with well-differentiated thyroid carcinoma and high serum thyroglobulin but negative 131I whole-body scan. Clin Nucl Med, 2012, 37(6): 561-567.
[21] Choi JW, Lee JH, Baek JH, et al. Diagnostic accuracy of ultrasound and 18-F-FDG PET or PET/CT for patients with suspected recurrent papillary thyroid carcinoma. Ultrasound Med Biol, 2010, 36(10): 1608-1615.
[22] Bannas P, Derlin T, Groth M, et al. Can (18)F-FDG-PET/CT be generally recommended in patients with differentiated thyroid carcinoma and elevated thyroglobulin levels but negative I-131 whole body scan? Ann Nucl Med, 2012, 26(1): 77-85.
[23] Ma C, Xie J, Kuang A. Is empiric 131I therapy justified for patients with positive thyroglo bulin and negative 131I wholebody scanning results? J Nucl Med, 2005, 46(7): 1164-1170.
(本文编辑 冯 婕)
Comparison of131I-whole Body Scan and18F-FDG PET/CT on the Metastatic Management of Differentiated Thyroid Cancer After Operation
PurposeTo explore the clinical value of131I-whole body scan (131I-WBS) and18F-FDG PET/CT on the metastatic management of patients with differentiated thyroid cancer (DTC) after operation.Materials and MethodsSerum thyroglobulin (Tg) of 27 patients after DTC surgery was measured one day before131I therapy, and the patients underwent131I-WBS on 3-5 days after131I therapy. According to the results of Tg and131I-WBS, all the patients were divided into 4 types as follows: type I: Tg (+),131I-WBS (-); type II: Tg (+),131I-WBS (+); type III: Tg (-),131I-WBS (+); and type IV: Tg (-),131I-WBS (-). Then the patients received18F-FDG PET/CT scan within a week after131I-WBS. The results of131I-WBS and18F-FDG PET/CT scan were analyzed according to histopathologic findings or clinical and imaging follow-up of at least 6 months as diagnosis standard.ResultsThe examinations uncovered that metastasis occurred in 52 lesions of 22 cases out of the 27 cases.131I-WBS revealed 24 metastatic lesions (46.2%) in 8 cases (36.4%), and18F-FDG PET/CT showed 35 metastatic lesions (67.3%) in 15 cases (68.2%), the difference with statistic signifcance (χ2=4.46 and 4.74, P<0.05). Metastasis were confrmed in 13 type I cases (100.0%); 5 type II cases (100.0%); 3 type III cases (100.0%) and 1 type IV case (16.7%), respectively. The rate of detecting metastasis by18F-FDG PET/CT was 100.0% in type I, 20.0% in type II, 0% in type III respectively, the difference with statistic signifcance (χ2=9.14 and 10.11, P<0.05); and 100.0% in type IV, the difference without statistic signifcance (χ2=1.25, P>0.05). Based on that, therapeutic plans were modified for 13 patients with type I metastasis and 1 patient with type IV metastasis.Conclusion131I-WBS and18F-FDG PET/CT are complementary for detecting metastatic lesion and help to decide the following treatment of DTC patients after surgery. Moreover,18F-FDG PET/CT shows advantages in detecting metastatic lesion in Tgpositive and negative131I-WBS type of DTC patients after surgery, thus can provide an important clinical guidance for this type of patients.
Thyroid neoplasms; Surgical procedures, operative; Neoplasm metastasis; Iodine radioisotopes; Positron-emission tomography; Tomography, X-ray computed; Fluorodeoxyglucose F18
南京医科大学第一附属医院核医学科 江苏南京 210029
包丽华
Department of Nuclear Medicine, the First Affliated Hospital of Nanjing Medical University, Nanjing 210029, China
Address Correspondence to: BAO Lihua E-mail: lihuabao@126.com
R736.1;R445.5
2014-05-08
2014-10-16
中国医学影像学杂志
2014年 第22卷 第11期:805-810
Chinese Journal of Medical Imaging
2014 Volume 22(11): 805-810
10.3969/j.issn.1005-5185.2014.11.002

