兔创伤性脑外伤质子磁共振波谱成像研究
肖 勇 XIAO Yong
夏建国 XIA Jianguo
周 仪 ZHOU Yi
兔创伤性脑外伤质子磁共振波谱成像研究
肖 勇 XIAO Yong
夏建国 XIA Jianguo
周 仪 ZHOU Yi
目的探讨质子磁共振波谱成像(1H-MRS)技术连续检测兔脑外伤模型伤后2周内脑内代谢改变及动态演变的价值。材料与方法中国大白兔15只,随机分为对照组(假手术组)5只和损伤组10只,分别于伤后1 h、6 h、24 h、48 h、168 h、336 h进行1H-MRS检测,观察代谢物N-乙酰天门冬氨酸(NAA)、肌酸(Cr)、胆碱(Cho)及NAA/Cr、Cho/Cr比值的变化情况。分别于伤后6 h、24 h、168 h 各取1只兔,经腹麻后处死,经左心插管灌注固定,取脑,修块,脱水,做冰冻切片,行HE染色并观察。结果与对照组相比,伤后1 h外伤区NAA/Cr下降29%,伤后24 h NAA/Cr下降40%,达最低值,随后有所升高,外伤168 h后相对稳定。伤后1 h外伤区Cho/Cr下降16%,伤后6 h Cho/Cr下降30%,达到最大降幅,其后逐渐升高,168 h后超过对照组约20%,此后相对稳定。各观察时间点NAA/Cr、Cho/ Cr变化差异均有统计学意义(P<0.05)。结论1H-MRS可以无创性地动态检测脑外伤后脑组织代谢的变化情况,比常规MRI更早发现颅内异常改变,其中以NAA/Cr最为敏感。检测外伤区NAA/Cr、Cho/Cr的变化对临床评估治疗效果有指导意义。
脑损伤;磁共振成像;磁共振波谱学;胆碱;N-乙酰天门冬氨酸;肌酸;疾病模型,动物;兔
创伤性颅脑损伤(traumatic brain injury, TBI)是儿童和年轻人致残和死亡的主要原因。目前临床评分及常规影像学检查均难以准确预测TBI外伤后功能恢复程度、致残可能性、认知及其他功能状态[1]。质子磁共振波谱成像(1H proton magnetic resonance spectroscopy,1H-MRS)技术是一种利用磁共振现象和化学位移作用对体内特定原子核和化合物进行定性定量分析的影像学检查方法,是目前唯一非侵袭性的活体生化定量检测方法,已广泛应用于脑肿瘤、脱髓鞘病变、儿童遗传代谢性脑病等多种中枢神经系统疾病的临床研究[2]。脑外伤的1H-MRS研究亦受到国内外学者的广泛关注,已有关于兔脑轻型脑损伤模型功能
MRI的研究[3],但尚无关于兔脑中重度外伤的1H-MRS系统性研究。本研究通过建立自由落体兔脑外伤模型,在伤后1~336 h于不同时间点进行1H-MRS检测,观察代谢物N-乙酰天门冬氨酸(N-acetylaspartate, NAA)/肌酸(creatine, Cr)、胆碱(choline, Cho)/Cr随时间的变化规律,了解脑外伤后脑细胞变性死亡的演变过程,探讨1H-MRS在TBI的早期诊断及疗效评估中的应用价值和前景。
1 材料与方法
1.1 实验动物及脑外伤模型的建立 中国大白兔15只,雌雄不限,体重2.0~3.0 kg,随机分为对照组5只和实验组10只,由南通大学医学院动物中心提供。
实验兔以3%戊巴比妥钠3 mg/kg经腹腔注射麻醉。将实验兔俯卧固定于实验台上,剪去顶部兔毛,碘伏消毒,沿中线切开头皮3.5 cm, 暴露颅骨,取眶后缘连线与中线交点偏左1.2 cm处,用颅骨钻磨去部分颅骨后用弯钳扩开一直径约0.8 cm的骨窗,保持硬脑膜完整。参照Feeney等[4]的脑自由落体撞击致脑挫伤的方法,撞击锤直径0.5 cm,重50 g,沿不锈钢管下落50 cm,垂直打击于脑表面,造成左侧顶叶脑组织挫伤。然后用骨水泥封闭骨窗,缝合头皮,手术结束。对照组除脑组织不撞伤外,其余步骤与实验组一致。分别于伤后1 h、6 h、24 h、48 h、168 h、336 h进行1H-MRS检测。分别于伤后6 h、24 h、168 h各取1只兔处死后进行病理学观察。
1.2 自制帽型线圈[5]取空心圆柱体120°的圆弧,直径75 mm,长80 mm,高90 mm,线圈品质因素(Q)98,频率127.74 MHz,阻抗50 Ω。自制帽型线圈见图1。

图1 自行研制的兔脑表面线圈
1.3 MRI检查 采用GE 3.0T(Signa Excite II HD, GE Medical System)超导MRI仪。将兔四肢固定于自制动物架上,头部置于线圈中心,并固定于动物架头槽内,线圈紧贴于兔头部,线圈基底固定于动物架上,以视交叉为中心行冠状位扫描。先进行3-pl Loc扫描确定位置和范围,然后分别进行常规冠状位T1WI、T2WI、 DWI扫描及T2WI矢状位、轴位扫描。
1.41H-MRS检查 对兔脑外伤模型和对照组兔脑在不同时间点进行 MRS扫描,扫描参数:TR=1000 ms,TE=135 ms,矩阵18×18,视野12 cm,激励次数1,层厚8.2 mm,层间距10 mm,成像时间5'28''。将扫描所得图像于AW 4.2工作站进行后处理,观察外伤区代谢物NAA、Cho、Cr的浓度,并测量外伤区的NAA/ Cr、Cho/Cr比值。
1.5 病理学检查 分别于伤后6 h、24 h、168 h 各取1只兔,经腹腔注射3%戊巴比妥钠3 mg/kg,开胸,经心尖将穿刺针插入主动脉根部,先灌注生理盐水1000 ml冲洗循环系统血液,再缓慢灌注10%甲醛溶液1000 ml固定组织,完整取出全脑,肉眼观察脑部变化,然后置于10%甲醛溶液内固定48 h,修块,脱水,做冰冻切片,行HE染色并观察。
1.6 统计学方法 采用SPSS 10.0软件,损伤区域的代谢物比率与对照组比较、不同时间点之间的代谢物比率比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 脑损伤后动物反应 打击瞬间,动物肢体痉挛抽搐,呼吸浅快;动物苏醒后行动迟缓,右侧肢体行动障碍;24 h后,动物生理反应完全恢复正常,但其右侧肢体存在不同程度的行动障碍,其中5例表现为烦躁不安,有攻击倾向。
2.2 常规MRI表现及MRS表现 外伤早期常规MRI未见明显异常表现(图2A、B)。外伤2 h后损伤侧顶叶可见明显异常信号,在T1WI上呈低信号或等信号,在T2WI上显示为高信号(图2C、D)。对照组手术同侧NAA/Cr为2.11±0.18,Cho/Cr为1.38±0.27,各时间点比较差异无统计学意义(P>0.05)。分别于外伤后6个时间点行MRS跟踪检查,结果见表1,典型波谱见图3。

图2 兔脑冠状位常规MRI图像。A、B为打击伤后1 h显示外伤区域脑组织信号正常;C、D为打击伤后2 h显示外伤区域T1WI呈等、低信号,T2WI呈高信号

表1 两组大白兔NAA/Cr、Cho/Cr各时点均值比较

图3 外伤后1 h、6 h、24 h、48 h、168 h、336 h典型谱线(A~F);NAA: N-乙酰天门冬氨酸;Cr:肌酸;Cho:胆碱
实验组NAA/Cr伤后1 h即出现下降,此后随着时间的延长NAA/Cr逐渐降低,伤后24 h达最低值,较对照组下降40%。48 h后NAA/Cr逐渐上升,伤后168 h较对照组下降17%,与伤后336 h比较差异无统计学意义(P>0.05),与对照组间差异有统计学意义(P<0.05),见图4。实验组损伤侧顶叶Cho/Cr伤后1 h较对照组下降16%。伤后6 h达最大降幅,与对照组比较差异有统计学意义(P<0.05),其后出现不同程度的恢复,伤后168 h Cho/Cr超过对照组约20%。伤后336 h与伤后168 h时无明显差异,与对照组间差异有统计学意义(P<0.05),见图5。在损伤的对侧及胼胝体区亦检测到异常谱线,NAA/Cr、Cho/Cr变化幅度比损伤侧小,但变化规律与损伤侧相仿,168 h后基本恢复正常。

图4 NAA/Cr伤后不同时间点的变化
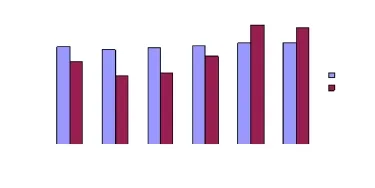
图5 Cho/Cr伤后不同时间点的变化
2.3 外伤后病理学变化 于伤后6 h、24 h、168 h处死动物后,取出脑组织,大体可见到打击处硬膜下血肿,剔除血肿后可见脑组织肿胀。HE染色显示对照组脑组织无明显异常变化;伤后6 h损伤区光镜下可见神经元出现不同程度的肿胀,并见大片出血灶。伤后24 h损伤区可见胶质细胞周围大量炎症细胞浸润,变性神经元周围出现空泡。伤后168 h损伤区可见大量变性坏死的胶质细胞,而炎症细胞浸润明显减少,见图6。常规MRI图像显示,伤后6 h外伤区域可见明显异常信号,呈长T1长T2信号,伤后24 h异常信号面积增大,MRS显示NAA峰下降达最大幅度,伤后168 h外伤区域异常信号面积有所减小,同时所检测NAA峰有所回升。常规MRI表现及MRS检查结果与病理结果一致。
3 讨论
3.1 动物模型的选择 在脑损伤实验研究中,选择合适的实验动物并制作可靠的动物模型是实验成功的前提条件,目前创伤性脑损伤动物模型主要包括自由落体撞击伤模型、液压冲击伤模型、加速损伤模型等[6]。自由落体撞击伤模型中以Marmarou模型装置[7]和Feeney模型装置应用较为广泛。高燕等[8]通过改进Feeney自由落体模型装置建立了脑损伤分级定量模型,本实验模型装置亦采用类似方法。国内外实验性脑外伤文献报道中大多采用大鼠作为实验动物,考虑到大鼠脑体积较小,对于实验的耐受性较差,MRS结果容易受到干扰,本实验研究采用家兔作为实验动物模型,利于长期观察,并有效提高MRS结果的准确性和稳定性。

图6 外伤后大体可见打击面上血肿(A);B为正常兔脑切片HE染色(×100);外伤6 h病理镜下可见散在片状出血区(HE, ×100, C);外伤24 h镜下可见胶质细胞增生,多量炎症细胞浸润(HE, ×100, D);外伤168 h镜下可见变性坏死的胶质细胞,炎症细胞浸润较前明显减少(HE, ×100, E);外伤后24 h镜下可见变性的神经元周边出现空泡(HE, ×400, F)
3.2 兔脑表面线圈的研制 既往研究常用人体线圈进行兔和大鼠的脑MRI研究[9]。用8通道膝关节线圈和头部线圈可以得到常规T1WI、T2WI图像,而无法得到稳定的MRS谱线。本研究中,针对兔脑的形状大小定制合适的帽型表面线圈,不但改进了T1WI、T2WI图像的质量,而且大大提高了MRS的灵敏度和信噪比。
3.3 MRS在TBI诊断中的意义1H-MRS可以检测到脑组织内特定代谢物浓度的细微变化,能够反映TBI在常规影像学检查中无法显示的病理改变[1]。1H-MRS检测的脑代谢产物主要包括NAA、Cho、肌醇、Cr、乳酸、移动脂肪、丙胺酸、谷氨酸类化合物等。在对TBI的检测中,常检测的化合物有NAA、Cho、Cr、乳酸。
NAA是正常脑组织1H-MRS上最高的代谢峰,其波峰的位置在2.02 ppm,是正常神经元的标志物,也是神经轴突的标志物,主要由线粒体产生,在大脑皮层NAA主要位于神经元胞体内,在脑白质主要存在于轴突内,其含量的多少可以反映神经元的功能状态,凡是对脑组织有损伤的疾病均可以导致NAA峰降低[2]。 Cr在MRS上是一种能量标志物,波谱位于3.0 ppm附近,是由肌酸和磷酸肌酸组成,缺氧、卒中、肿瘤均可导致Cr峰减低。而在创伤的高渗状态下,脑白质区可以见到代谢异常,即以Cr峰增高为特征[10]。Cr是正常脑MRS第三高峰波,且非常稳定,常作为内部参照。然而也有研究认为在评估神经化学改变时计算代谢物的绝对浓度要比计算代谢物与肌酸的相对比值要精确,但在广泛的神经轴索损伤时,由于局部细胞内的水分增加,代谢物的绝对浓度就不能准确地反映组织损伤的程度。而且代谢物的绝对浓度会因个体的功能状态不同而出现很大的波动,这对数据的统计分析产生干扰,常影响结果的准确性,因此本次实验也采用代谢物与肌酸的相对比值进行评估。
本实验发现在损伤后1 h即可检测到NAA峰下降,此时在常规T1WI、T2WI图像中尚未见到明显异常信号,由此可见对于脑外伤患者进行MRS扫描可以发现更早期的脑损伤病灶。NAA/Cr下降多认为是神经元的不可逆损伤,亦可能与神经元功能下降以及细胞内外水肿有关。Smith等[11]对活体猪脑外伤模型的MRS研究发现NAA/Cr较正常对侧下降20%。本研究中损伤24 h后NAA/Cr下降达最大值,随后比值有所升高,外伤168 h后比值相对稳定。NAA/Cr的部分恢复提示脑外伤并非完全不可逆的损伤,反映了损伤神经元代谢性改变具有一定的可复性。
Cho的频谱横坐标位置位于3.20 ppm,参与细胞膜的构成,是反映髓鞘形成、细胞代谢和胶质增生的指标。Cho上升代表组织破坏、修补或炎症反应。例如在创伤、肿瘤、糖尿病等疾病中Cho的绝对浓度会上升。George等[12]对轻型颅脑损伤的研究发现,Cho/Cr比值的下降程度与认知功能的减退呈正相关。本研究发现与对照组相比,Cho/Cr伤后1 h出现降低,考虑可能与外伤导致细胞坏死以及数量减少有关,在伤后6 h比值达到最低值,其后比值逐渐升高,168 h后比值超过对照组约20%。Cho/Cr升高可能与外伤后细胞损伤导致髓鞘降解和神经胶质细胞增生有关,说明损伤在一定范围内脑组织具有潜在的修复能力。此外,本次实验采用的是开颅手术,局部脑组织对手术的反应性炎症反应可能也是引起Cho/Cr升高的因素之一,至于早期Cho/Cr下降可能提示损伤较重,导致细胞坏死丢失比局部炎症反应引起的Cho改变更明显。
Lac的频谱横坐标位置在3.05 ppm,Lac是组织缺血缺氧的间接标志,与能量代谢有关,反映了细胞的能量状态。本实验中,在外伤后的MRS谱线中0.80~1.57 ppm均出现了高低不等的乳酸和移动脂肪的重合峰,但其变化不稳定,故未进行统计分析。
3.4 MRS在临床TBI中的应用价值、局限性及展望本研究探讨了TBI不同时间点MRS变化特点,其中NAA/Cr的变化最为敏感。通过MRS了解TBI的病理生理变化过程对于脑外伤的早期诊断及疗效评估有积极意义。本研究以家兔为研究对象,虽然兔脑比之前广为研究的大鼠脑体积要大,提高了MRS的精确性和可靠性,但与人脑相比还是相差很大,今后可以考虑用猪或者灵长类动物作为动物模型,这样更接近于人脑外伤的研究,可以提高实验结果的可应用性。随着MRI新技术的不断发展完善,MRI必将在TBI的临床诊断和治疗方面发挥更为广泛的作用。
[1] Sivák Š, Bittšanský M, Grossmann J, et al. Clinical correlations of proton magnetic resonance spectroscopy findings in acute phase after mild traumatic brain injury. Brain Inj, 2014, 28(3): 341-346.
[2] Oz G, Alger JR, Barker PB, et al. Clinical proton MR spectroscopy in central nervous system disorders. Radiology, 2014, 270(3): 658-679.
[3] 欧阳林, 肖玉辉, 何平. 斜坡滑动撞击建立兔轻型脑损伤模型及功能MRI实验研究. 中国医学影像学杂志, 2011, 19(8): 608-612.
[4] Feeney DM, Boyeson MG, Linn RT, et al. Responses to cortical injury: I. Methodology and local effects of contusions in the rat. Brain Res, 1981, 211(1): 67-77.
[5] 王秀彬, 肖勇, 景宏美. 帽型线圈进行兔脑磁共振成像的初步研究. 实用放射学杂志, 2013, 29(8): 1334-1337.
[6] 初殿伟, 王玮, 杨术旺. 创伤性脑损伤的动物模型. 武警医学院学报, 2008, 17(7): 642-644.
[7] Marmarou A, Foda MA, Van Den Brink W, et al. A new model of diffuse brain injury in rats. Part I: Pathophysiology and biomechanics. J Neurosurg, 1994, 80(2): 291-300.
[8] 高燕, 孙骏谟, 田志雄, 等. 大鼠创伤性脑损伤质子磁共振波谱研究. 临床放射学杂志, 2004, 23(5): 432-437.
[9] 杨艳艳, 刘家传, 张永明, 等. 颅脑爆震伤后兔脑内代谢变化的磁共振波谱研究. 中华创伤杂志, 2011, 27(4): 375-378.
[10] Danielsen ER, Ross B. Magnetic resonance spectgroscopy diagnosis of neurological disease. New York: Marcel Dekker, 1999: 120-146.
[11] Smith DH, Cecil KM, Meaney DF, et al. Magnetic resonance spectroscopy of diffuse brain trauma in the pig. J Neurotrauma, 1998, 15(9): 665-674.
[12] George EO, Roys SR, Sours C, et al. Longitudinal and prognostic evaluation of mild traumatic brain injury: A 1H-magnetic spectroscopy study. J Neurotrauma, 2014, 31(11): 1018-1028.
(本文编辑 张春辉)
1H-MR Spectroscopy of Traumatic Brain Injury in Rabbits
PurposeTo evaluate1H proton magnetic resonance spectroscopy (1H-MRS) in detecting traumatic brain injury (TBI) and its metabolic changes during the initial two weeks after trauma using rabbit modes.Materials and MethodsFifteen Chinese rabbits were randomly divided into sham control group (n=5) and TBI group (n=10),1H-MRS was performed 1 hour, 6 hours, 24 hours and 2 days, 7 days, 14 days after trauma, the concentration of N-acetylaspartate (NAA), creatine (Cr), choline-compound (Cho), NAA/ Cr and Cho/Cr in each group was evaluated. At 6 hours, 24 hours and 168 hours after injury, 1 rabbit was slaughtered after abdominal anesthesia at each time point, the sample was fxed with left heart catheterization perfusion after death, brain tissue was obtained, blocked, dehydrated into frozen section, HE staining was used for observation.ResultsCompared with the control group, NAA/Cr ratio in the trauma region decreased by 29% 1 hour after trauma, with maximal reduction of 40% (at 24 hours) before increasing slightly, the NAA/Cr ratio returned to control level gradually until 168 hours later. The Cho/Cr ratio decreased by 16% 1 hour after trauma, with maximal reduction of 30% (at 6 hours) and increased gradually until finally surpassed control level (168 hours) for 20% and then became stable. NAA/Cr ratio and Cho/Cr ratio showed statistically significant changes between each observing time point (P<0.05).Conclusion1H-MRS can be used for dynamic detection of cerebral metabolism without injury, and is superior to MRI in detecting early abnormality of the brain, with NAA/Cr as the most sensitive parameter. Detecting the changes of NAA/Cr, Cho/Cr ratios in the trauma region can be used as a guide for assessment of the clinical treatment effectiveness of TBI.
Brain injuries; Magnetic resonance imaging; Magnetic resonance spectroscopy; Choline; N-acetylaspartate; Creatine; Disease models, animal; Rabbits
盐城市第一人民医院磁共振室 江苏盐城224005
周 仪
Department of MRI, Yancheng First People's Hospital, Yancheng 224005, China
Address Correspondence to: ZHOU Yi
E-mail: 30539808@qq.com
R-33;R651.15
2014-04-09
修回日期:2014-08-09
中国医学影像学杂志
2014年 第22卷 第9期:645-649
Chinese Journal of Medical Imaging
2014 Volume 22(9): 645-649
10.3969/j.issn.1005-5185.2014.09.002

