碘泰牛乳头消毒剂药浴效果评价
王 乐,操国景,曹 杰
(1.中国农业大学动物医学院,北京 100193;2. 泰华施贸易(上海)有限公司,上海 200120)
碘泰牛乳头消毒剂药浴效果评价
王 乐1,操国景2,曹 杰1
(1.中国农业大学动物医学院,北京 100193;2. 泰华施贸易(上海)有限公司,上海 200120)

采集挤前药浴前、挤前药浴30s后、挤后药浴前(脱杯后立即)、挤后药浴10min、30min及60min的奶牛乳头侧壁及乳头孔样品,经4~6个梯度稀释后,采用3M细菌总数测试片进行细菌培养及计数,分析挤前、挤后乳头药浴液杀菌及抑菌效果,以评价不同稀释比例的碘泰牛乳头消毒剂挤前药浴快速杀菌效果以及挤后药浴杀菌和持续抑菌效果。结果表明,按1∶4~1∶6稀释的碘泰牛乳头消毒剂具有良好的挤前快速杀菌和挤后药浴持续抑菌效果。
乳头药浴;聚维酮碘;3M测试片;细菌总数
乳房炎是奶牛最常见疾病之一,也是引起牧场经济损失最严重的疾病之一。引起乳房炎的因素繁多复杂,其中由病原微生物引发的乳房炎约占发病总数的80~90%。乳头表面污染的病原微生物可通过奶杯、挤奶员的手以及擦拭乳房用的毛巾等传播,引发乳房炎。对奶牛乳头进行挤奶前、后药浴消毒,是预防乳房炎的重要措施之一。Moak(1916)首次报道利用松树油稀释液进行乳头药浴以控制无乳链球菌性乳房炎,但该方法当时并未引起重视。20多年后,Newbould 和 Barnum报道了采用碘伏或洗必泰进行奶牛乳头药浴以控制葡萄球菌性乳房炎的应用效果。此后乳头药浴才逐渐推广,纳入挤奶卫生控制流程。Natzke(1977)的田间试验表明,仅三种成分——洗必泰(0.5%)、碘制剂(0.5%,1%)和氯制剂(4%),可作为有效的乳头药浴液。鉴于氯制剂的挥发性与皮肤刺激性,目前国际上多使用碘制剂和洗必泰成分的药浴液。
本试验采用3M细菌总数测试片检测奶牛乳头皮肤及乳头孔药浴前后细菌总数的变化,评价不同稀释浓度碘泰牛乳头消毒剂快速杀菌以及持续抑菌效果。
1. 材料和方法
1.1 试验动物及分组
本试验在北京某规模化牛场进行。该牛场存栏1200头,成母牛TMR饲喂,每天3次挤奶,2012年成母牛头年单产11吨。牛场内设有实验室,可立即进行样品的稀释及细菌培养。
试验组奶牛使用碘泰牛乳头消毒剂进行乳头药浴,分为1∶4与1∶6两个稀释度试验组(碘泰一组和碘泰二组);对照组奶牛使用牧场现有某进口品牌药浴液进行乳头药浴。奶牛挤后药浴后,在采食通道站立1h。
挤前药浴试验选择临床健康泌乳牛6头,随机分为3组(碘泰一组2头,碘泰二组2头,对照组2头),每组奶牛的各8个乳头归入试验范围,分别于药浴前及前药浴30s后进行皮肤拭子采样。挤后药浴试验选择临床健康泌乳牛18头,随机分为3组(碘泰一组6头,碘泰二组6头,对照组6头),为消除采样过程中乳头皮肤采样后给后续试验造成的误差,将挤后药浴试验进一步分为4小组进行:碘泰一A1组、碘泰二A1组和对照A1组各8个乳头进行0min-10min配对采样;碘泰一A2组、碘泰二A2组和对照A2组各8个乳头进行0min-30min配对采样;碘泰一A3组、碘泰二A3组和对照A3组各8个乳头进行0min-60min配对采样。
1.2 试剂与用品
试验组药浴液:碘泰牛乳头消毒剂,为10%聚维酮碘溶液(有效碘含量10000ppm),由泰华施贸易(上海)有限公司提供。
碘泰一组挤前、挤后药浴液,碘泰用清水按1∶4稀释后使用,工作液有效碘含量约为2000ppm;
碘泰二组挤前、挤后药浴液,碘泰用清水按1∶6稀释后使用,工作液有效碘含量约为1500ppm;
对照组药浴液:为牧场现有某进口品牌碘伏产品(原液有效碘含量20000ppm)。挤前药浴用清水按1∶1稀释,工作液有效碘含量10000ppm;挤后药浴使用原液,工作液有效碘含量20000ppm。
单包装无菌棉拭子、PetrifilmTM细菌总数测试片(3M)、1.5mL无菌离心管、无菌盒装枪头等,购自北京兰伯瑞生物技术有限公司。
1.3 样品采集及检测
采样时间:挤前药浴杀菌试验,选取药浴前及药浴30s后两个时间点进行样品采集;挤后药浴杀菌和抑菌试验,奶牛挤完奶脱杯后立即采集样品(0min),随即进行挤后药浴处理,并于挤后药浴10min、30min和60min采集样品。
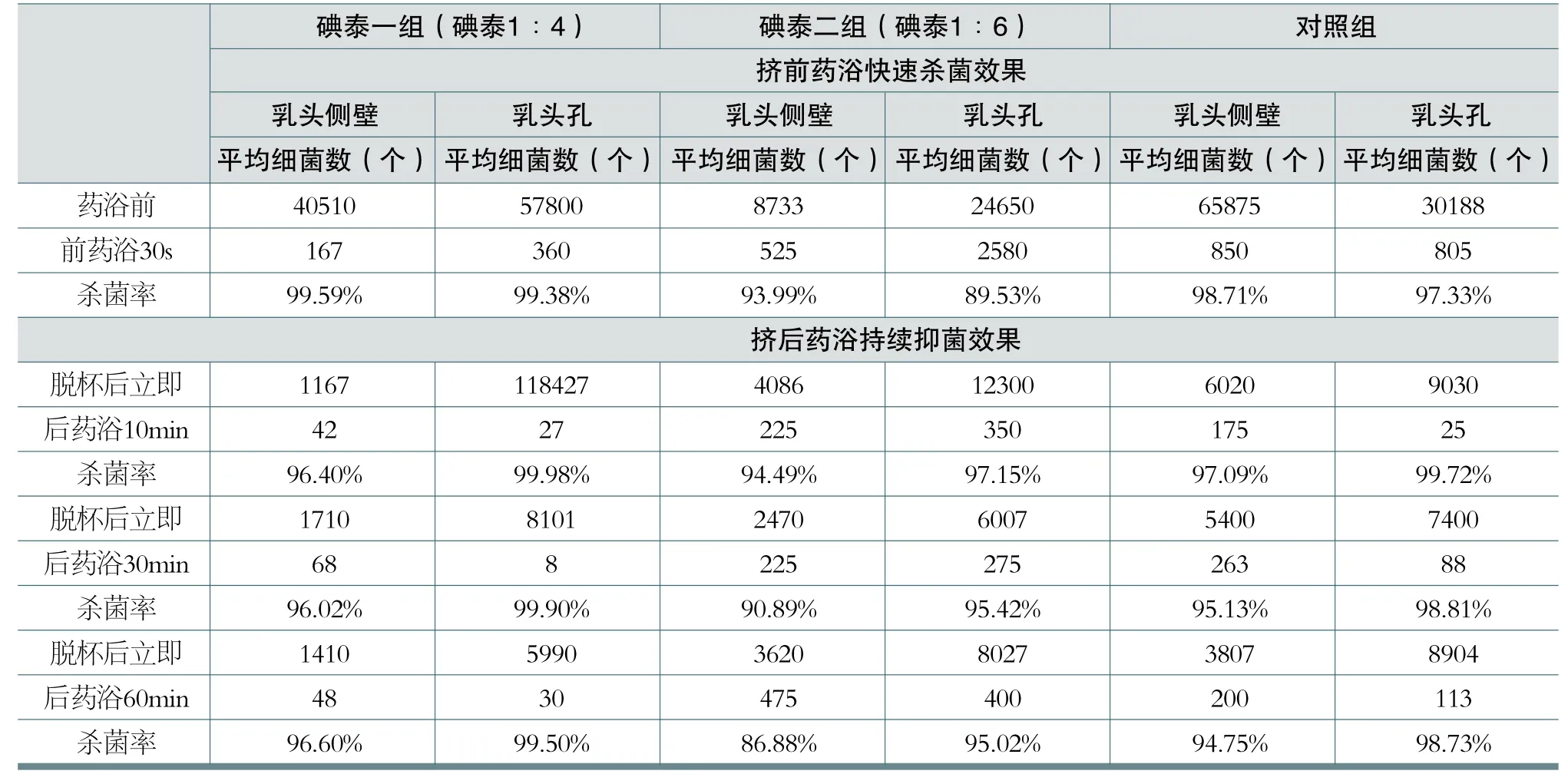
表1 奶牛挤前、挤后药浴前后乳头孔及乳头侧壁细菌计数变化
采样区域:每个乳头选择2个区域采样(乳头侧壁1cm2区域和乳头孔1cm2区域)。
采样方法:使用一次性无菌棉拭子(无菌生理盐水浸润),在采样区域擦拭5次,而后放入含有1.5mL无菌生理盐水的灭菌离心管中充分洗脱,标记后置冰盒内送实验室。为消除采样误差,所有拭子均在各自含1.5mL无菌生理盐水的灭菌离心管中浸润,采样后洗脱,确保离心管中最终生理盐水中的细菌总数与采样区域一致。
检测方法:挤前药浴前样品进行6个梯度稀释(10倍),挤前药浴30s后样品进行4个梯度稀释(10倍);脱杯后样品进行6个梯度稀释(10倍),挤后药浴10min、30min和60min样品进行4个梯度稀释(10倍)。稀释好的样品分别取1mL垂直滴加在3M细菌总数测试片的中央处,压板后置37℃培养箱加湿培养。所有样品于采集后2h内完成加样培养,防止细菌在保存过程中增殖。
1.4 计数及评价方法
3M细菌总数测试片经24h培养后,进行细菌总数计数。每个样品选择其最佳梯度(适宜计数范围为菌落数25~250)计算细菌总数,统计杀菌和抑菌率。
2. 结果与分析
2.1 挤奶前药浴快速杀菌效果
试验显示:碘泰一组奶牛乳头药浴30s后,对乳头侧壁及乳头孔处的平均杀菌率达99.59%和99.38%;碘泰二组和对照组则分别为93.99%、89.53%和98.71%、97.33%(具体检测数据请参见附表一)。三组均具有较好的快速杀菌效果,可满足奶牛挤奶前乳头药浴需求。
从临床使用效果比较,碘泰按1∶4稀释后杀菌效率最强,可以满足奶牛挤奶前药浴需求;碘泰按1∶6稀释后具有快速杀菌功效,可满足环境及乳区特别是乳头清洁的奶牛挤奶前药浴需求;对照组用于挤奶前药浴具有快速杀菌效果,但杀菌效率弱于碘泰按1∶4稀释的溶液,这表明单质碘产品有效碘释放比聚维酮碘缓慢,提高工作液浓度并不能提高其快速杀菌效果,同时会增加牛奶中碘残留风险。1500ppm及2000ppm的碘泰牛乳头消毒剂均可满足挤前药浴的要求。

2.2 挤奶后药浴杀菌及持续抑菌效果
碘泰一组挤后药浴10min、30min和60min后,对奶牛乳头孔的平均杀菌率分别为99.98%、99.90%和99.50%,对乳头皮肤侧壁的平均杀菌率分别为96.40%、96.02%和96.60%。碘泰二组挤后药浴10min、30min和60min后,对奶牛乳头孔的平均杀菌抑菌率分别为97.15%、95.42%和95.02%,对乳头侧壁皮肤的平均杀菌抑菌率分别为94.49%、90.89%和86.88%。对照组挤后药浴10min、30min和60min后,对奶牛乳头孔的平均杀菌抑菌率分别为99.72%、98.81%、98.73%,对乳头侧壁皮肤的平均杀菌抑菌率分别为97.09%、95.13%、94.75%。
三组药浴液用于挤后药浴杀菌和抑菌菌效果均较为理想,可持续保护开张的乳头孔免受病原微生物侵入,但碘泰二组挤后药浴60min时乳头侧壁的抑菌效果低于90%,考虑到试验牛挤后处于站立状态,而很多牛场挤后只能维持站立30min,或颈枷不足或损坏导致部分牛无法保证站立时间,抑菌效果可能无法保证,因此建议牧场环境或乳区卫生状况较差时应适当提高药浴液浓度。另从经济性及乳头皮肤的刺激性来看,有效碘浓度在2000ppm左右的碘泰牛乳头消毒剂效果更佳,并且长期使用时,聚维酮碘较单质碘的皮肤刺激性小,更为安全。
3. 讨论
3.1 乳房炎的发生是由环境、微生物和奶牛机体三者关联而发生,缺一不可。其中以挤奶厅操作及卫生管理尤为重要。据统计,正确的乳头药浴可以降低约50%的乳房炎病例。其中挤前药浴可快速杀灭乳头表面病原微生物,降低传染性乳房炎传播风险并保障原奶微生物及体细胞指标。挤后药浴可杀灭乳头表面病原微生物且持续保护乳房以防止病原微生物侵入松弛的乳头孔,减少新的乳房炎病例发生。此外,还应重视卧床和运动场的卫生状况,定期进行卧床及运动场清理消毒。
3.2 对于奶牛乳头药浴液的实际杀菌效果评价,按国标法要求应进行细菌分离培养及标准平板计数等操作,检测方法繁琐复杂,工作量极大,费时费力,且检测结果可能存在较大误差。3M Petrifilm法是一种区别于传统方法的菌落总数测定方法, 目前已经被广泛应用于食品类检测领域。其测定原理如下:3M Petrifilm 为预先制备好的培养基系统,测试片上的培养基含有冷水可溶性凝胶和指示剂,菌落测试片中含有的指示染剂可使菌落显示红色。在接种样品并经过一定时间的培养后, 计数测试片所在区域红色菌落的数量来判定样品的菌落总数指标。
3.3 与单质碘药浴液产品相比,聚维酮碘(PVP-I)产品原液更稳定,PVP增强了碘的杀菌能力,使聚维酮碘药浴液用于挤前药浴更快速、高效,且PVP-I具有长效缓释作用,用于挤后药浴杀菌保护作用更持久。
3.4 前药浴30s后,各组奶牛乳头皮肤仍有少数细菌残存。因此最好使用无菌消毒纸进行药浴后乳头擦干,且后续挤奶操作仍应重视相关卫生流程要求。脱杯后奶牛乳头表面细菌数较高,说明挤奶结束后挤奶杯组内衬表面细菌数也同样较高,对于问题较严重的牧场,可采用过氧乙酸或碘伏稀释溶液消毒挤奶杯组。
[1] MOAK, H. Control and eradication of infectious mastitis in dairy herds. Cornell Vet. 6∶36-40. 1916.
[2] NATZKE, R.P. Role of teat dips and hygiene in mastitis control. J. Am. vet. med. Ass. 170∶1196-1198. 1977.
[3] NEWBOULD, F.H.S. and D.A. BARNUM. The reduction of the microflora of milking machine inflations by teat dipping and teat cup pasteurization. J. Milk Fd Technol. 23∶374-376. 1960.
[4] PANKEY, J.W. JR. and W.N. PHILPOT. Hygiene in the prevention of udder infections I.Comparative efficacy of four teat dips. J.Dairy Sci. 58∶ 202-204. 1975.
[5] PHILPOT. W.N. and J.W. PANKEY, JR. Hygiene in the prevention of udder infections III.Effectiveness of 59 teat dips for reducing bacterial populations on teat skin. J. Dairy Sci. 58∶ 209-216. 1975.
[6] PHILPOT, W.N., J.W. PANKEY, R.L. BODDIE and W.D. GILSON. Hygiene in the prevention of udder infections VI. Comparative efficacy of a teat dip under experimental and natural exposure to mastitis pathogens. J. Dairy Sci. 61∶ 964-969. 1978.
[7] WESSON, D.O. and L.H. SCHULTZ. Effectiveness of post-milking teat dips in preventing new udder infections. J. Dairy Sci. 53∶ 1391-1393. 1970.

