Cry2A蛋白的石英晶体微天平检测
杜 方,黄 新,纪淑娟,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.中国检验检疫科学研究院植物检疫研究所,北京 100029)
Cry2A蛋白的石英晶体微天平检测
杜 方1,黄 新2,纪淑娟1,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.中国检验检疫科学研究院植物检疫研究所,北京 100029)
目的:建立检测苏云金芽孢杆菌Cry2A蛋白的石英晶体微天平(quartz crystal microbalance,QCM)传感方法。方法:根据抗原抗体相互作用原理,利用QCM技术,在金片表面修饰抗原所对应的单克隆抗体,对苏云金芽孢杆菌Cry2A蛋白进行检测研究。结果:该方法灵敏度达到1 μg/mL,特异性好、重复性高。结论:该方法有利于为苏云金芽孢杆菌蛋白检测提供新思路,可以应用到实际样品的检测,在农产品转基因检测和进出口检验检疫中具有很好的应用前景。
石英晶体微天平;Cry2A蛋白;转基因作物
转基因技术凭借可以使作物育种定向化的自身优势,近年来得到了迅猛发展[1]。由苏云金芽孢杆菌(Bacillus thuringiensis,Bt)中的cry基因表达的抗虫性转基因作物成为主要抗虫作物之一[2]。苏云金芽孢杆菌是一种广泛存在于土壤中的革兰氏阳性菌,在芽孢形成时产生的具有高度特异性杀虫活性的晶体蛋白,称为杀虫晶体蛋白(insecticidal crystal protein,ICPs),目前主要的Bt转基因作物是棉花和玉米[3]。第1代Bt棉花是孟山都公司著名的Bollgard棉和Ingard棉,表达Cry1Ac毒素,有效控制了北美地区的重要害虫[4-5]。孟山都公司开发的第2代Bt棉花BollgardⅡ棉可以同时表达Cry1Ac和Cry2Ab两种Cry毒素。
Bt杀虫蛋白基因现已成为转基因作物育种研究中应用最广泛的抗虫基因[3]。Cry2A杀虫蛋白是由苏云金芽孢杆菌形成芽孢时产生的杀虫蛋白中的一类,对鳞翅目和双翅目昆虫具有特异杀虫毒性。Cry2A基因与目前转基因作物中常用的Cry1Ab基因的同源性小于45%,因此对于某些Cry1A杀虫蛋白不能杀死的害虫具有杀虫效果。Bt转基因水稻中的Cry2A基因是根据原始基因进行密码子优化得到的,在植物中能够很好的表达[6]。
转基因技术发展的同时,转基因作物的 生物安全问题备受关注。许多国家要求对转基因作物及产品实行标签制度[7-10]。为了保证转基因作物安全管理和标识制度的顺利实施,转基因作物及产品检测方法和技术体系的研究就显得尤为关键。目前常用的检测方法是聚合酶链式反应(polymerase chain reaction,PCR)检测[11]和酶联免疫吸附法[12],但是这两种方法程序复杂,仪器设备要求高,耗时长,检测成本高,并且需要专业的技术人员。本实验研究了QCM传感器检测方法,通过压电效应来检测晶体表面质量的变化[13-17]。在金片表面特异性修饰Cry2A单克隆抗体,该方法检测时间短,方法简便易掌握,金片可以反复使用30 次以上,灵敏度高,特异性好,变异系数小,因此是一种有效可行的检测方法。
1 材料与方法
1.1 材料、试剂与仪器
Cry2A转基因水稻、Cry1Ac转基因水稻、非转基因水稻 中国检验检疫科学研究院;Cry2A蛋白及Cry2Ab单克隆抗体 中国农业科学院植物保护研究所;牛血清蛋白(bovine serum albumin,BSA)上海游然传感科技有限公司;N-羟基硫代琥珀酰亚胺(N-hydroxysulfosuccinimide sodium salt,Sulfo-NHS)、磷酸盐缓冲液(phosphate buffered saline,PBS)、N-乙基-N’-(二甲氨基丙基)二亚胺(N-ethyl-N’-(3-dimethylaminopropyl) carbodiimide hydrochloride,EDC) 美国Sigma公司;脂肪酸甲酯磺酸盐(fatty acid methyl ester sulfonate,MES)、11-巯基十一酸(11-mercaptoundecanoic acid,11-MUA)、3-巯基丙酸(3-mercaptopropionic acid,3-MPA)、Tris-HCl(pH6.5) 上海共价化学科技有限公司;30%双氧水和氨水 北京翰隆达科技发展有限公司;CP4-EPSPS蛋白抗原 中国农业科学院;石英晶体微天平 美国Biolin Scientific AB公司。
1.2 方法
1.2.1 QCM金片预处理
将30%双氧水、氨水、水按1∶1∶5的体积比煮沸,温度为85 ℃,10 min后取出,用去离子水洗净氮气吹干,再用无水乙醇清洗,氮气干燥备用。
1.2.2 QCM表面修饰
将预处理后的金片沉浸在浓度为10 mmol/L比例为10∶1的3-MPA与11-MUA混合液中,封口膜封好过夜,之后用去离子水和乙醇清洗表面,氮气吹干后修饰现配的1∶1的EDC(0.075 mol/L)和NHS(0.015 mol/L)混合液,室温2 h后重复此过程,用于活化金片表面11-MUA的硫醇羧基,洗净吹干后滴加0.2 mg/mL的Cry2Ab单克隆抗体,抗体用PBS稀释,在恒温箱37 ℃静置3 h(封口膜封好,并在周围洒若干水),之后用去离子水洗净残留抗体,用PBS稀释牛血清蛋白BSA到1 mg/mL,将BSA滴加金片表面封闭未结合羧基位点,室温静置2 h,水洗吹干-4 ℃备用。
1.2.3 样品QCM检测
将修饰好的金片固定于QCM传感器中,打开蠕动泵开始流速为200 μL/min,样品管通入PBS,等基线稳定流速改为50 μL/min,通入待检测抗原,PBS稀释到目标质量浓度。
2 结果与分析
2.1 QCM检测Cry2A蛋白的灵敏度与重复性
2.1.1 灵敏度与线性相关性
为了考察QCM金片检测Cry2A蛋白的灵敏度。将提纯蛋白用PBS进行稀释,分别稀释为1、5、10、20、30 μg/mL,然后进行QCM检测,当进样时间约20 min后,蠕动泵将抗原溶液送达金片表面,引起金片频率下降和耗散上升,说明抗原与QCM金片表面固定的抗体特异性地结合在一起。抗原溶液样品质量浓度越大,与金片表面单抗结合的抗原越多,引起频率下降越多。用3次响应值的平均值与抗原质量浓度作标准曲线,如图1所示,得到一条近似符合线性关系的的直线,R2为0.993 7,相关系数较好。将3次实验数据取平均值作图如图2所示,由图2可知,用QCM检测Cry2A蛋白的灵敏度可以达到1 μg/mL,由表1可见,其3 次检出限频率下降分别为2.14、2.06、2.19 Hz。

图1 QCM金片检测Cry2A抗原标准曲线Fig.1 Standard curve of Cry2A antigen using QCM chip
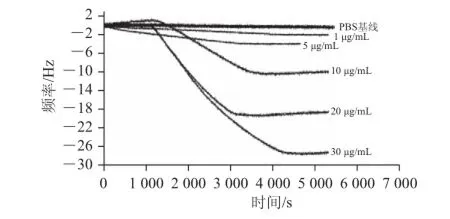
图2 QCM芯片检测灵敏度Fig.2 Sensitivity and repeatability of Cry2A protein detection using QCM
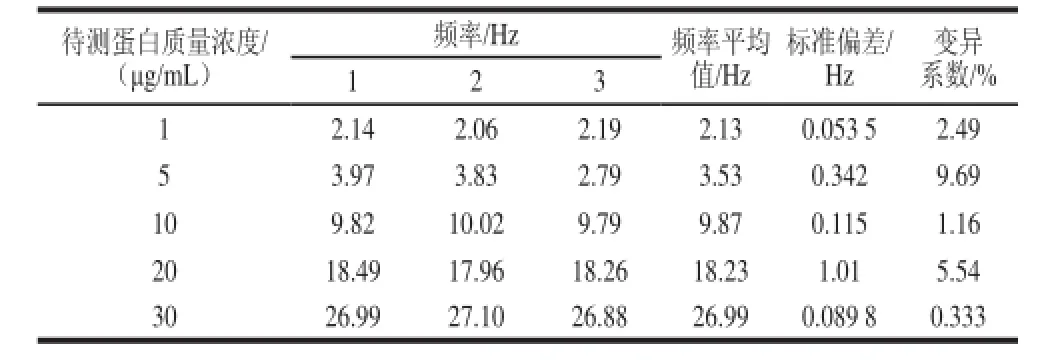
表1 QCM金片的重复性Table 1 The repeatability of QCM chip
2.1.2 重复性
在同样的条件下分别对15 片QCM金片进行清洗、修饰活化、固定单克隆抗体等过程,将固定好单抗的QCM金片用于检测上述5 种质量浓度的抗原,每个质量浓度测量3 次,得到结果如表1所示,计算3 次测量值的平均值、标准偏差及变异系数。得到的变异系数均小于相应平均值的10%,说明QCM金片检测Cry2A蛋白的重复性较好。
2.2 QCM检测Cry2A蛋白的特异性
为了考察QCM检测Cry2A蛋白的特异性,同样取1 mL质量浓度为20 μg/mL的CP4-EPSPS蛋白、Cry2A蛋白和两种蛋白等体积的混合液进行QCM检测,重复实验3次,如表2、图3所示。检测同样质量浓度的样品溶液,只有含有Cry2A蛋白的抗原溶液有明显的响应。说明该方法修饰的金片具有良好的特异性。

表2 QCM金片特异性Table 2 The specificity of QCM chip

图3 QCM检测Cry2A蛋白特异性结果Fig.3 Specificity of QCM for Cry2A protein detection
2.3 实际样品检测
为了考察制备的QCM金片对转基因水稻实际样品的检测效果和特异性,选择Cry1Ac转基因水稻、非转基因水稻和Cry2A转基因水稻种子,用液氮研磨成粉末,用PBS将水稻粉末稀释同样倍数,对3 种水稻实际样品进行检测,如图4所示,只有Cry2A转基因水稻信号明显,另外两种转基因水稻信号很小,接近仪器误差水平。说明该方法制备的QCM金片选择性强,特异性好,可以应用到实际样品的检测中去。

图4 QCM金片转基因水稻检测结果Fig.4 Detection of genetically modified rice using QCM
3 结 论
由于目前转基因食品安全性引起社会各界广泛关注[18-19],因此转基因检测技术的研究有着重要的现实意义,根据抗原抗体特异性结合的原理,通过自组装法制成检测芯片[20-24],利用QCM生物传感器可以实现检测过程方便快捷,结果真实可靠,检测时间短,检测灵敏度可达到1 μg/mL,检测质量浓度同为20 μg/mL的CP4-EPSPS和Cry2A蛋白作比较时发现,CP4-EPSPS蛋白几乎没有响应,而Cry2A蛋白响应明显,在实际样品检测实验中,Cry2A转基因水稻频率下降值明显高于非转基因水稻和Cry1Ac转基因水稻,说明不仅该方法特异性很好,而且可以应用到实际样品检测。实验中的金片耗材价格为800 元人民币,为了节约成本,实验中的QCM金片经过处理后,可以重复使用,每片金片可以重复利用30 次左右。此方法可以广泛应用到进出口植物检验检疫工作中,对于转基因检测有着重要的应用价值。
[1] KNOX O, NEHI D, MOR T, et al. Genetically modi ed cotton has no effect on arbuscular mycorrhizal colonisation of roots[J]. Field Crops Research, 2008, 109(1/2/3): 57-60.
[2] IBARGUTXI M, MUNOZ D, ESCUDERO I, et al. Interactions between Cry1Ac, Cry2Ab, and Cry1Fa Bacillus thuringiensis toxinsin the cotton pests Helicoverpa armigera (Hübner) and Earias insulana (Boisduval)[J]. Biological Control, 2008, 47(1): 89-96.
[3] SCHNEPF E, CRICKMORE N, van RIE J, et al. Bacillus thuringiensis and its pesticidal crystal proteins[J]. Microbiology and Molecular Biology Review, 1998, 62(3): 775-806.
[4] HALCOMB L, BENEDICT J, COOK B. Survival and growth of bollworm and tobacco budworm on nontransgenic and transgenic cotton expressing a CryIA insecticidal protein (lepidoptera: Noctuidae)[J]. Environmental Entomology, 1996, 25(2): 250-255.
[5] MACLNTOSH S, STONE T, SIMS S, et al. Speci city and ef cacy of puri ed Bacillus thuringiensis proteins against agronomically important insects[J]. Journa of Invertebrate Pathology, 1990, 56(2): 258-266.
[6] 杨奇. Cry2A杀虫蛋白在大肠杆菌中的表达及胶体金免疫层析速测卡的研制[D]. 上海: 上海海洋大学, 2012.
[7] Question and answers on the regulation of GMOs in the EU[R]. European Commission, 2002.
[8] Global G M food labelling laws biotech bulletin 8[S/OL]. http://www. afaa.com.au.
[9] Guideline for the conduct of food safety assessment of foods derived from recombinant-dna plants, CAC/GL 45, 2003[S].
[10] Guideline for the conduct of food safety assessment of foods produced using recombinant-DNA microorganisms, CAC/GL 46, 2003[S].
[11] KAMLE S, ALI S. Gene tically modi ed crops: detection strategies and biosafety issues[J]. Gene, 2013, 522(2): 123-132.
[12] LI Yunhe, HU Long, ROMEIS J, et al. Use of an arti cial diet system to study the toxicity of gut-active insecticidal compounds on larvae of the green lacewing Chrysoperla sinica[J]. Biological Control, 2014, 69: 45-51.
[13] CHEN Qiang, TANG Wei, WANG Dingzhong, et al. Amplified QCM-D biosensor for protein based on aptamer-functionalized gold nanoparticles[J]. Biosensors and Bioelectronics, 2010, 26(2): 575-579.
[14] SUI Tao, GE Yingbin, LIU Wujun, et al. An acetylcholinesterase antibody-based quartz crystal microbalance for the rapid identification of spinal ventral and dorsal roots[J]. Quartz Crystal Microbalance Fast Identifies Nerves, 2013, 8(7): e69049.
[15] VELUSAMY V, ARSHAK K, KOROSTYNSKA O, et al. An overview of foodborne pathogen detection: in the perspectiveof biosensors[J]. Biotechnology Advances, 2010, 28(2): 232-254.
[16] RUSU G, ASANDULESA M, TOPALA I, et al. Atmospheric pressure plasma polymers for tuned QCM detection of protein adhesion[J]. Biosensors and Bioelectronics, 2014, 53: 154-159.
[17] MATATAGUIA D, FONTECHA J, FERNANDEZ M, et al. Comparison of two types of acoustic biosensors to detect immunoreactions: love-wave sensor working in dynamic mode and QCM working in static mode[J]. Sensors and Actuators B, 2013, 189: 123-129.
[18] 庄云, 肖振晶. 转基因产品检测技术应用与发展[J]. 吉林农业科技学院学报, 2009, 18(9): 22-29.
[19] 龚宏伟. 转基因农产品检测前沿技术及应用[J]. 甘肃农业, 2010, 12(3): 34-40.
[20] ASAV E, AKYILMAZ E. Preparation and optimization of a bienzymic biosensor based on self-assembled monolayer modified gold electrode for alcohol and glucose detection[J]. Biosensors and Bioelectronics, 2010, 25(5): 1014-1018.
[21] COMBA F, RUBIANES M, CABRERA L, et al. Highly sensitive and selective glucose biosensing at carbon paste electrodes modified with electrogenerated magnetite nanoparticles and glucose oxidase[J]. Electroanalysis, 2010, 22(14): 1566-1572.
[22] TANNE C, GOBEL G, LISDAT F. Development of a (PQQ)-GDH-anode based on MWCNT-modified gold and its application in a glucose/O2-biofuel cell[J]. Biosensors and Bioelectronics, 2010, 26(2): 530-535.
[23] FU Guanglei, YUE Xiuli, DAI Zhifei, et al. Glucose biosensor based on covalent immobilization of enzyme in sol-gel composite film combined with Prussian blue/carbon nanotubes hybrid[J]. Biosensors and Bioelectronics, 2011, 26(9): 3973-3976.
[24] CHE Xin, YUAN Ruo, CHAI Yaqin, et al. Amperometric glucose biosensor based on Prussian blue-multiwall carbon nanotubes composite and hollow PtCo nanochains[J]. Electrochimica Acta, 2010, 55(19): 5420-5427.
Detection of Cry2A Protein Based on Quartz Crystal Microbalance Technique
DU Fang1, HUANG Xin2, JI Shu-juan1,*
(1. College of Food Science, Shenyang Agricultural University, Shenyang 110866, China; 2. Institute of Plant Quarantine, Chinese Academy of Inspection and Quarantine, Beijing 100029, China)
Purpose: To establish a detection method for Cry2A protein by quartz crystal microbalance (QCM) sensing method. Methods: By using QCM, based on the principle of the interaction between antigen and antibody, the specific monoclonal antibody was modifi ed on the gold surface for Cry2A protein detection. Results: The proposed method had a high sensitivity of 1 μg/mL, good specifi city, and suffi cient repeatability. Conclusion: This method may provide a new idea for the detection of Bacillus thuringiensis protein from genetically modifi ed crops and thus has promising prospects for application in import and export inspection and quarantine supervision work.
quartz crystal microbalance (QCM); Cry2A protein; genetically modifi ed crop (GMC)
Q31
A
1002-6630(2014)24-0209-04
10.7506/spkx1002-6630-201424040
2014-01-17
质检公益性行业科研专项(201410014)
杜方(1987—),男,硕士研究生,研究方向为食品质量控制。E-mail:dufang321@163.com
*通信作者:纪淑娟(1960—),女,教授,博士,研究方向为食品质量控制。E-mail:1162212290@qq.com

