茶枝柑皮提取物中川陈皮素和橘皮素的大鼠肠吸收特性
源瀚祺,黄庆华,*,张小英,周子雄,游明霞
(1.广东药学院药科学院,广东 广州 510006;2.汤臣倍健股份有限公司,广东 珠海 519040)
茶枝柑皮提取物中川陈皮素和橘皮素的大鼠肠吸收特性
源瀚祺1,黄庆华1,*,张小英1,周子雄1,游明霞2
(1.广东药学院药科学院,广东 广州 510006;2.汤臣倍健股份有限公司,广东 珠海 519040)
目的:研究茶枝柑皮提取物中多甲氧基黄酮类成分川陈皮素和橘皮素在大鼠的肠吸收特性。方法:采用大鼠单向肠灌流模型,利用高效液相色谱法分别测定灌流前后经处理的灌流液中川陈皮素和橘皮素的含量变化,计算其肠吸收速率常数Ka和表观吸收系数Kapp,分析茶枝柑皮提取物在大鼠肠吸收的特征。结果:川陈皮素和橘皮素在各肠段吸收有显著差异,同种成分不同肠段间吸收无显著差异,质量浓度和pH值对吸收情况无显著影响。结论:茶枝柑皮提取物中川陈皮素和橘皮素在大鼠各肠段吸收良好,在空肠段吸收最好,其吸收呈简单的被动扩散。
茶枝柑皮;在体单向肠灌流模型;川陈皮素;橘皮素
目前,我国食品功能因子的研发相对快捷有效的途径主要有:从各种天然产物特别是药食两用的中药资源中寻找食品功能因子;加强对第2代功能性食品的功效物质基础的研究。研究活性组分口服后在体内的吸收情况,对设计其传输系统具有重要的指导意义。小肠是吸收的主要场所,也是研究口服活性成分吸收机理的主要部位。评价活性成分在肠道吸收的方法有离体法、在体法和体内法等多种方法[1],在体法因不损伤研究部位的淋巴和循环系统而明显优于其他方法。在众多的在体研究法中,单向灌流模型是以较低的流速(0.2~0.3 mL/min)对某一肠段进行单向灌流,根据进出入口处灌流液中的药物浓度差考察药物在该肠段的吸收,其实验条件与口服给药后药物接触的肠道环境较接近,吸收速率稳定,与人体有良好的相关性[2-3]。这种技术在国内外被广泛地应用于研究各种化学药物的吸收行为[4-6],在中药及功能食品研究中也日益普及。
茶枝柑皮是茶枝柑(Citrus reticulata “Chachi”)的成熟果皮,是广东道地药材广陈皮的原料来源,也是国家卫生部确定的药食两用的中药品种。黄酮类成分是茶枝柑皮中的主要活性成分[7],而多甲氧基黄酮类(polymethoxylated flavones,PMFs)更是芸香科柑橘属所特有的、高度甲氧化的微量成分,由于具有很强的抗氧化、抗癌、抗肿瘤、抗炎、降低胆固醇水平及抗菌活性而备受关注[8]。本课题组主要针对茶枝柑皮的抗氧化活性进行研究,以体外抗氧化活性为指标进行了茶枝柑皮的提取工艺研究,应用血清药物化学的原理确定了提取物入血有效成分主要为包括川陈皮素和橘皮素在内的多种PMFs[9-10],在经过硅胶柱层析分离得到多种PMFs后,通过细胞实验证实了茶枝柑皮提取物及PMFs均具有抗氧化活性,对受H2O2氧化应激损伤的大鼠嗜铬瘤细胞PC12具有保护作用,能降低细胞丙二醛水平,提高其超氧化物歧化酶及谷胱甘肽过氧化物酶活性[11]。
研究口服茶枝柑皮提取物后PMFs的吸收部位和吸收机制对建立其口服传输系统和理解茶枝柑皮提取物作用的物质基础具有重要意义。实验采用大鼠单向肠灌流模型,比较不同质量浓度和pH值条件下的茶枝柑皮提取物中川陈皮素和橘皮素在不同肠段的吸收变化,以期通过研究以川陈皮素和橘皮素为代表的PMFs在大鼠肠道的吸收转运特性,探讨茶枝柑皮提取物抗氧化活性成分在不同条件下服用时的吸收差异,为功能食品功效机制的深入研究提供基础。
1 材料与方法
1.1 实验动物
动物SD大鼠,雄性,体质量250~300 g,广州中医药大学实验动物中心提供(粤检证字第2000A037号)。适应性喂养1周,每天自由进食、饮水。
1.2 材料与试剂
茶枝柑皮于2009年12月采自广东翁源坝仔镇溪水村,由广州中医药大学中药鉴定教研室张丹雁教授鉴定为茶枝柑(Citrus reticulata “Chachi”)。参照文献[9],茶枝柑皮粉碎至20目,在40 ℃烘箱内干燥1~2 d,以液料比17∶1,42%乙醇于62 ℃条件下水浴回流3.1 h,真空干燥得固体块状茶枝柑皮提取物。经高效液相色谱法(high performance liquid chromatography,HPLC)测定[12],茶枝柑皮提取物中川陈皮素和橘皮素含量分别为13.30 mg/g和10.68 mg/g。
川陈皮素及橘皮素对照品(实验室自提,经HPLC归一化法测定含量大于98%);乙腈、甲醇为色谱纯,其他试剂为分析纯。Krebs-Ringer’s灌流液组成:NaCl(133 mmol/L)、KCl(4.7 mmol/L)、CaCl2(3.3 mmol/L)、MgCl2(2.3 mmol/L)、NaH2PO4(1.8 mmol/L)、NaHCO3(16.4 mmol/L)、D-葡萄糖(7.8 mmol/L)。
1.3 仪器与设备
H L-2电子蠕动泵 上海沪西分析仪器厂;ZNHW-Ⅲ电子节能控温仪 巩义市英峪予华仪器厂;高效液相色谱仪 美国安捷伦公司。
1.4 方法
1.4.1 色谱条件
Phenomenex Luna C18柱(250 mm×4.6 mm,5 μm);柱温:25 ℃;流速:1.0 mL/min;进样量:20 μL;流动相(体积分数):0.2%乙酸-乙腈,梯度洗脱,0~10 min乙腈8%~25%,10~20 min乙腈25%~30%,20~30 min乙腈30%~50%,30~40 min乙腈40%;检测波长:330 nm。
1.4.2 溶液的配制
茶枝柑皮提取物供试液:精密称取一定量的茶枝柑皮提取物,加入20 mL 0.5%羧甲基纤维素钠溶液溶解后以Krebs-Ringer’s灌流液定容至200 mL,得质量浓度分别为1.00、3.00、5.00 mg/mL的提取物灌流液。
对照品溶液:精密称取川陈皮素、橘皮素对照品适量,置10 mL量瓶中,甲醇定容,即得1 mg/mL的对照品贮备液。精密量取对照品贮备液适量,用甲醇稀释成不同质量浓度的混合对照品系列溶液。
1.4.3 方法学考察
1.4.3.1 标准曲线的建立
精密吸取系列溶液各200 μL,置于1.5 mL 离心管中,水浴加热氮气吹干甲醇溶剂,分别精密加入Krebs-Ringer’s灌流液200 μL,乙酸乙酯800 μL,涡旋混匀3 min,静置后10 000 r/min离心10 min,吸取上清液,反复操作2次,合并上清液,水浴加热氮气吹干,精密加入甲醇200 μL,涡旋1 min后10 000 r/min离心5 min,取上清液20 μL进行HPLC分析。分别以川陈皮素和橘皮素的质量浓度ρ/(μg/mL)对峰面积A进行线性回归,得2个标准曲线方程。
1.4.3.2 精密度实验
精密吸取上述系列的高质量浓度(含川陈皮素84.40 μg/mL、橘皮素84.08 μg/mL)、中质量浓度(含川陈皮素10.55 μg/mL、橘皮素10.51 μg/mL)、低质量浓度(含川陈皮素0.66 μg/mL、橘皮素0.66 μg/mL)混合对照品溶液,按1.4.3.1节“置于1.5 mL离心管中”开始操作处理,24 h内间隔进样5次,5 d内间隔进样5 次,分别记录峰面积及计算日内和日间精密度。
1.4.3.3 回收率实验
分别精密吸取上述系列的两组高质量浓度(含川陈皮素84.40 μg/mL、橘皮素84.08 μg/mL)、中质量浓度(含川陈皮素10.55 μg/mL、橘皮素10.51 μg/mL)、低质量浓度(含川陈皮素0.66 μg/mL、橘皮素0.66 μg/mL)混合对照品溶液各200 μL,置于1.5 mL 离心管中,水浴加热氮气吹干甲醇溶剂,一组分别精密加入Krebs-Ringer’s灌流液200 μL,另一组分别精密加入空白肠液200 μL,其余步骤按1.4.3.1节从“乙酸乙酯800 μL”开始处理后进样,以后者对前者相应质量浓度的峰面积比值计算绝对回收率。并以后者峰面积代入标准曲线方程计算实测质量浓度,与实际对照品质量浓度的比值计算方法回收率。
1.4.3.4 稳定性实验
精密称取茶枝柑皮提取物适量,按1.4.2节方法配制茶枝柑皮提取物灌流液,封口膜密封,置37 ℃恒温水浴中,分别于0、30、60、90、120 min精密吸取200 μL,按1.4.3.1节方法处理后进样,将各时间点测得的川陈皮素和橘皮素含量与0 min测得的含量作百分比,并重复实验3 次,计算各时间点含量百分比值的相对标准偏差(relative standard deviation,RSD),作为供试液稳定性考察指标,考察供试液中的成分含量在大鼠肠灌流吸收研究过程中能否保持稳定。
1.4.4 大鼠在体肠吸收实验
实验前将大鼠禁食过夜(自由饮水),腹腔注射0.2 g/mL乌拉坦溶液麻醉(5 mL/kg),固定,用红外灯保持37 ℃体温,沿腹中线打开腹腔约3 cm,分别截取十二指肠、空肠、回肠、结肠肠段(选取肠段标准如下:十二指肠自幽门1 cm处开始向下10 cm止;空肠段自幽门起15 cm往下10 cm止;回肠自盲肠上行20 cm开始往下10 cm止;结肠段从盲肠后端开始往下10 cm止。每个肠段的吸收状况用6 只大鼠进行考察统计,每次实验只截取1 只大鼠的其中1 个肠段),两端切口,用预热至37 ℃的生理盐水将肠内容物冲洗干净,再用空气将生理盐水排空,切口两端分别插管并结扎固定。伤口处用浸有生理盐水的脱脂棉覆盖保湿,红外灯下保温。用37 ℃的Krebs-Ringer’s灌流液以0.2 mL/min流速对截取肠段灌流平衡30 min,再取预热至37 ℃的供试药液50 mL,以0.2 mL/min流速灌流平衡45 min,待平衡结束后肠段入口处换上装有灌流液且已称量的供试液瓶并开始计时,出口处则用另一已知质量的具塞瓶收集流出液,每隔15 min迅速更换供试液瓶和收集液瓶并称质量,实验共收集6 次流出液,即于灌流计时开始后15、30、60、75、90 min收集流出液。实验结束后,测量肠段长度l与内径r。供试液和各时间点得到的收集液分别按1.4.3.1节方法处理后进样测定,将得到的川陈皮素及橘皮素峰面积代入标准曲线方程,计算其质量浓度。
实验中小肠不仅吸收药物也吸收和分泌水分,导致供试液体积变化,故不能用直接测定药物浓度的方法计算药物的吸收。故采用质量法[13]校正因肠内水分吸收引起的灌流液体积的变化。供试液瓶和收集液瓶的空瓶质量分别为ms0和mr0,ρin为入肠灌流供试液的密度,ρout为15~60 min的总收集液混匀后的密度(各时间点的收集液密度经测定可看作一致)。每隔15 min结束灌流后装供试液瓶和接收液瓶的质量分别为ms1和mr1,则入肠液体的质量min=ms0-ms1;出肠液体质量mout=mr1-mr0;供试液实际体积Vin=min/ρin;接收液实际体积Vout=mout/ρout。Vin与Vout的差异即为肠道吸收或分泌的水分体积。
1.5 数据分析
采用质量法[9],根据公式(1)、(2)计算药物吸收速率常数(Ka)和表观吸收系数(Kapp)。

式中:Q为灌流速度;V为被测肠段的体积;r为被测肠段内径;l为被测肠段长度;Cout为各时间点得到的收集液中被测成分的质量浓度;Vout为经质量法校正后的收集液实际体积;Cin为提取物供试液中被测成分的质量浓度;Vin为经质量法校正后的供试液实际体积。
利用统计分析软件SPSS 13.10处理肠吸收数据,并进行方差分析。
2 结果与分析
2.1 方法学验证
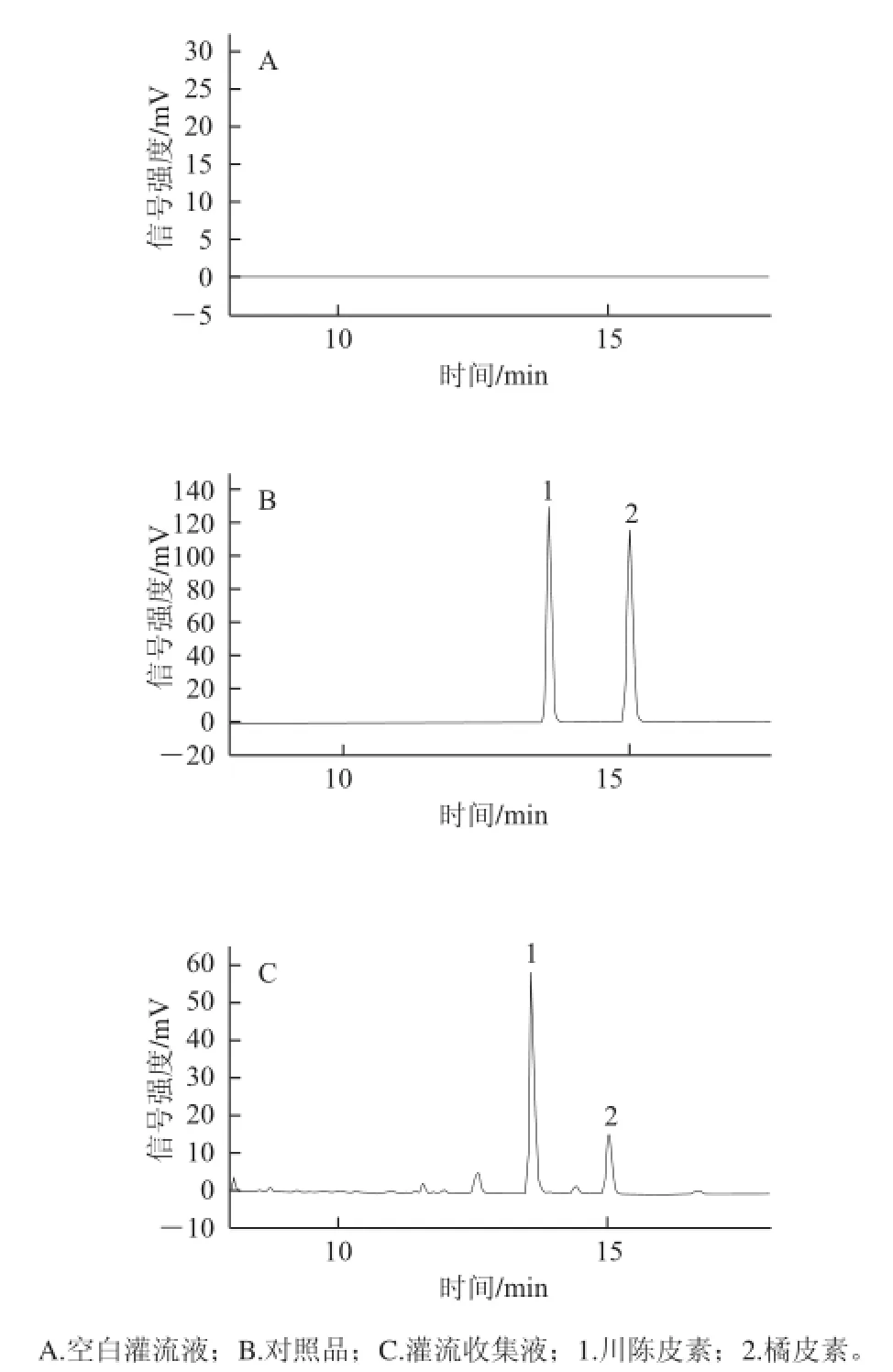
图1 肠灌流液中的川陈皮素和橘皮素的HPLLCC图Fig.1 Chromatograms of intestinal fluid spiked with nobiletin and tangeretin
由图1可知,经HPLC测定,川陈皮素和橘皮素的保留时间分别是13.29、15.47 min,空白灌流液中的物质不干扰其测定,表明分析方法可行。
川陈皮素的线性方程为:A=74.66C-8.8431,r=0.999 9,线性范围0.66~84.40 μg/mL;橘皮素的线性方程为:A=80.90C-21.63(r=0.999 9),线性范围0.66~84.08 μg/mL。高、中、低质量浓度的日内精密度RSD(n=5)分别为川陈皮素:2.28%、2.99%、7.37%;橘皮素:1.58%、2.76%、5.88%。高、中、低质量浓度的日间精密度RSD(n=5)分别为川陈皮素:2.03%、2.76%、4.93%;橘皮素:2.15%、2.70%、4.29%。RSD均小于10%,表明方法的精密度良好。3 次稳定性实验测得的含量百分比的平均RSD为川陈皮素:1.03%,橘皮素:0.74%,表明供试液中的成分质量浓度在37 ℃水浴加热2 h内基本稳定不变。川陈皮素和橘皮素的方法回收率和绝对回收率考察结果见表1,符合质量浓度测定的要求。2.2 茶枝柑皮提取物中川陈皮素和橘皮素在大鼠不同肠段的吸收
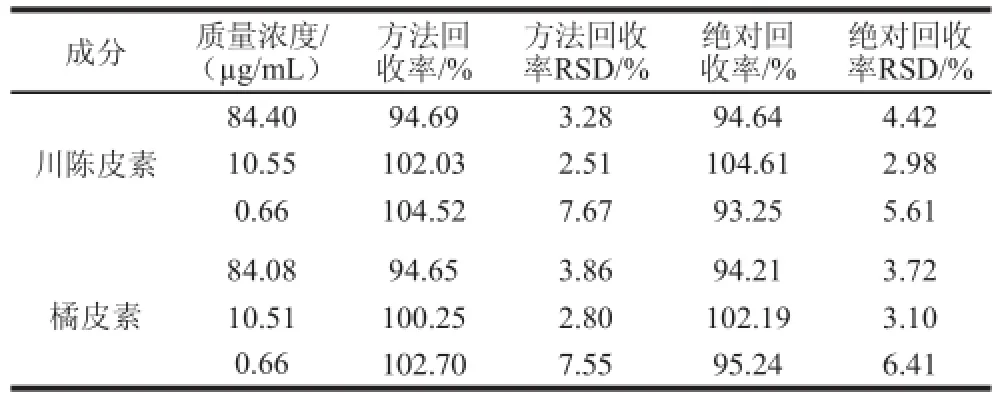
表1 川陈皮素和橘皮素的回收率考察(n=55)Table 1 Recovery of nobiletin and tangeretin in intestinal fluid ( = 5)
用1 mg/mL提取物灌流液(含川陈皮素13.30 mg/L和橘皮素10.68 mg/L),对大鼠各肠段的吸收特性进行考察,结果见表2。表2中Kapp值表明,川陈皮素(13.30 mg/L)在肠道的吸收状况为空肠>回肠>十二指肠>结肠;橘皮素(10.68 mg/L)在肠道的吸收状况为空肠>回肠>结肠>十二指肠,但同种成分在不同肠段吸收参数统计学上均无显著性差异(P>0.05),说明川陈皮素和橘皮素在全肠段均有吸收,且在空肠段吸收最好。另外从表2可看出,橘皮素比川陈皮素的在各段肠道中吸收稍好,吸收系数均存在极显著差异(P<0.01)。
表2 不同肠段对川陈皮素(13.30 mg/L)和橘皮素(10.68 mg/L)吸收的app值的影响Table 2 Absorptivity and app of nobiletin (13.30 mg/L) and tangeretin (10.68 mg/L) in different intestinal segme

表2 不同肠段对川陈皮素(13.30 mg/L)和橘皮素(10.68 mg/L)吸收的app值的影响Table 2 Absorptivity and app of nobiletin (13.30 mg/L) and tangeretin (10.68 mg/L) in different intestinal segme
注:**.与川陈皮素的吸收系数相比,差异极显著(P<0.01)。
参数药物十二指肠空肠回肠结肠Ka/(10-2/min)川陈皮素97.38±0.4297.21±0.9697.76±0.3697.28±0.68橘皮素98.75±0.31**98.89±0.44**99.13±0.15**98.53±0.85**Kapp/(10-3cm/min)川陈皮素2.58±0.203.04±0.522.99±0.732.46±0.64橘皮素6.11±0.78**7.56±1.18**6.67±1.13**6.53±0.95**
2.3 不同质量浓度的提取物灌流液对十二指肠段吸收的影响
分别采用了高、中、低质量浓度的提取物供试液对十二指肠段进行灌流,结果见表3。结果表明在低质量浓度的提取物供试液中川陈皮素和橘皮素的吸收系数最大,并随质量浓度的提高而降低,但同种成分在不同质量浓度下的吸收系数均无显著性差异,说明提取物质量浓度对吸收的总体影响不大。
表3 质量浓度对川陈皮素和橘皮素在大鼠十二指肠吸收的Ka和Kapp值的影响Table 3 Absorptivity of different concentrations of nobiletin and tangeretin in the duodenu

表3 质量浓度对川陈皮素和橘皮素在大鼠十二指肠吸收的Ka和Kapp值的影响Table 3 Absorptivity of different concentrations of nobiletin and tangeretin in the duodenu
药物质量浓度/(mg/L)Ka/(10-2/min)Kapp/(10-3cm/min)川陈皮素66.5(高)96.76±2.612.50±0.31 39.9(中)97.21±0.452.68±0.50 13.3(低)97.66±0.212.69±0.22橘皮素66.5(高)98.15±0.135.37±0.19 39.9(中)98.89±0.186.10±0.47 13.3(低)98.97±0.146.47±0.83
2.4 不同pH值的提取物灌流液对十二指肠段吸收的影响
分别采用了高、中、低pH值的Krebs-Ringer’s灌流液配制提取物供试液,对十二指肠段进行灌流,结果见表4。结果表明用于配制提取物供试液的Krebs-Ringer’s灌流液的pH值的变化对其在大鼠肠道的吸收影响并不明显,在不同pH值条件下同种成分在十二指肠的吸收系数均无显著性差异。
表4 pH值对川陈皮素和橘皮素在大鼠十二指肠吸收的Ka和Kapp值的影响Table 4 Absorptivity of nobiletin and tangeretin in perfusates with different pH values in the duodenu

表4 pH值对川陈皮素和橘皮素在大鼠十二指肠吸收的Ka和Kapp值的影响Table 4 Absorptivity of nobiletin and tangeretin in perfusates with different pH values in the duodenu
药物pHKa/(10-2/min)Kapp/(10-3cm/min)川陈皮素7.50(高)97.66±0.212.69±0.22 6.50(中)98.01±0.333.41±0.60 5.50(低)96.05±1.474.09±1.05橘皮素7.50(高)98.97±0.146.47±0.83 6.50(中)98.80±0.144.94±0.98 5.50(低)97.77±0.916.37±0.91
3 讨 论
在体单向肠灌流法通过测定药物经过在体肠段后灌流液的减少量来估算药物渗透系数,可避免胃肠内容物、消化道的运动等生理因素的影响,较容易通过控制和改变实验条件来观察比较药物在肠道中的消除过程和影响因素[14-15]。由于小肠吸收并不是引起肠道内药物减少的唯一原因,肠黏膜代谢和药物在黏膜的积聚也会引起供试液中药物质量浓度的减少,因此在实验开始前应用供试液对考察肠段进行灌流平衡以减少实验结果与实际情况的误差[16]。另外,实验过程中由于肠道能吸收或排泄水分,导致供试液体积改变,所以有必要对其进行校正。有文献报道,用不被吸收的标记物如酚红或14C-聚乙二醇标示灌流液体积的变化,然而酚红本身能部分被吸收以及对某些化合物的肠道转运或分析测定有干扰,而14C-聚乙二醇存在放射性和安全性问题[17],故本实验采用质量分析法校正。质量法通过灌流前后的质量差和密度对灌流液体积进行校正,能更真实地反映肠道吸收水分的实际情况,提高测定Ka和Kapp准确度,并且对实验条件无特殊要求,广泛适用于中药复方的肠吸收研究[18-20]。
由于多甲氧基的存在,使PMFs分子更具平面性,因而比柑橘中富含的其他黄酮苷的极性更小,且PMFs脂溶性极好,故易于透过细胞膜而被吸收[21]。药物吸收的量可用Kapp表示,药物吸收的速度则用Ka表示,文献报道药物成分Kapp<1.8×10-3cm/min和Kapp>1.2×10-2cm/min时表示药物在大鼠肠道难以吸收和易于吸收[2]。实验结果显示,提取物中川陈皮素和橘皮素在各肠段均有Kapp>1.2×10-2cm/min,据此可认为两种成分在各肠段均易于吸收,其中空肠段最好,提示可考虑将提取物制成缓释制剂或空肠定位制剂等剂型。另外,实验结果表明提取物灌流液中川陈皮素、橘皮素在各高、中、低质量浓度及pH值的吸收系数无显著性差异,说明药物吸收不受质量浓度的影响,不存在较大浓度下饱和的现象。而pH值分配假说认为药物的吸收取决于药物在胃肠道中的解离状态和油水分配系数[22-23],川陈皮素和橘皮素均为弱酸性化合物,在消化道体液pH值环境下,未解离型成分在胃肠道的浓度占大比例,容易透过消化道上皮细胞膜,故调节供试液pH值可能影响成分的解离度继而影响吸收状况,但实验结果显示弱酸性至弱碱性pH 5.5~7.5对其吸收无显著影响。因此推断茶枝柑皮提取物中川陈皮素和橘皮素的吸收可能表现为被动扩散。
影响口服药物生物利用度的原因很多,如药物溶解性、胃肠道的酸碱度、胃排空的速度和胃肠蠕动等,还有可能是肠道菌群作用、肠道屏障作用、药物外排和肠上皮细胞的代谢。因此研究药物吸收和代谢特点成为口服药物开发的主要环节,而在体单向肠灌流模型为其提供了重要的方法。大鼠在体肠灌流模型技术成熟,目前已被广泛应用于研究各类单体药物及中药复方的吸收机制[24-27]。本实验印证了将大鼠在体肠灌流模型应用于研究保健食品的功能因子在肠道吸收机制的可行性,若结合体内代谢动力学研究,可为保健食品的剂型及剂量设计提供参考依据。
[1] 谭晓斌, 贾晓斌, 陈彦, 等. 在体肠灌流模型及其在中药研究中的应用[J]. 中成药, 2008, 29(11): 1665-1668.
[2] SCHURGERS N, BIJDENDIK J, TUKKER J J, et al. Comparison of four experimental techniques for studying drug absorption kinetics in anesthetized rat in situ[J]. Journal of Pharmaceutical Sciences, 1986, 75(2): 117-119.
[3] FAGERHOLM U, JOHANSON M, LENNEMÄS H. Comparison between permeability coefficients in rat and human jejunum[J]. Pharmaceutical Research, 1996, 13(9): 336-342.
[4] le CORRE P, DOLLO G, CHEVANNE F, et al. Influence of hydroxypropyl-β-cyclodextrin and dimethy-β-cyclodextrin on diphenhydramine intestinal absorption in a rat in situ model[J]. International Journal of Pharmaceutics, 1998, 169(2): 221-228.
[5] 王春英, 李敏, 袁志芳, 等. 二苯乙烯苷大鼠在体胃肠吸收动力学研究[J]. 中草药, 2008, 39(8): 1215-1219.
[6] 栾立标, 赵暖. 水飞蓟宾在大鼠小肠中的吸收特性[J]. 药学学报, 2006, 41(2): 138-141.
[7] MANTHEy J A, GUTHRIE N, GROHMANN K. Biological properties of citrus fl avonoids pertaining to cancer and inf l ammation[J]. Current Medicinal Chemistry, 2001, 8(2): 135-153.
[8] WANG Dandan, WANG Jian, HUANG Xuehui, et al. Identification of polymethoxylated fl avones from green tangerine peel (Pericarpium Citri Reticulatae Viride) by chromatographic and spectroscopic techniques[J]. Journal of Pharmaceutical and Biomedical Analysis. 2007, 44(1): 63-69.
[9] 莫云燕, 黄庆华, 游明霞. 多抗氧化指标响应面法优化茶枝柑皮提取工艺[J]. 食品工业科技, 2012, 15(33): 215-219.
[10] 李娆玲, 黄庆华, 游明霞, 等. 茶枝柑皮提取物血清药物化学的初步研究[J]. 安徽农业科学, 2012, 40(5): 2666-2668.
[11] 李娆玲. 茶枝柑皮提取物抗氧化有效成分的研究[D]. 中山: 广东药学院, 2012: 44-52.
[12] 甘伟发, 黄庆华, 吉国辉, 等. 茶枝柑皮提取物中黄酮类成分的含量测定[J]. 广东药学院学报, 2013, 29(3): 1-4.
[13] 聂淑芳, 潘卫三, 杨星钢, 等. 对大鼠在体肠单向灌流技术中重量法的评价[J]. 中国新药杂志, 2005, 14(10): 1176-1179.
[14] JEONG E J, LIU yan, LIN Huimin, et al. in situ single-pass perfused rat intestinal model for absorption and metabolism[M]// yAN Zhengyin, CALDWELL G W. Optimization in Drug Discovery. Totowa: Humana Press, 2004: 65-76.
[15] LENNERNÄS H, AHRENSTEDT Ö, HÄLLGREN R, et al. Reginal jejunal perfusion, a new in vivo approach to study oral drug absorption in man[J]. Pharmaceutical Research, 1992, 9(10): 1243-1251.
[16] 张晓雷, 周明眉, 贾伟, 等. 在体肠灌流模型及其在中药中的应用[J].上海中医药大学学报, 2010, 24(3): 87-92.
[17] 胡一桥, 郑梁元, 钱陈钦, 等. 离子型药物酚红的小肠吸收研究[J].中国药科大学学报, 1996, 27(6): 355-359.
[18] 吴雅娜, 栾立标. 独活有效成分大鼠在体单向灌流肠吸收[J]. 药学学报, 2008, 43(1): 102-107.
[19] 廖正根, 平其能, 萧伟, 等. 桂枝茯苓胶囊中有效成分的大鼠在体肠吸收研究[J]. 中国天然药物, 2005, 3(5): 303-307.
[20] 王宇红, 张水寒, 杨永华, 等. 心宁复方有效部位在大鼠胃肠中的吸收动力学[J]. 中成药, 2007, 29(6): 815-819.
[21] 王磊, 苏学素, 付陈梅, 等. 柑橘中多甲氧基黄酮生物活性及应用研究进展[J]. 食品科学, 2009, 30(7): 285-290.
[22] 曹颖, 李永吉, 吕邵娃. 大鼠在体肠灌流模型在中药研究中的应用[J].中医药学报, 2010, 38(3): 134-136.
[23] 梁文权, 李高, 刘建平. 生物药剂学与药物动力学[M]. 北京: 人民卫生出版社, 2009: 27.
[24] 陈颖, 杨庆, 邹丽娟, 等. 黄连生物碱在大鼠在体单向肠灌流模型中的转运特性研究[J]. 中国中药杂志, 2011, 36(24): 3523-3527.
[25] FETIH G, HABIB F, KATSUMI H, et al. Excellent absorption enhancing characteristics of NO donors for improving the intestinal absorption of poorly absorbable compound compared with conventional absorpiton enhancers[J]. Drug Metabolism and Pharmacokinetics, 2006, 21(3): 222-229.
[26] 许蕾, 杨中林. 大鼠在体单向灌流法研究橙皮苷肠道吸收性质[J].中国药学杂志, 2009(8): 594-597.
[27] 孙勇兵, 孙进, 施世良, 等. 阿糖胞苷5’-缬氨酸酯前体药物的小肠吸收机制[J]. 沈阳药科大学学报, 2009, 25(12): 992-996.
Intestinal Absorption Properties in Rats of Nobiletin and Tangeretin in Ethanol Extract of Citrus reticulata “Chachi” Peel by Single Pass Perfusion Model
YUAN Han-qi1, HUANG Qing-hua1,*, ZHANG Xiao-ying1, ZHOU Zi-xiong1, YOU Ming-xia2
(1. College of Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006, China; 2. By-Health Co. Ltd., Zhuhai 519040, China)
Objective: To study the intestinal absorption behaviors of two polymethoxylated flavonoids (PMFs), nobiletin and tangeretin, from Citrus reticulata “Chachi” peel. Methods: In situ single pass perfusion model was used to investigate the absorption rate constant (Ka) and apparent absorption coefficient (Kapp), based on nobiletin and tangeretin concentration in the solution before and after perfusion. Results: An obvious difference betwe en nobiletin and tangeretin was observed for their absorption in whole intestinal sections. For each of the two PMFs, the absorption in whole intestinal sections was not significantly different. The concentration and pH of PMFs exerted no remarkable effect on intestinal absorption. Conclusion: Nobiletin and tangeretin from Citrus reticulata “Chachi” peel can be well absor bed in whole intestinal sections, especially in the jejunum. Their transport mechanism in vivo is sim ilar to p assive diffusion.
Citrus reticulata “Chachi” peel; in situ single pass perfusion; nobiletin; tangeretin
R945
A
1002-6630(2014)15-0263-05
10.7506/spkx1002-6630-201415053
2013-10-21
珠海市科技工贸和信息化局企业技术创新项目(珠经贸字(2009)414号)
源瀚祺(1989—),男,硕士研究生,研究方向为保健食品开发。E-mail:keithyuen@126.com
*通信作者:黄庆华(1954—),女,教授,本科,研究方向为中药保健食品开发与质量控制。E-mail:hqh1003@163.net

