根皮苷对高脂膳食喂饲仓鼠氧化损伤保护机制的研究
申婷婷,马 娜,李成龙,余 轩,薛文琛,王 浩,*
(1.天津科技大学生物工程学院,天津 300457;2.天津科技大学食品工程与生物技术学院,天津 300457)
根皮苷对高脂膳食喂饲仓鼠氧化损伤保护机制的研究
申婷婷1,2,马 娜1,2,李成龙2,余 轩2,薛文琛1,王 浩2,*
(1.天津科技大学生物工程学院,天津 300457;2.天津科技大学食品工程与生物技术学院,天津 300457)
以饲喂高脂膳食的仓鼠为动物模型,研究根皮苷在喂饲高脂膳食仓鼠体内的抗氧化活性。实验动物随机分为对照组和3 个实验组(3、6、9 g/kg根皮苷),6 周后测定仓鼠血清、心脏、肾脏及肝脏中抗氧化酶超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)和总抗氧化力(total antioxidant capacity,T-AOC)的活力、丙二醛(malonaldehyde,MDA)含量及采用荧光定量聚合酶链式反应(real time-polymerase chain reaction,RT-PCR)法检测肝脏中抗氧化相关基因mRNA表达水平。抗氧化酶活力测定结果显示,给予根皮苷后血清、心脏、肾脏及肝脏中SOD、GSH-Px、CAT酶活力均有升高,氧化产物MDA含量显著降低。RT-PCR结果显示,3 个不同剂量根皮苷实验组CuZn-SOD、Mn-SOD、GSH-Px、血红素加氧酶1(heme oxygenase 1,HO-1)、核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)mRNA表达水平与对照组相比均极显著升高(P<0.01);给予6、9 g/kg根皮苷,CAT基因表达水平较对照组极显著升高(P<0.01)。因此,根皮苷对高脂膳食喂饲仓鼠氧化应激损伤的保护作用可能是通过激活抗氧化基因Nrf2表达,并上调抗氧化基因SOD、GSH-Px、CAT、HO-1 mRNA表达水平,进而增加抗氧化酶的活力实现的。
根皮苷;抗氧化;酶活力;基因表达
线粒体是氧化磷酸化供能的主要场所,在氢质子和氧供应失调或者在机体代谢和耗能时,会生成自由基,有氧生物产生自由基是不可避免的[1],特别是当机体处于一定生理(年老)、病理或者能量过剩状态时,会产生过多的自由基,当超出了机体清除能力时,自由基便会攻击细胞内的蛋白质、脂质及DNA等,且受损的DNA不易降解会对机体造成严重损伤,最终造成细胞死亡,机体组织功能受损[2-6]。
为维持内环境稳态机体本身存在自由基清除体系。Nrf2-Keap1/ARE通路是机体内的一种复杂且极为重要的内源性抗氧化应激通路[7]。正常生理情况下,Keap1与Nrf2紧密结合,抑制Nrf2诱导靶基因的表达;当机体处于氧化应激状态时,Nrf2与Keap1解离[8],Nrf2由胞质转入细胞核中,识别并与抗氧化反应元件(antioxidant response element,ARE)结合,启动Ⅱ相解毒酶和抗氧化酶基因的转录,提高细胞对氧化应激的反应能力。另外,Nrf2是超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)、血红素加氧酶1(heme oxygenase 1,HO-1)的上游基因,Nrf2的激活可以促进抗氧化基因的表达,且能对抗衰老引起的免疫力下降[9]。其中,SOD能催化O2-转化为H2O2,CAT和GSH-Px等能将H2O2转化成H2O。HO-1是血红素降解反应的限速酶[10],催化血红素降解为胆绿素、CO及Fe2+,胆绿素再在还原酶作用下转化为胆红素,血红素的3 种代谢产物均具有抗氧化功能[11]。
根皮苷富含酚羟基,多存在于在苹果和多穗柯甜茶嫩叶中,多个研究表明根皮苷具有抗氧化、降血糖等活性[12-13]。高脂膳食能够导致动物体内能量代谢失衡,进而造成机体氧化应激损伤[14],本实验以饲喂高脂膳食仓鼠为动物模型,研究根皮苷对仓鼠氧化应激损伤的保护作用机制,为富含根皮苷的苹果渣深度开发应用提供基础研究。
1 材料与方法
1.1 材料与试剂
基础饲料 北京维通利华实验动物技术有限公司;根皮苷 天津尖峰天然产物研究开发有限公司。
丙二醛(malondialdehyde,MDA)测定试剂盒、谷胱甘肽过氧化物酶(GSH-Px)测试盒、超氧化物歧化酶(S OD)、总抗氧化能力(total antioxidant capacity,T-AOC)测试盒 南京建成生物工程研究所;Trizol试剂、cDNA反转录试剂盒、SYBR Green 日本TaKaRa公司。
1.2 仪器与设备
Myclcyer PCR仪、MyiQ2 Real Time-PCR仪 美国Bio-Rad公司;UVmini-1240紫外-可见分光光度计 日本岛津公司;冷冻离心机 美国Thermo公司。
1.3 动物
仓鼠(Mesocricetus auratus),清洁级,36 只,(125±10)g,雄性,购自北京维通利华实验动物技术有限公司。
1.4 方法
1.4.1 动物饲养条件及实验分组
动物饲养条件:屏障系统动物房,温度(22±2)℃,相对湿度40%~60%,控制照明时间为12 h,适应1 周后开始实验。
实验分组:将健康仓鼠随机分成4 组,每组9 只,分别为对照组、低剂量组(3 g/kg根皮苷)、中剂量组(6 g/kg根皮苷)、高剂量组(9 g/kg根皮苷)。高脂饲料配方:玉米淀粉408 g/kg、酪蛋白242 g/kg、蔗糖119 g/kg、猪油150 g/kg、矿物质混合物40 g/kg(AIN93)、维生素混合物20 g/kg(AIN93)、DL蛋氨酸1 g/kg,实验组在此基础上添加3、6、9 g/kg根皮苷。仓鼠饲养6 周,实验期间自由摄食摄水。
实验6 周后,仓鼠禁食不禁水12 h,CO2麻醉后取血、处死并解剖。4 ℃离心分离血清后-80 ℃保存,用于后期SOD、GSH-Px、CAT酶活力及MDA含量检测。收集心脏、肾脏、肝脏等重要器官,生理盐水清洗后-80 ℃保存。
1.4.2 血清、心脏、肾脏、肝脏中酶活力的测定
血清、心脏、肾脏、肝脏中SOD、GSH-Px、CAT活力及MDA含量测定具体参照文献[13]方法。
1.4.3 RT-PCR检测肝脏中抗氧化基因CuZn-SOD、Mn-SOD、CAT、GSH-Px、OH-1、Nrf2 mRNA表达水平
Trizol法提取仓鼠肝脏中的RNA,反转录得cDNA,-80 ℃保存,具体方法参照反转录试剂盒。SYBR Green法检测基因表达水平,以GAPDH为内参基因。基因引物信息见表1。

表1 仓鼠抗氧化基因实时定量引物Table 1 RT-PCR primers used to measure mRNA expression levels of hepatic antioxidant enzyme genes
1.5 数据分析
2 结果与分析
2.1 根皮苷对仓鼠血清、心脏、肾脏中SOD、GSH-Px、CAT酶活力及MDA含量的影响
T-AOC通过测 定反应体系中Fe3+还原为Fe2+的量,反映了体系内自由基总的清除能力。MDA是自由基作用于脂质发生过氧化反应后的终产物,会引起蛋白质、核酸等大分子交联聚合,具有细胞毒性。
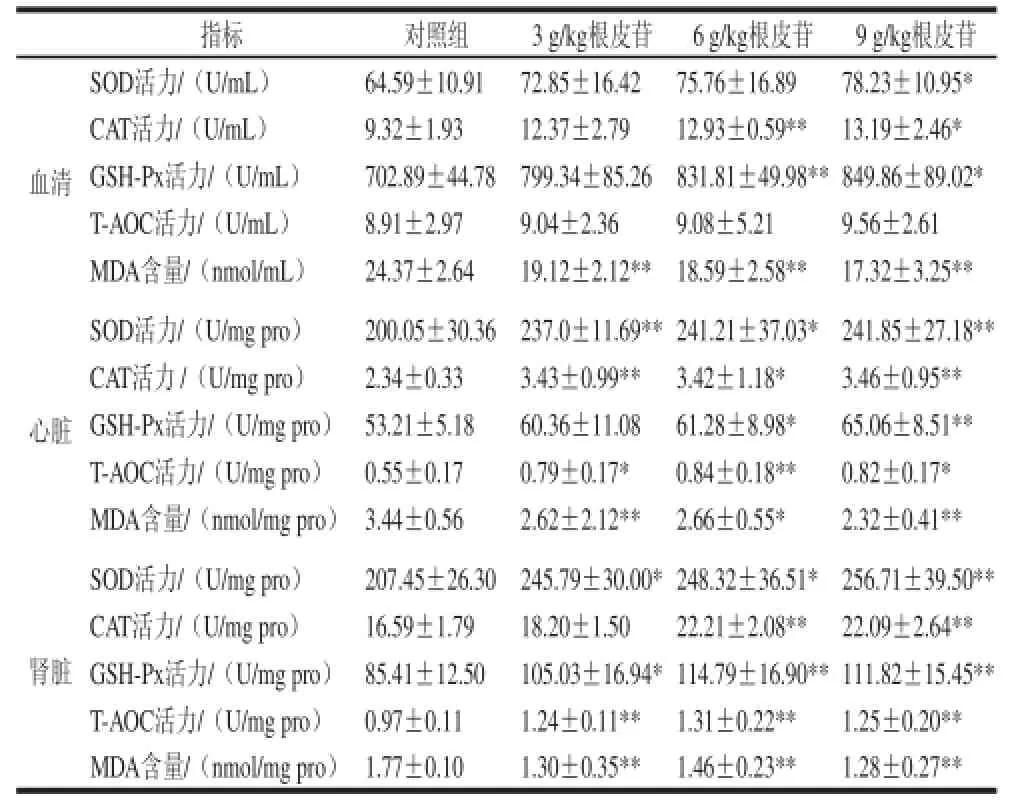
表2 给予不同剂量根皮苷对仓鼠血清、心脏、肾脏中抗氧化酶活性及氧化产 物MDA生成量的影响Table 2 Effect of different doses of dietary supplementation with phlorizin on antioxidant enzyme activities and MDA content in plasma, kidney and heart of hamsters
由表2可知,实验组血清总SOD活力与对照组相 比,低剂量组、中剂量组有升高趋势但无显著性(P>0.05),高剂量组显著升高(P<0.05);GSH-Px酶活性在3、9 g/kg根皮苷剂量组较对照组显著升高(P<0.05),6 g/kg根皮苷剂量组与对照组相比极显著升高(P<0.01);CAT活力测定结果显示6 g/kg根皮苷可以极显著升高其酶活性(P<0.01),9 g/kg根皮苷显著升高其酶活力(P<0.05);血清中T-AOC活性呈上升趋势,但无显著性差异(P>0.05);氧化产物MDA含量3 个实验组与对照组相比极显著减少(P<0.01)。
心脏抗氧化酶活力及MDA含量测定结果显示:3、9 g/kg根皮苷剂量组与对照组相比,SOD、CAT酶活力极显著升高(P<0.01),6 g/kg剂量组SOD、CAT酶活力显著升高(P<0.05);给予3、9 g/kg根皮苷,T-AOC活性显著升高(P<0.05),6 g/kg根皮苷剂量组T-AOC活性极显著升高(P<0.01);6 g/kg根皮苷剂量组GSH-Px酶活力显著升高(P<0.05),9 g/kg剂量组极显著升高(P<0.01);氧化产物MDA含量在3、9 g/kg根皮苷实验组与对照组相比极显著降低(P<0.01),6 g/kg根皮苷剂量组显著降低(P<0.05)。
3、6 g/kg根皮苷剂量组与对照组相比肾脏中SOD酶活性显著升高(P<0.05),9 g/kg根皮苷剂量组SOD酶活性极显著升高(P<0.01);与对照组相比,3 g/kg根皮苷剂量组GSH-Px酶活力显著升高(P<0.05),6、9 g/kg根皮苷剂量组GSH-Px酶活力极显著升高(P<0.01);CAT酶活力6、9 g/kg实验组较对照组极显著升高(P<0.01);给予根皮苷能极显著升高仓鼠肾脏中T-AOC活力(P<0.01)和降低氧化产物MDA水平(P<0.01)。
2.2 根皮苷对肝脏中抗氧化酶活性及抗氧化相关基因表达的影响
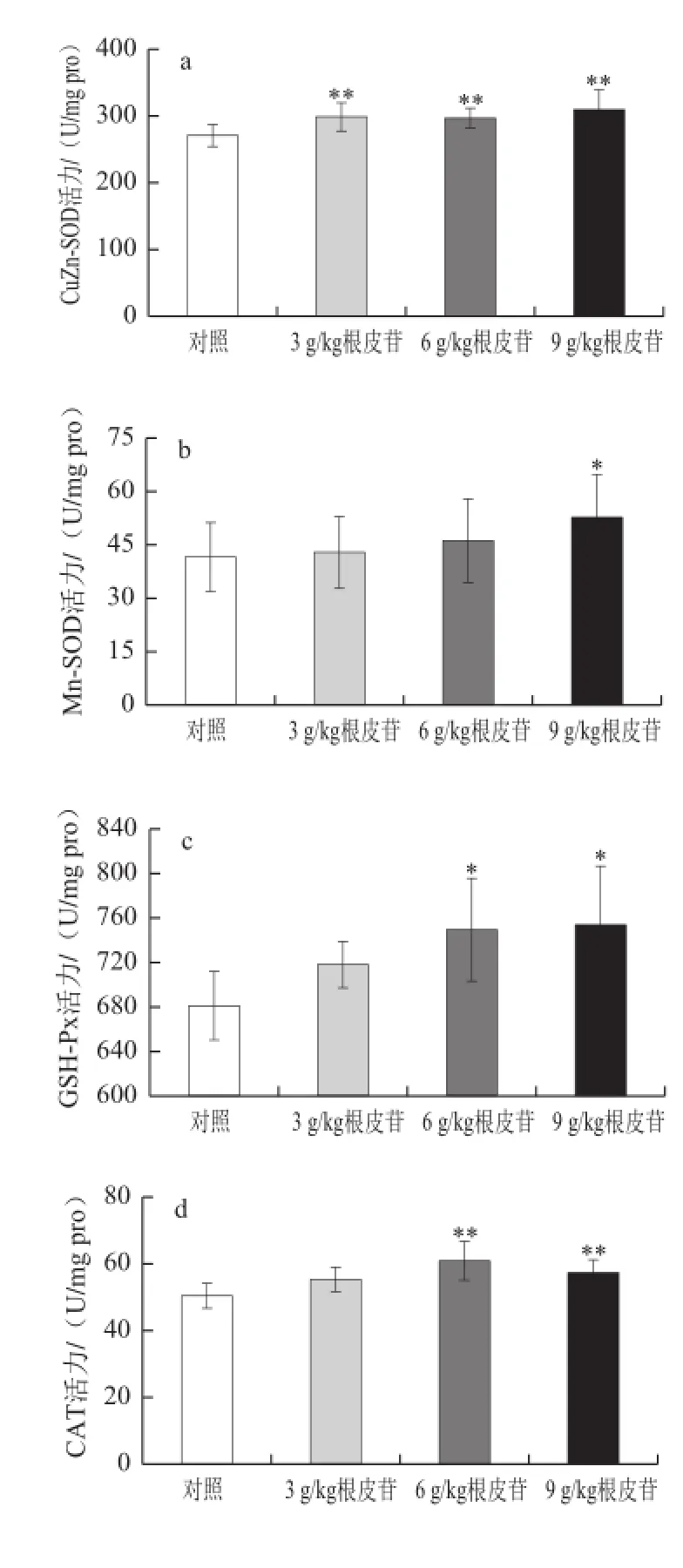

图1 不同剂量根皮苷对仓鼠肝脏中抗氧化酶活性及氧化产物MDDAA含量的影响(Fig.1 Effects of different doses of dietary supplementation with phlorizin on antioxidant enzyme activities in heart of hamsters
由图1a可知,肝脏中CuZn-SOD酶活力测定结果显示,3 g/kg根皮苷组CuZn-SOD酶活力较对照组显著升高(P<0.05),6、9 g/kg根皮苷组CuZn-SOD酶活力极显著升高(P<0.01);由图1b可知,Mn-SOD酶活力较对照组升高,且9 g/kg剂量组具有显著性(P<0.05);由图1c可知,给予根皮苷后肝脏中GSH-Px酶活力增加,与对照组相比6、9 g/kg根皮苷剂量组GSH-Px酶活力显著升高(P<0.05);由图1d可知,给予6、9 g/kg根皮苷,肝脏中CAT酶活性极显著升高(P<0.01);由图1e可知,实验组肝脏中T-AOC活力较对照组都极显著升高(P<0.01);由图1f可知,给予根皮苷能够极显著降低肝脏中氧化产物MDA含量(P<0.01)。
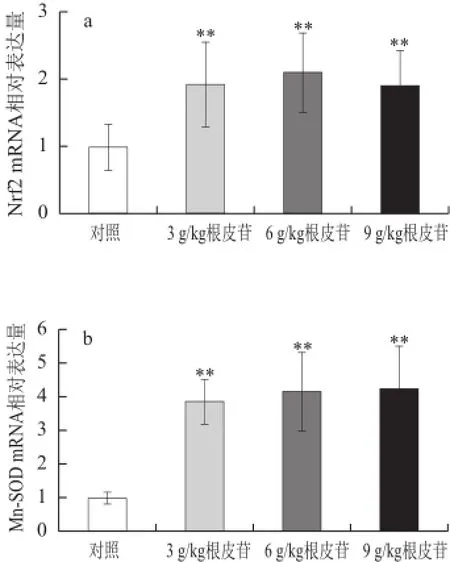
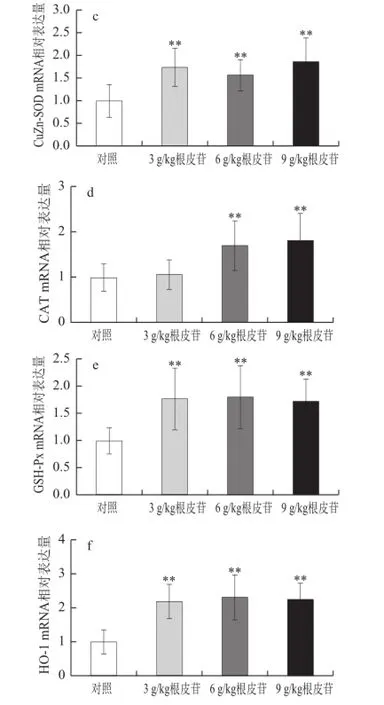
图2 不同剂量根皮苷对仓鼠肝脏中抗氧化酶CuZn-SOD、Mn-SOODD、CAT、GSH-Px、 HO-1和Nrf2 mRNA表达水平的影响Fig.2 Effects of different doses of dietary supplementation with phlorizin on antioxidant enzyme gene mRNA expression in hamsters
由图2可知,与对照相比,给予3、6、9 g/kg根皮苷,肝脏中Mn-SOD、CuZn-SOD、GSH-Px、HO-1、Nrf2 mRNA表达水平极显著上调(P<0.01);给予6、9 g/kg根皮苷亦能显著上调肝脏中CAT基因表达水平(P<0.01)。
3 讨 论
目前,已有多个研究证明苹果多酚能保护机体抵抗氧化应激、慢性动脉粥样硬化、冠心病、癌症、中风及炎症等[15-17],如Lu Yinrong等[18]对苹果皮渣中含有的天然活性成分的抗氧化活性进行了研究,发现其中含有根皮苷、原花青素B2、绿原酸等具有很强的 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和超氧阴离子自由基清除能力的物质,在体外根皮苷的超氧阴离子清除能力是VC和VE的2~3 倍[15]。血清、心脏、肾脏、肝脏中SOD、GSH-Px、CAT酶活力测定实验结果显示,给予根皮苷后动物体内抗氧化酶及总抗氧化活力升高,氧化产物MDA水平降低。这与冯天艳等[19]研究发现的根皮苷对小鼠CCl4致急性肝损伤具有保护作用,能显著降低肝组织MDA含量,升高肝组织T-AOC和GSH-Px活力结果一致。另外,Wang Hao等[20]研究发现山楂黄酮可以升高加速衰老鼠体内抗氧化酶活力及上调肝脏内CuZn-SOD、Mn-SOD、CAT mRNA表达,这与本实验研究结果显示的根皮苷实验组CuZn-SOD、Mn-SOD、GSH-Px、CAT、Nrf2、HO-1 mRNA表达水平与对照组相比均极显著升高(P<0.05)一致。
因此,根皮苷对高脂膳食仓鼠氧化应激保护作用可能是通过激活Nrf2 mRNA及其蛋白质表达,进而上调抗氧化基因SOD、GSH-Px、CAT、HO-1 mRNA转录水平,增加抗氧化酶的活性实现的。
[1] ALLEN R G, TREINI M. Oxidative stress and gene regulation[J]. Free Radical Biology & Medicine, 2000, 28(3): 463-499.
[2] 王琳琳, 凌文华. 线粒体DNA氧化损伤机制的探讨[J]. 疾病控制杂志, 2000, 4(1): 79-83.
[3] KOWALTOWSKI A J, VERCESI A E. Mitochondrial damage induced by conditions of oxidative stress[J]. Free Radical Biology & Medicine, 1999, 26(3/4): 463-471.
[4] YU E, MERCER J, BENNETT M. Mitochondria in vascular disease[J]. Cardiovascular Research, 2012, 95(2): 173-182.
[5] DAIBER A. Redox signaling (cross-talk) from and to mitochondria involves mitochondrial pores and reactive oxygen species[J]. Biochimica et Biophysica Acta-Bioenergetics, 2010, 1797(6/7): 897-906.
[6] DIKALOV S. Cross talk between mitochondria and NAPDH oxidases[J]. Free Radical Biology and Medicine, 2011, 51(7): 1289-1301.
[7] 钟敏. Nrf2-Keap1抗氧化系统研究进展[J]. 中国公共卫生, 2006, 22(3): 360-362.
[8] LI Wenge, KONG A N. Molecular mechanisms of Nrf2-mediated antioxidant response[J]. Molecular Carcinogenesis, 2009, 48(2): 91-104.
[9] 蔡维霞, 张军, 胡大海. 氧化和化学应激的防御性转导通路: Nrf2/ ARE[J]. 中国生物化学与分子生物学报, 2009, 25(4): 297-303.
[10] KIM J S, SONG H J, KO S K, et al. Quercetin-3-O-β-D-glucuronopyranoside (QGC)-induced HO-1 expression through ERK and PI3K activation in cultured feline esophageal epithelial cells[J]. Fitoterapia, 2010, 81(2): 85-92.
[11] 朱子夫, 马莉. HO-1抗氧化损伤的研究进展[J]. 医学综述, 2010, 16(15): 2266-2270.
[12] EHRENKRANZ J R, LEWIS N G, KAHN C R, et al. Phlorizin: a review[J]. Diabetes-Metabolism Research and Reviews, 2005, 21(1): 31-38.
[13] ROSSETTI L, SMITH D, SHULMAN G I, et al. Correction of hyperglycemia with phlorizin normalizes tissue sensitivity to insulin in diabetic rats[J]. Journal of Clinical Investigation, 1987, 79(5): 1510-1515. [14] PFLUGER P T, HERRANZ D, VELASCO-MIGUEL S, et al. Sirt1 protects against high-fat diet-induced metabolic damage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(28): 9793-9798.
[15] LEE K W, KIM Y J, KIM D O, et al. Major phenolics in apple and their contribution to the total antioxidant capacity[J]. Journal of Agricultural and Food Chemistry, 2003, 51(22): 6516-6520.
[16] LOTITI S B, FREI B. Relevance of apple polyphenols as antioxidants in human plasma: contrasting in vitro and in vivo effects[J]. Free Radical Biology & Medicine, 2004, 36(2): 201-211.
[17] BOYER J, LIU Ruihai. Apple phytochemicals and their health benefits[J]. Nutrition Journal, 2004, 3: 5.
[18] LU Yinrong, YEAP FOO L. Antioxidant and radical scavenging activities of polyphenols from apple pomace[J]. Food Chemistry, 2000, 68(1): 81-85.
[19] 冯天艳, 方荣, 邓改改, 等. 根皮苷对小鼠CCl4急性肝损伤的保护作用[J]. 中药药理与临床, 2010, 26(5): 47-50.
[20] WANG Hao, ZHANG Zesheng, ZUO Yanbo, et al. Hawthorn fruit increases the antioxidant capacity and reduces lipid peroxidation in senescence-accelerated mice[J]. European Food Research Technology, 2011, 232(5): 743-751.
Mechanism by Which Phloridzin Protects against High-Fat Diet-Induced Oxidative Damage in Hamster
SHEN Ting-ting1,2, MA Na1,2, LI Cheng-long2, YU Xuan2, XUE Wen-chen1, WANG Hao2,*
(1. College of Biological Engineering, Tianjin University of Science and Technology, Tianjin 300457, China; 2. College of Food Engineering and Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China)
Excessive exposure to dietary lipids causes deranged homeostasis of cellular energy metabolism and oxidative damage. Phlorizin is rich in phenolic hydroxyl groups which have been proved to play an antioxidant role in vivo and in vitro. This study aimed to investigative the antioxidant activity of phlorizin in hamsters fed a high fat diet. Totally, 36 hamsters were fed either control diet or one of the three experimental diets containing 3, 6, or 9 g/kg phlorizin for 6 weeks. Then the enzyme activities of superoxide dismutase (SOD), glutathione peroxidase (GSH-Px), catalase (CAT), total antioxidant capacity (T-AOC) and the content of malonaldehyde (MDA) in hamster serum, heart, kidney and liver were assayed. Finally, the mRNA expression levels of antioxidant enzymes including SOD, GSH-Px, CAT, heme oxygenase-1 (HO-1) and F-E2-related factor 2 (Nrf2) were detected by real-time PCR (RT-PCR). Antioxidant enzyme activity assays showed that the activities of SOD, GSH-Px and CAT in serum, heart, kidney and liver were increased and the content of MDA was significantly reduced by dietary phloridzin supplementation. RT-PCR results showed that the mRNA expression levels of CuZn-SOD, Mn-SOD, GSH-Px, HO-1 and Nrf2 were significantly increased compared with those of the control group (P < 0.01), while CAT gene in 6 and 9 g/kg groups were significantly increased (P < 0.01) compared with the control group. Therefore, the protection of phloridzin against oxidative stress injury in hamsters fed a high fat diet may be mediated through the induction of the expression of Nrf2 gene and the increases in the mRNA expression levels of SOD, GSH-Px, CAT, and HO-1, which in turn increases the activities of antioxidant enzymes.
phlorizin; antioxidant; enzyme activity; gene expression
TS201.4
A
1002-6630(2014)15-0221-05
10.7506/spkx1002-6630-201415045
2013-08-01
国家自然科学基金青年科学基金项目(31201322);“十二五”国家科技支撑计划项目(2012BAD33B05);天津市高等学校科技发展基金计划项目(20100609)
申婷婷(1988—),女,硕士研究生,主要从事食品营养学研究。E-mail:shenting890101@163.com
*通信作者:王浩(1979—),男,副教授,博士,主要从事食品营养学研究。E-mail:wanghao@tust.edu.cn

