基于生命周期建立清洁验证文件体系的方法
智晓日 贾晓艳
(奥星制药设备(石家庄)有限公司,河北石家庄050000)
0 引言
从2004年ICHQ8提出产品生命周期理论到现在已有10年的时间,但生命周期理论在制药行业的应用非常有限,尤其是国内制药企业对清洁验证生命周期方面的研究更是少之又少。自从2010版GMP实施以来,清洁验证受到了监管机构以及制药企业的普遍关注,不过从目前的现状来看,制药企业对清洁验证涉及到的清洁方法的开发重视程度明显不够,很多清洁方法都是来自设备厂家提供的通用方法,这就导致某些企业出现清洁验证不合格的现象。
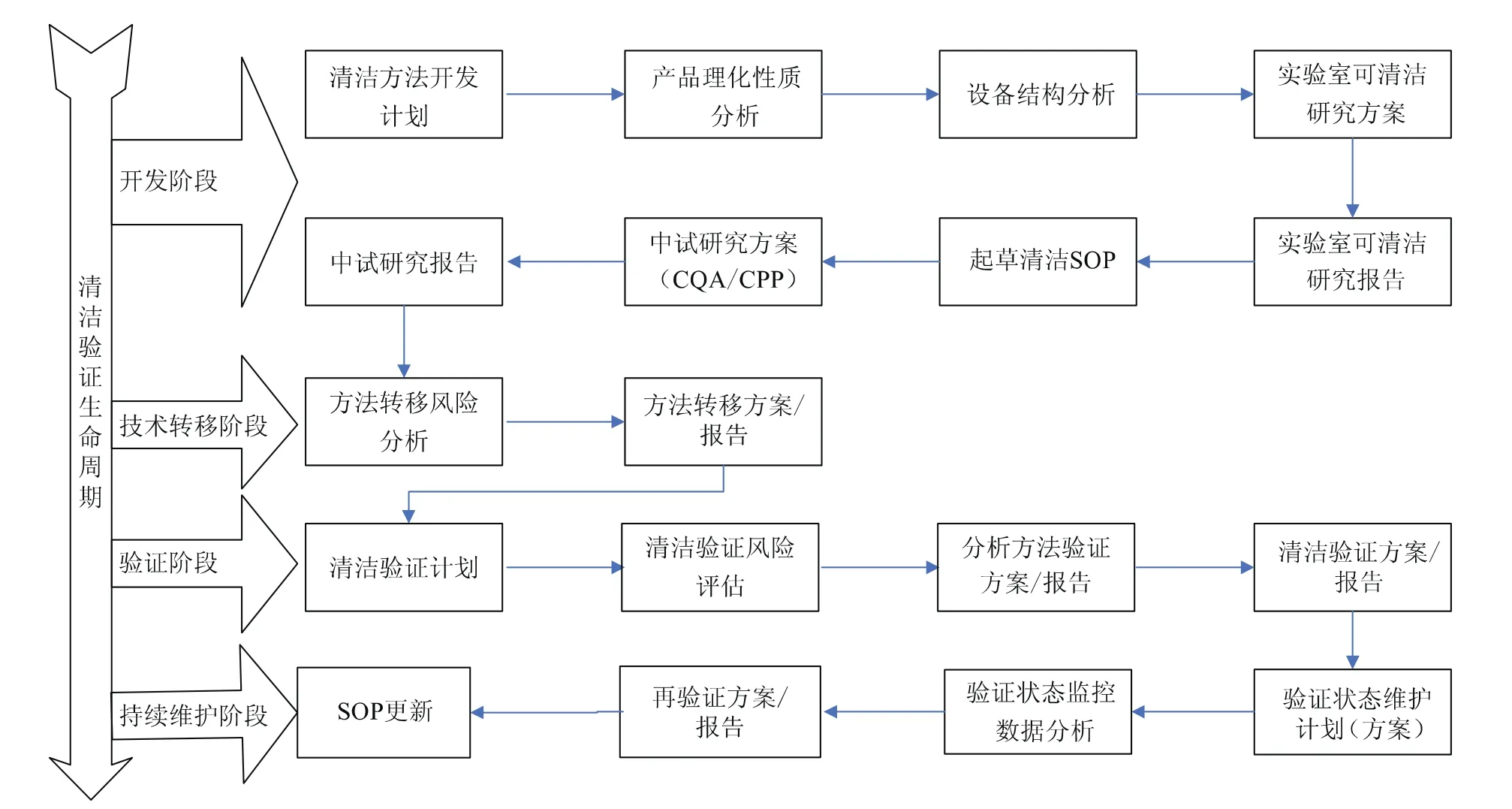
图1 清洁验证生命周期的关注重点
国家食品药品监督管理总局在2014年6月17日第2次发布了“确认与验证”附录征求意见稿,在最新的征求意见稿中提到“确认与验证应当贯穿于产品生命周期的全过程”。产品生命周期包括产品研发、技术转移、商业生产、产品退市这4个阶段,笔者在对多家制药企业清洁验证的咨询工作中发现,清洁验证生命周期的关注重点如图1所示。本文将基于生命周期的清洁验证文件体系(图1中各工作节点)作一介绍。
1 开发阶段
目前,清洁方法的开发在制药企业的应用相对薄弱,很多制药企业的清洁方法都是经验主义或者拿来主义的产物,没有经过系统的开发,这样的清洁工艺有很多问题,并不一定能够彻底解决清洁问题。因此,在开发阶段应该对以下几个方面进行考虑:
(1)制定清洁方法的开发计划,该计划制定的目的是明确产品清洁开发过程中,制药企业各个职能部门的职责、需要完成的任务以及完成任务的时间节点。另外,还需要在该阶段明确清洁方法开发的执行策略。一个好的计划对后续工作的开展有很好的引导作用,可以有效增强工作的主动性,减少盲目性,有利于工作有条不紊地进行。
(2)产品理化性质分析,包括公司产品所有的原料和辅料,在产品分析时需关注各原辅料的溶解度、毒理、药理等方面,通过对产品的理化性质分析,将有助于提高公司对产品的认识,有助于选择合适的清洁剂,并为制定合理有效的清洁方法提供帮助。
(3)设备结构分析,主要针对和产品直接接触的设备,可从设备是否有死角、设备是否有特殊材质以及材质和产品的反应、材质和清洗剂是否有化学反应等方面进行考虑。
(4)实验室可清洁性研究方案,是针对产品理化性质与设备结构的分析结果制定的在实验室进行相应的研究方案,其应考虑选择合适的清洁剂在特定的材质进行模拟清洗过程,并制定合理的可接受标准。同时,在报告中做出该清洁剂是否可以接受的结论。
(5)清洁SOP的起草,应结合前期研究成果并考虑设备的特殊结构,一般情况下的设备厂家提供的通用方法可作为参考,不建议直接采用,由于制药企业生产品种的多样性和产品本身成分的复杂性,若忽略了该过程,直接采用了设备制造企业提供的通用清洁方法,这样固然节省清洁方法的研发时间,但最后损害的是制药企业自己的利益。
(6)中试研究方案是根据企业开发的清洁规程(SOP)在中试车间进行中试规模的试验,从而明确清洁工艺的关键控制参数和关键质量属性。
2 技术转移阶段
清洁工艺的技术转移在制药企业的应用也比较薄弱,清洁工艺如果需要转移,则必须要有完善的研发体系,没有经过适当研究、开发的清洁工艺就相当于无根之萍。严格来说,清洁工艺是在研发部门开发出来的,这些技术只有转移到车间使用部门,才能使清洁技术产生应有的价值。然而,在转移过程中,企业经常会遇到某些障碍,如技术转移的时机、参与技术转移的人员,以及技术转移过程中技术输出方和接收方的沟通和组织形式、相关的文件等。
需要在技术转移阶段建立风险评估操作规程,根据操作规程进行风险分析并完成风险分析报告,再建立技术转移方案,在方案中需关注关键控制点及风险评估报告中的关键风险。
清洁工艺的转移有其特殊性,由于转出方和接受方的设备可能存在差距,因此转移过程需要评估双方设备的差距,包括设备形状、材质、自动清洗程度等因素。清洁工艺的技术转移应基于产品特性,并结合设备现状进行适当的再次开发。
3 验证阶段
验证阶段对制药企业来说比较熟悉,该阶段经过2010版GMP的实施已经深入人心,但是很多企业在某些方面还是做得不够好,比如没有制定清洁验证计划或者验证计划不够完善,以至于后期执行过程中出现较多的偏差。
清洁验证计划的目的是描述制药企业的验证计划、执行和报告清洁验证活动的过程,应描述产品清洁验证活动的执行和完成时间,通常会涵盖要清洗的设备、程序、材料、可接受标准、监测和控制参数、分析方法和取样方法等内容。
验证阶段还需要进行清洁验证风险评估,风险评估的目的是应用ICHQ9(质量风险管理)的原则,以及使用基本风险管理简易方法(流程图、检查表等)的风险管理工具,评估确定出某车间的所有产品中需要进行清洁验证的产品、设备的相关取样点设置以及影响清洁验证的潜在危险和关键控制点等,并记录在文件中,以保证清洗过程具有适宜的控制以及所有设备清洗程序有效。
清洁验证分析方法是为了确定用于测定残留或污染物的分析方法的特性和敏感性。如果测不到污染物或残留物,并不意味着清洁后没有残留的污染物,这只是表示在样品中不存在大于分析方法的灵敏度或检测极限等级的污染物。制药企业在进行清洁验证前应挑战分析方法,并结合所采用的取样方法,用于显示污染物可以从设备表面回收及回收的水平(50%、90%回收率等)。分析方法验证应该在清洁验证执行前完成。
建立清洁验证方案的目的是为了确认和记录与某产品直接接触的设备、系统或设施的标准清洁程序能够保证活性成分和上一批产品可能的残留物或潜在的微生物污染在预先所定义的可接受范围内,以防止对下一次生产产品的安全性和质量带来不利影响。
4 持续维护阶段
验证状态维护计划是在清洁验证完成之后进行的计划,该计划主要是为了保证清洁验证可以保持持续的验证状态,应制定监控措施、监控周期以及出现偏差或变更后的处理措施。在验证状态维护计划中还应规定监控数据的分析周期、何时进行再验证以及SOP在什么条件下需要更新等内容。
再验证方案、再验证周期一般根据产品的特性或工艺的稳定性来规定,清洁验证的再验证周期一般可定为每年1次。如果对清洁工艺有充分的认识,那么再验证时可以只进行1个批次。
SOP更新的目的是为了更好发地清洗产品。由于人员对清洗方法的认识加深以及自动清洗设备的引入都可能引起SOP更新,该变化需要经由质量保证部的确认才可生效,且生效后需要重新进行清洁验证风险评估及执行清洁验证。
验证维护是清洁验证过程的关键点,以验证状态的偏离、漂移或变更对后续生产的纯度、安全、质量等是否存在潜在不良影响。变更控制、定期监测和数据趋势分析是保证验证处于持续维护状态的主要工具。此外,培训是清洁工艺的重要控制方法,尤其是保证手工清洁一致性的主要机制。
5 结语
产品生命周期理论是制药企业强化自身管理的有力工具,随着中国制药法规向欧美等发达地区的靠拢,可以预见“确认和验证”在生命周期方面的应用会越来广泛。中国GMP附录“确认和验证”征求意见稿中引入生命周期理论就是一个明显的信号,而对于清洁验证在生命周期中的应用,国内制药行业在此方面的执行差距非常大,很多制药企业还没有这一概念。
本文基于生命周期理论,阐述了在该理论下的清洁工艺在制药企业从研发到持续维护阶段需要建立的文件体系,该文件体系不一定是最全面的,但如果能够灵活应用,相信能够为制药企业对清洁验证的生命周期方式的理解提供一定的帮助。

