赤麂源多杀性巴氏杆菌的分离鉴定
周跃塔,曾 泽,费 磊,张 斌,岳 华
(西南民族大学生命科学与技术学院,四川成都610041)
巴氏杆菌病(Pasteurellosis)主要是由多杀性巴氏杆菌(Pasteurella multocida)所引起的多种畜禽、野生动物及人类的一类传染病的总称[1]。急性病例以败血症和炎性出血过程为特征。牛、猪、鹅、鸭和兔的巴氏杆菌发病严重,危害较大[2-4]。人的病例少见,且多呈伤口感染。2013年9月本实验室对四川省某养殖户送检1只死亡赤麂进行病原学和病理学诊断,确诊为赤麂巴氏杆菌病死亡。本试验对赤麂源巴氏杆菌进行分离、鉴定和耐药性分析。本次系国内首次分离鉴定赤麂源巴氏杆菌,为赤麂临床疾病的诊断和治疗提供了参考依据。
1 材料与方法
1.1 材料
1.1.1 临床病料 无菌采集四川省某养殖场病死赤麂脑、心血、肝脏等病料。
1.1.2 主要试剂 TSA培养基、麦康凯培养基为杭州微生物有限公司产品;LB培养液为实验室自制;细菌微量生化鉴定管为杭州微生物试剂有限公司产品;DNA Markers为北京TIANGEN公司产品;Taq DNA 聚合酶(5U/μL )、dNTPs为宝生物工程(大连)有限公司产品。
1.1.3 主要仪器设备 CO2培养箱为美国Thermoforma公司产品;高速离心机(centrifuge 5804)为德国Eppendorf公司产品;PCR仪(my cyclerTM)、核酸电泳仪(powerpac universalTM)、凝胶成像系统(VerSa Doc2000)为美国Bio-Rad公司产品;超纯水仪(Milli-Q)为法国Millipore公司产品;核酸蛋白检测仪(DU800)为美国Beckman公司产品。
1.2 方法
1.2.1 细菌的分离培养和鉴定
1.2.1.1 细菌分离 将无菌采集的赤麂的脑、心血及肝脏等病料接种血清肉汤中进行增菌培养24h,分别划线接种血平板(含NAD)、含50mL/L血清TSA培养基和麦康凯培养基,置于37℃、体积分数为5%的CO2培养箱培养24h~48h,观察菌落形态。
1.2.1.2 染色镜检 培养后观察细菌菌落特征,挑取典型菌落进行革兰染色镜检。
1.2.1.3 生化鉴定 用接种针将待检测菌在无菌的工作台中接种于生化鉴定管中,置于37℃、体积分数为5%CO2培养箱培养24h~48h,观察并记录结果。
1.2.2 动物回归试验 将分离的菌种接种到血清肉汤培养24h,用灭菌生理盐水作5倍稀释。将20只小鼠分为4组,1组~3组为试验组,4组为对照组。1组~3组的每只小鼠分别腹腔注射0.1、0.2、0.3mL菌液,对照组注射0.3mL的生理盐水,观察发病情况。
1.2.3 耐药性分析 取所分离纯化后的细菌进行药敏实验。药物敏感性试验参照CLSI标准的药敏纸片法进行,选用β-内酰胺类,氨基糖苷类,喹诺酮类,四环素类等18种常用药敏纸片。
1.2.4 PCR鉴定 取所分离纯化后的细菌接种血清肉汤培养24h之后提取DNA,根据已建立好的多杀性巴氏杆菌的PCR检测方法[5]对提取的DNA进行检测,引物由宝生物工程(大连)有限公司合成。对提取的DNA进行PCR扩增,PCR扩增产物用10g/L琼脂糖凝胶电泳检测,观察结果。用PCR产物纯化回收试剂盒[宝生物工程(大连)有限公司产品],对PCR扩增产物进行纯化,纯化产物送上海生工生物工程技术服务有限公司测序。
2 结果
2.1 临床症状和病理变化
发病赤麂拉稀,跛行,右侧卧,胸部和前肢内侧水肿,之后2d~3d死亡。解剖后,胸腔有血色积液,心尖心包膜下有黄色胶冻样渗出物,心脏冠状沟弥漫性出血,心内膜刷状出血。肝脏刷状出血,肝变硬,颜色很深。肺脏表面有纤维性渗出,肺尖叶实变肉变。肠系膜淋巴结出血成黑色弥漫性出血大理石样变,质脆。膀胱尿液充盈。十二指肠出血,十二指肠系膜出血。其它脏器未见明显病理变化。
2.2 细菌分离结果
血平板培养24h,可见透明、圆形、隆起、湿润、露珠样针尖大小菌落,不产生溶血。在麦康凯培养基上不生长。
2.3 革兰染色结果
革兰染色可见阴性、短杆状或球杆状细菌,常单个存在。
2.4 生化鉴定结果
对该菌进行了10项生化指标检测。生化鉴定结果表明该菌对靛基质、吲哚、葡萄糖、蔗糖和甘露醇反应为阳性,能产生硫化氢,但对乳糖、鼠李糖、脲酶和卫矛醇反应为阴性。根据分离菌的生化特性,结合其形态染色特征和菌落特征。可以确定该分离菌为多杀性巴氏杆菌。
2.5 动物回归试验
动物接种后4h,先后出现精神沉郁、食欲废绝等症状,接种0.3mL/只小鼠8h死亡;接种0.1mL/只小鼠和0.2mL/只小鼠均在48h内死亡,剖检可见典型的败血症变化。对照组无发病或死亡。将病变脏器进行细菌分离和鉴定,结果与赤麂分离鉴定细菌一致。
2.6 药敏试验结果
取所分离细菌进行药物敏试验。药物敏感性试验参照CLSI标准(2010版)的药敏纸片法进行,选用链霉素、头孢噻吩等18种药敏片进行药敏试验。结果如下,分别对先锋V、头孢他定、单环菌素、亚胺配能、头孢氨噻肟、头孢吡肟敏感;对头孢噻吩、左氟沙星、头孢西丁那、丙氟哌酸、诺氟沙星中敏、对丁胺卡那、氧哌泰青霉素、呋喃唑酮、庆大霉素、氨苄西林及链霉素耐药。
2.7 PCR鉴定结果
PCR扩增产物用10g/L琼脂糖凝胶电泳检测,结果(图1)显示扩增片段与预期的460bp相一致。用PCR纯化试剂盒对PCR扩增产物进行纯化,纯化产物送上海生工生物工程技术服务有限公司测序。测序结果在NCBI中Blast比对分析发现,与GenBank中已收录的多杀性巴氏杆菌相应的基因序列同源性达100%,进一步确定从赤麂分离的细菌为多杀性巴氏杆菌。由此可以确诊该养殖场发病赤麂是由多杀性巴氏杆菌感染引起的。
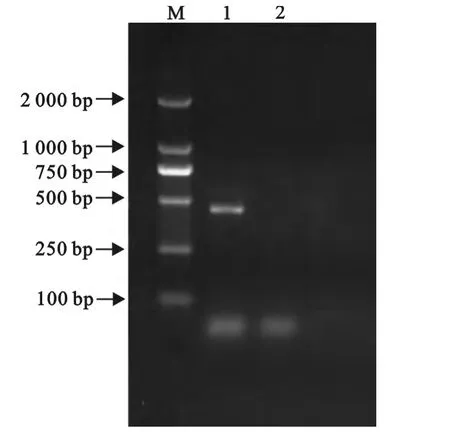
图1 PCR鉴定结果Fig.1 PCR identification of Pasteurella multocida
3 讨论
多杀性巴氏杆菌病是造成全球多种动物养殖业损失的一种重要细菌病[6]。巴氏杆菌为条件致病菌,因此巴氏杆菌病的流行与动物的抵抗力有密切关系,不良因素的刺激易引起该病的发生和传染[7-8]。该病多在冬春两季气候骤变及长途运输等应激条件下,机体抵抗力降低时病原菌侵入并大量繁殖,经淋巴液进入血液,发生内源性传染。Bengeys细菌学鉴定手册中,引起巴氏杆菌病的病原主要有多杀性巴氏杆菌、溶血性巴氏杆菌、嗜肺巴氏杆菌及脲巴士杆菌等。该属细菌不同菌株的致病性不同,由于动物种类不同,该菌的检出率也有很大的差异、多种野生动物都可以感染发病。
本试验从临床送检的赤麂病料中分离的病原进行染色观察、培养特性、生化特性等系统分析,确定为多杀性巴氏杆菌。对小鼠的感染性试验呈现致死性,说明此菌株的毒力较强。因此,可确诊该赤麂因运输应激,抵抗力下降,感染巴氏杆菌,这是国内外首次报道巴氏杆菌致病的赤麂死亡。该研究可为临床上赤麂疾病的诊断提供参考依据。
多杀性巴氏杆菌极易产生耐药性且以多重耐药为主,目前,对抗生素或抗菌药物的耐药性已相当严重[8-11],因此,通常通过药敏试验筛选出高敏药物进行治疗。此次从赤麂分离到的多杀性巴氏杆菌,在18种抗生素中对丁胺卡那、氧哌泰青霉素、呋喃唑酮、庆大霉素、氨苄西林及链霉素均耐药,这可能跟抗生素的剂量不断加大,品种不断更新,随之使分离的菌株耐药性不断上升有关,使不少病例形成了抗生素广泛大量使用与耐药菌株的顽强与递增这样一个恶性循环。由此看来,对动物的治疗之初,就应根据致病菌株的特性,药敏试验,合理使用抗生素而且不可随意用药。
[1]唐先春,吴 斌,陈焕春.产毒多杀性巴氏杆菌研究进展[J].动物医学进展,2003,10(5):14-17.
[2]杨泽晓,周 香,王 印,等.肉鹅巴氏杆菌病的诊断[J].动物医学进展,2013,34(1):119-122.
[3]张爱芹,郭东春,刘家森,等.多杀性巴氏杆菌PurF蛋白的原核表达及多克隆抗体制备[J].动物医学进展,2013,34(1):6-10.
[4]Lopez C,Sanchez Rubio P,Betran A,et al.Pasteurella multocida bacterial meningitis caused by contact with pigs[J].Braz J Microbiol.2013,44(2):473-474.
[5]Townsend K M,Frost A J,Lee C W,et al.Development of PCR assays for species and type-specific identification of Pasteurella multocida isolates[J].Amer Soci Microbiol,1998,36(4):1096-1100.
[6]Wilkie I W,Harper M,Boyce J D,et al.Pasteurella multocida:diseases and pathogenesis[J].Curr Top Microbiol Immunol,2012,361:1-22.
[7]Wilson B A,Ho M.Pasteurella multocida:from zoonosis to cellular microbiology[J].Clin Microbiol Rev,2013,26(3):631-655.
[8]Harper M,Cox A D,Adler B,et al.Pasteurella multocidalipopolysaccharide:the long and the short of it[J].Vet Microbiol,2011,153(1):109-115.
[9]Robinson A.Antibiotics and resistance hand in hand[J].Can Med Assoc J,1994,150:927.
[10]孔令聪,战 利,赵 晴,等.动物源多杀性巴氏杆菌能耐药性及耐药机制研究进展[J].中国兽药杂志,2012,46(3):52-55.
[11]廖素环,蹇慧,吴雨晴,等.14株猪源致病性多杀性巴氏杆菌的耐药谱分析[J].广西畜牧兽医,2011,27(2):72-74.

